紫色杆菌素基因工程菌的构建与生产途径调控机制的研究进展
2022-07-22储晓婷谢承佳唐苏苏
储晓婷,谢承佳,唐苏苏,江 凌,徐 娴
(1.南京工业大学 生物与制药工程学院 材料化学工程国家重点实验室,江苏 南京 211800;2.扬州工业职业技术学院 化学工程学院,江苏 扬州 225127;3.南京工业大学 药学院,江苏 南京 211800;4.南京工业大学 食品与轻工学院,江苏 南京 211800;5.南京师范大学 食品与制药工程学院,江苏 南京 210046)
紫色杆菌素(violacein)是由微生物产生的次级代谢产物,主要由革兰氏阴性菌生产,在乙醇、丙酮和甲醇等有机溶剂中具有较高的溶解度,并且在轻金属离子和氧化剂(如H2O2)的条件下具有良好的稳定性[1]。紫色杆菌素具有多种生物活性:它可使肿瘤细胞的核酸物质在结构形态上发生改变,对白血病细胞、淋巴瘤细胞和结肠癌细胞等具有很强的抑制效果[2];它通过提高线粒体的膜电位使人胚肺成纤维细胞(MRC-5细胞)和子宫颈癌细胞的细胞系(HeLa细胞)凋亡[3]。在抗菌方面,紫色杆菌素能抑制细菌和真菌的生长,对芽孢杆菌(Bacillussp.)、金黄色葡萄球菌(Staploylococcousaureus)、分枝杆菌(Mycobacterium)及链球菌(Streptococcussp.)等革兰氏阳性菌有明显的抗菌活性,而对革兰氏阴性菌的抗菌活性则相对较低[4-8]。紫色杆菌素具有较强的抗氧化性,与β-环糊精以1∶2的比例形成的络合物可进一步增强紫色杆菌素的抗氧化活性,从而有效防止肝细胞过氧化损伤[9]。这些特性使得紫色杆菌素在食品、生物医药和印染工业等领域[10-12]具有广阔的应用前景。
紫色杆菌素的生物合成途径最先由Pemberton等[13]提出,并由Balibar等[14]完全阐明。该途径由2个色氨酸分子经过由1个基因簇编码的5种酶蛋白催化质氧化缩合而成[15]。在自然界中,产紫色杆菌素的菌株主要包括Chromobacteriumviolaceum[16]、Janthinobacteriumlividum[17]、Pseudoalteromonasluteoviolacea[18]、Duganellasp.[19]和Janthinobacteriumsp.B9-8[20]等,它们可以从海洋、冰川、河流和土壤等环境中筛选获得,具有独特的生存能力[19,21]。虽然这些微生物能够产生紫色杆菌素,但是由于它们存在产物生成速率低、前体物质供应不足以及一些菌株具有致病性等不利因素,特别是紫色杆菌素在这些原始菌株中产量并不高,因此以这些菌株规模化工业生产紫色杆菌素受到限制。
随着生物技术的迅速发展,基于代谢工程和合成生物学技术寻找新策略来提高紫色杆菌素的生产规模和扩大其应用领域成为目前研究的热点。同时,研究者们开始寻找新的微生物,鉴定新的基因簇,构建基因工程菌,以不同底盘细胞异源生产紫色杆菌素,为紫色杆菌素的大规模生产提供新思路。
1 紫色杆菌素合成基因簇的多样性
在不同微生物中,由于基因(簇)的不同,会影响所合成的紫色杆菌素及其衍生物结构、产量等。目前,愈来愈多的紫色杆菌素产生菌被发现,其中部分菌株完成了基因组测序工作,已收录在NCBI数据库中(表1)。这些基因组数据为分析紫色杆菌素合成的相关基因(簇),研究基因结构及在染色体上的分布规律,进一步解析紫色杆菌素的合成机制、基因调控模式及其产生微生物和基因的多样性研究提供了基础。
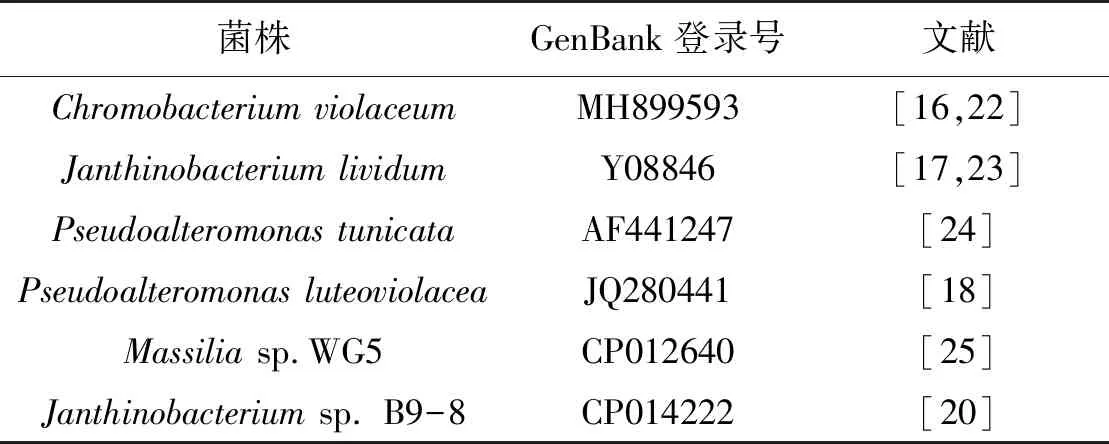
表1 全基因组测序的产紫色杆菌素菌株Table 1 Original strains of violacein-producing by whole genome sequencing
紫色杆菌素的生物合成共涉及6步反应,由5步酶促反应和一步非酶促氧化脱羧反应组成[26],这是由一个基因簇控制的多基因调控合成过程,具体的反应过程相对复杂。通过解析上述已测序的基因组数据发现,控制紫色杆菌素合成的基因簇(vioABCDE)由vioA、vioB、vioC、vioD和vioE这5个基因组成,且它们在同一方向上进行转录。L-色氨酸氧化酶(VioA,由vioA基因编码)在黄素腺嘌呤二核苷酸(FAD)存在时,将L-色氨酸氧化脱氨生成吲哚-3-丙酮酸(IPA);IPA在聚酮合成酶(VioB,由vioB基因编码)的作用下合成IPA亚胺二聚体(CAP);VioE酶(由vioE基因编码)以CAP作为底物生成脱氧紫色杆菌素前体;脱氧紫色杆菌素前体在色氨酸羟化酶(VioD,由vioD基因编码)的羟化作用下生成紫色杆菌素前体(proviolacein),最后在单加氧酶(VioC,由vioC基因编码)的氧化作用下生成紫色杆菌素。同时,VioC酶在NAD(P)H的条件下还会对脱氧紫色杆菌素前体起催化作用,产生紫色杆菌素衍生物——脱氧紫色杆菌素。当微生物缺失VioC时,会产生其他衍生物,如deoxychromoviridans、chromoviridans、oxychromoviridans等[21]。
紫色杆菌素合成基因簇的多样性体现在:①基因簇及其调控序列在基因组上的有无;②不同来源的基因簇序列有一定的差异;③5个组成基因及其调控元件的不同组合方式导致产物的多样化和含量的差异。
Kumar等[27]从锡金喜马拉雅冰川的溪水中分离到1株浅粉红色细菌JanthinobacteriumlividumERGS5∶01,它不产生该属典型的紫罗兰色素,且在基因组中也没有发现紫罗兰素的合成基因簇(vioABCDE)。Gong等[28]筛选获得的菌株Janthinobacteriumpsychrotoleranssp.nov.具有明显区别于该属其他菌株的特征,虽然它与该属的其他菌株具有99%的16S rRNA序列同源性,但经基因组测序注释后发现该菌也缺乏紫色杆菌素合成基因簇,所以该菌株在平板上呈现淡黄色。O’Brien等[29]对1株鲜红色菌株Janthinobacteriumsp.BJB412基因组测序分析后发现紫色杆菌素合成基因簇缺失的情况。从南极冰川河流中分离获得的菌株Janthinobacteriumsp.strain CG3也不产生紫色杆菌素,因为在其基因组上不存在紫色杆菌素合成的关键操纵子vioA[30]。
不同来源紫色杆菌素基因簇虽然都是由5个基因组成,但在基因的组成上具有一定的差异。如,从新疆低温污水中筛选获得的菌株Janthinobacteriumsp.B9-8,它的紫色杆菌素合成基因簇与其他菌株的同源性不高(64%~78%),尤其是与产紫色杆菌素的常用菌株C.violaceum和J.lividum相比,相应的基因同源性较低,仅为64%和66%[20]。Zhang等[31]鉴定了Pseudoalteromonassp.520P1中紫色杆菌素合成的基因簇,经多序列比对后发现,它与P.tunicataD2具有较高的同源性,而与其他紫色杆菌素产生菌(C.violaceum、J.lividum和Duganellasp.B2)的同源性较低,其中基因簇的上游调控序列与P.tunicataD2的同源性仅为57.3%,而与C.violaceum的同源性只有29.4%,在同一基因水平上显示出明显的差异。来源于Duganellasp.B2的紫色杆菌素基因簇则与C.violaceum中的同源性仅65.4%,与J.lividum中的基因簇同源性为83.1%,并且在不同宿主中的产量和结构组成也不同[32]。新发现的菌株D.violaceinigrastr.NI28与D.violaceinigraYIM 31327在16S RNA序列上具有98.8%的同源性,但是其vioA基因却只有88.8%的同源性,虽然这表明NI28与YIM 31327亲缘上比较接近,但是这两株菌仍具有一定的差异[33]。
紫色杆菌素的产量及在粗提色素中的含量组成与所采用的质粒和表达宿主密切相关。如,将来源于Duganellasp.B2的紫色杆菌素基因簇在C.freundii和E.aerogenes中分别表达时,紫色杆菌素在总色素中的含量变少,不及其原始菌中的含量比例;当使用pET32作为表达载体时,不产生紫色杆菌素而产生它的衍生物——脱氧紫色杆菌素,而用pET17b为载体,则能产生大量的紫色杆菌素[32]。Lee等[34]利用紫色杆菌素合成基因簇构建了1个3 125个组合的文库,将其在酵母中表达后发现,不同的基因组合则最终的产物不同,他们检测到了4种主要产物(紫色杆菌素、脱氧紫色杆菌素和它们相对应的前体)外,还有少量的一些其他衍生物(如chromoviridans和oxychromoviridans)。Rodrigues等[35]将来源于C.violaceum的vioABCE基因构建了菌株dVio-1,它能够产生180 mg/L脱氧紫色杆菌素;之后在基因组上整合来源于J.lividum的vioD基因,获得的菌株Vio-4可生产710 mg/L的紫色杆菌素。Segall-Shapiro等[36]设计稳定型启动子TALEsp2,将其与不同核糖体结合位点(RBS)以及vioA、vioB和vioC这3个基因进行组合,再分别构建质粒、整合到基因组上用来合成紫色杆菌素的衍生物——deoxychromoviridans,并根据产物颜色的不同来分析不同调控元件对产物产量的影响。
将不同来源的紫色杆菌素合成基因簇与其他种属菌株中相应的基因进行多序列比对并构建系统发育树(图1)。由此可见,这些不同菌株中的基因簇同源性并不高(64.79%~78.54%),在亲缘关系上,以Chromobacterium属、Pseudoalteromonas属、Janthinobacterium属和Duganellas属这4个簇群存在,由此说明紫色杆菌素合成基因簇存在一定的多样性。虽然目前已发现了一些能够生产紫色杆菌素的微生物,然而这些野生型菌株在培养和传代培养的过程中会以较高频率形成突变体,并且部分菌株具有潜在的致病性。除此之外,微生物体内合成紫色杆菌素的机制比较复杂,涉及多个酶催化反应,相关酶的结构以及多个催化步骤还有待进一步挖掘及研究。
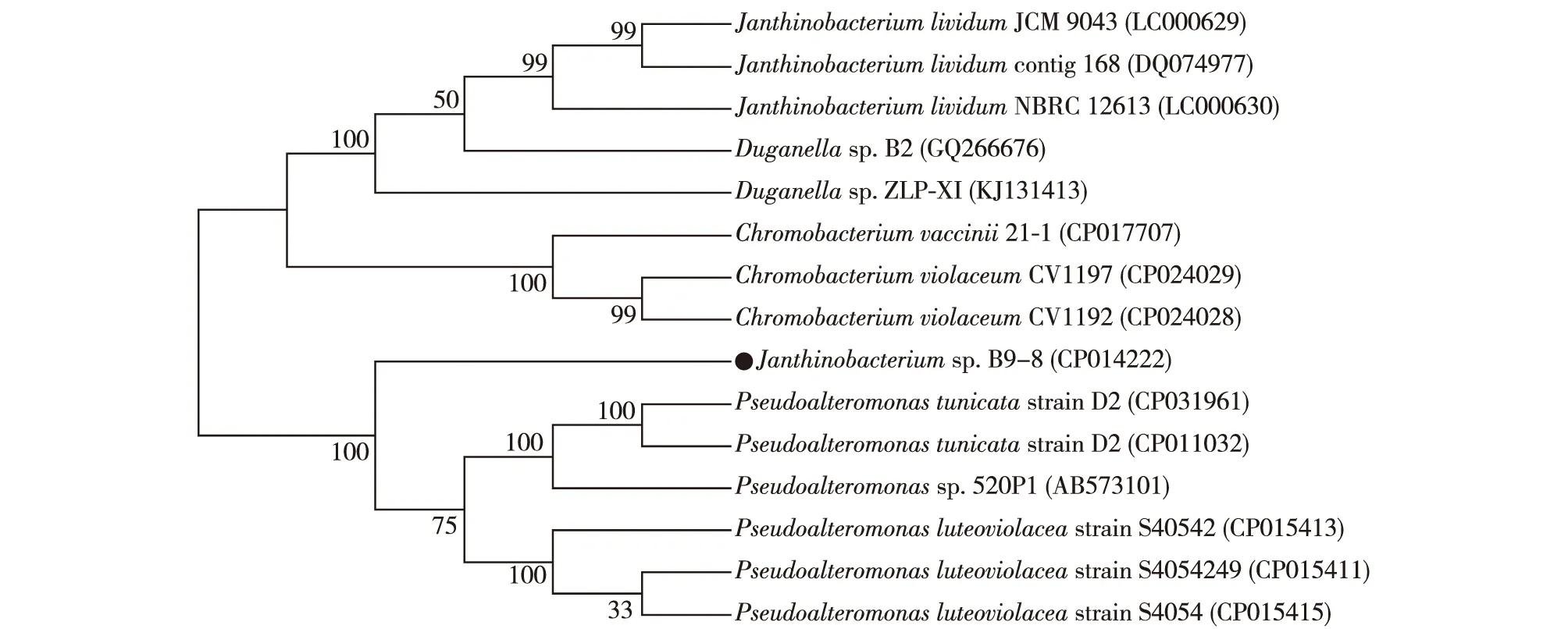
图1 不同来源的紫色杆菌素合成基因簇系统发育树Fig.1 Phylogenetic trees of violacein biosynthesis gene cluster from different strains
在现有紫色杆菌素生产菌株基础上,扩充其他来源的菌株资源,发掘具有独特功能或特性的基因,将较好特性的紫色杆菌素基因进行异源表达,可以获得新的菌株或基因资源,并进一步获得具有较高生产能力的微生物菌株,促进紫色杆菌素的工业化生产,为其进一步开发应用奠定基础。
2 产紫色杆菌素基因工程菌的构建
为了解决原始菌株产量低、产品纯度低的问题,可将紫色杆菌素基因簇导入其他宿主中进行异源表达。进行异源表达时,宿主的选择是关键,因为紫色杆菌素作为抗生素对革兰氏阳性菌具有杀菌作用,而且不同的宿主对于该基因簇的表达和调控存在差异。在一些常用表达宿主中表达这些基因(簇),可实现定向快速合成紫色杆菌素,增加其产量,更有助于解析紫色杆菌素生产中涉及的关键代谢途径。
2.1 产紫色杆菌素大肠杆菌基因工程菌的构建
大肠杆菌具有生长周期短、培养方便、生长要求低、基因工程操作方便、代谢途径清晰、合成调控较为简单和可行等优点,因此在大肠杆菌中人工构建紫色杆菌素合成途径方面的研究成果较多。Pemberton等[13]在1991年将来自C.violaceum的紫色杆菌素合成基因使用粘粒pHC79连接到转座子Tn5的BamHⅠ位点上,形成载体pHC79ΔBamHⅠ::Tn5,将构建成功的载体导入大肠杆菌MM294后成功表达,这是紫色杆菌素基因簇vioABCDE异源表达的最早实例。Fang等[37]将来源于Citrobacterfreundii的紫色杆菌素基因簇通过质粒pACYCDuet-trpE fbr/trpD(pED)和pRSFDuet-vio(pVio)共转化到具有不同色氨酸生产能力的菌株B1~B8中,共产生了8个工程菌株,其中,大肠杆菌B2/pED + pVio产紫色杆菌素产量最高,摇瓶产量为(600±10) mg/L。为了确定紫色杆菌素合成途径的限速步骤,进一步分别过表达紫色杆菌素通路中的vioA~vioE这5个基因后发现,菌株B8/pTRPH1-pVio-VioA和B8/pTRPH1-pVio-VioE的紫色杆菌素生产能力分别提高了14%和29%,从而确定了VioE酶是紫色杆菌素合成途径的关键酶。最终vioE基因过表达的菌株B8/pTRPH1-pVio-VioE在5 L生物反应器中进行补料分批发酵得到产量为98.7 mg/L的紫色杆菌素[38]。Zhang等[31]克隆并表征了Pseudoalteromonassp.520P1的紫色杆菌素基因簇,将基因簇以及上、下游区域的完整序列克隆到载体pET28a中,在大肠杆菌BL21(DE3)中实现了基因簇的成功表达,并产生了紫色杆菌素。为了实现在大肠杆菌K12 DH5α中稳定克隆以及高水平表达紫色杆菌素基因簇,Ahmetagic等[39]和Sarovich 等[40]在大肠杆菌K12 DH5α中使用Packagene©LambdaDNA包装系统构建放线菌Lechevalieiaraerocolonigenes的pPSX粘粒克隆库,分别构建质粒pPSX-vioABCDE和pUC18-vioABCDE,将构建的重组质粒分别转化到大肠杆菌K12 DH5α和K12 LE392中,在PYEA培养基中以及35 ℃条件下进行培养后发现:含pPSX-vioABCDE的大肠杆菌K12 DH5α和K12 LE392中的质粒稳定但紫色杆菌素水平低;含pUC18-vioABCDE的大肠杆菌K12 DH5α和K12 LE392能够合成较高水平的紫色杆菌素,但重组菌株却极不稳定。Bilsland等[41]将来源于J.lividum的vioABCDE以及将vioD敲除后的vioABCE操纵子克隆至质粒pBAT4上,转入大肠杆菌BL21(DE3)中分别实现紫色杆菌素和脱氧紫色杆菌素的生产。
由此可见,为了快速鉴定紫色杆菌素的基因簇及各个基因功能,以大肠杆菌作为表达宿主进行遗传操作是最为简便的,但从生物安全性、前体氨基酸的供应以及产物大量生产等方面综合考虑,大肠杆菌未必是最合适的宿主,因此,也有构建其他原核基因工程菌作为紫色杆菌素生产宿主的相关研究。
2.2 其他产紫色杆菌素原核基因工程菌的构建
谷氨酸棒状杆菌是安全的(GRAS)革兰氏阳性菌,作为经典氨基酸的产生菌具有色氨酸产量高的优势,因此研究者们也将谷氨酸棒状杆菌用作生产紫色杆菌素的代谢工程底盘。Sun等[42]分别从菌株J.lividum和C.violaceum克隆对应基因簇vioABCDE,经PCR扩增后与质粒pEC-XK99E连接分别构建载体pEC-J-vio1和pEC-C-vio1,将重组载体通过电转化至谷氨酸棒状杆菌ATCC 21850中培养,重组菌株ATCC 21850(pEC-J-vio1)在接种培养12 h时加入0.5 mmol/L IPTG诱导,最终产生629 mg/L紫色杆菌素,而菌株ATCC 21850(pEC-C-vio1)的紫色杆菌素产量则达到1 116 mg/L。Jiang等[26]以Duganallasp.B2为vio基因簇的来源,选择具有来自烷烃单加氧酶的Palkb强启动子的质粒pCOM10作为载体,将vio基因簇与质粒pCOM10连接构建了重组载体pCOM10vio,采用电转化法将重组载体分别导入柠檬酸杆菌C.freundii和恶臭假单胞菌P.putida,构建成功的基因工程菌生产紫色杆菌素的产量分别达到了514 mg/L和1 620 mg/L。Domrose等[43]在P.putida中建立了可实现基因簇一步重组克隆的yTREX载体系统,将来自C.violaceumATCC 12472的紫色杆菌素vio基因簇整合到yTREX载体中,将重组体转入大肠杆菌S17-1后,再进一步转移到P.putidaKT2440中,于LB培养基中30 ℃培养,紫色杆菌素最高产量达到105 mg/L。Choi等[44]利用供体质粒pTetSac-ΔpvdD::*将来源于C.violaceum的紫色杆菌素生物合成基因整合到P.putida染色体的靶遗传基因座中,重组P.putida菌株在含有适当抗生素的LB培养基中于30 ℃、200 r/min条件下振荡培养,可以得到紫色杆菌素。
以上研究表明,不同来源的基因簇在不同原核表达宿主中获得了不同产量的紫色杆菌素和其衍生物,但其生物合成在一定程度上并不稳定[32]。基因工程菌的构建,除了针对功能基因或者基因簇的鉴定筛选,表达质粒与宿主的匹配性也至关重要。因此,适合紫色杆菌素的基因异源表达宿主还需进一步探索。
2.3 产紫色杆菌素酵母基因工程菌的构建
作为真核生物的典型代表,酵母菌也是一个常用的工程菌宿主。现在酵母菌可合成一些难以合成的天然产物(如,烯萜类和抗细菌类产物)和多基因参与合成的复杂次级代谢产物。紫色杆菌素的多基因合成途径也同样被引入酵母菌中,Lee等[34]将vioABCDE基因簇与酿酒酵母载体pRS316进行Gibson重组装,将构建完成的载体导入酿酒酵母菌株BY4741培养后,工程菌产生了紫色杆菌素、脱氧紫色杆菌素以及它们各自的前体物质,表明vioABCDE基因簇可在酿酒酵母中成功表达。Zhou等[45]将酵母中的一种组装策略工作流程(MiYA)应用到酿酒酵母的紫色杆菌素合成途径的构建之中,产生了24个菌株,之后设计了3 125个组合的文库后,在其中筛选获得了比较纯的紫色杆菌素产生菌株,最终含量提高了2.42倍[45]。Wong等[46]在解脂耶氏酵母(Yarrowialipolytica)中开发了一种完整且通用的遗传工具包YaliBrick,可简化多基因重复克隆步骤,并扩增了来源于C.violaceum的vioA~vioEDNA片段,与质粒pYaliA1进行Gibson重组装,利用YaliBrick方法进行多次组装克隆后获得pYaliA1-vioDCBAE,转入Y.lipolyticaP01gΔleu中,在30 ℃培养48 h后形成深紫色的酵母菌落,证明了紫色杆菌素途径在解脂耶氏酵母中的成功构建及表达。除此之外,研究者们也开发出其他的模块化和层次化的多基因组装方法(如,VEGAS、yGG等)在酵母中实现了紫色杆菌素的合成,通过菌体本身在平板上呈现颜色的不同就可挑选出所需要的高产菌株[47-48]。
目前大肠杆菌、谷氨酸棒杆菌、柠檬酸杆菌、恶臭假单胞菌和酵母菌等已被用作天然紫色杆菌素的异源合成宿主,实现了紫色杆菌素的定向生产。由此可见,紫色杆菌素工程菌中质粒构建及转化模式主要通过3种方式:①紫色杆菌素基因簇直接克隆至单个质粒,转入宿主中;②紫色杆菌素基因簇以及与紫色杆菌素合成相关基因(如色氨酸合成基因)分别克隆至2个质粒,2个质粒再转入同一宿主中;③紫色杆菌素基因簇以及这5个基因中的vioX(vioA~vioE)克隆至同一个质粒,在合成紫色杆菌素的同时增强5个基因中的一个或几个的表达。大肠杆菌由于遗传背景清楚、载体系统成熟、重组子稳定等优点使其成为紫色杆菌素异源生产的理想宿主菌,但是所构建的重组菌产量普遍较低。谷氨酸棒状杆菌和恶臭假单胞菌比大肠杆菌更利于紫色杆菌素的生物合成,特别是谷氨酸棒状杆菌作为安全的基因工程宿主菌,具有较强的色氨酸生产能力,在紫色杆菌素的异源表达和定向合成中具有巨大优势。但是,紫色杆菌素工程菌的生物合成能力仍需进一步提高,如何实现高产量工程菌株的制备,还有待更深入的研究。
3 紫色杆菌素基因工程菌生产途径的调控机制
将紫色杆菌素合成途径导入宿主菌之后,还需对微生物中紫色杆菌素合成途径进行调控优化,以提高紫色杆菌素的产量和合成效率,主要包括菌株群体感应机制的调节、操纵子与基因顺序、色氨酸前体供给、相关基因突变和发酵培养条件优化等。
3.1 群体感应机制对基因表达的正调节
群体感应机制(QS)是由脂肪酰基高丝氨酸内酯(AHL)作为细胞外群体感应信号,通过激活AHL受体蛋白LuxR调节群体密度依赖性基因的表达。QS系统由转录调节因子CviI和CviR组成,受细胞密度的调控。通过增加细胞密度,可促进AHL的产生并累积,累积的AHL与受体蛋白结合形成复合物后,与紫色杆菌素生物合成操纵子的转录调节位点相互作用单向触发vio操纵子的表达,从而促进紫色杆菌素的产生(图2通路①)[49]。Aye等[50]证实菌株PseudoalteromonasulvaeTC14具有明显的群体感应特征,通过诱导AHL可激发菌株中紫色杆菌素的产生。在C.violaceum中,紫色杆菌素的合成受到细菌群体感应的调节,其调节模式的改变及结果可由色素直观显示,因此C.violaceum菌作为生物传感器被广泛用于QS研究[51]。在野生型C.violaceum中产生的N-己酰高丝氨酸内酯(C6HSL)作为其主要的AHL,Blosser等[52]将含有来自Photorhabdusluminescens的发光基因和来自费氏弧菌的自诱导剂受体基因(luxR)的重组质粒pSB403转入C.violaceumCV0blu菌株培养作为AHL自诱导物的来源,将发酵液进行浓缩萃取后,测定其中的C6HSL,证明重组菌C.violaceumCV0blu(pSB403)中具有多种短链C6HSL的存在,不同剂量的C6HSL和紫色杆菌素含量呈线性相关关系,当C6HSL浓度为20 nmol/L时,紫色杆菌素含量达到饱和。这表明,C.violaceumCV0blu(pSB403)合成的紫色杆菌素在C6HSL的诱导下产生,与C6HSL浓度直接相关。
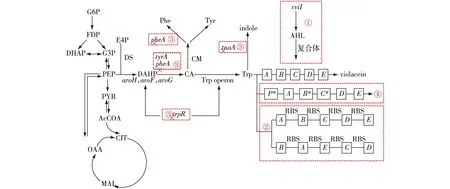
①cviI编码合成AHL合酶触发vio操纵子的表达;②J. lividum原始 vio操纵子序列被具有扩展的完整RBS序列替代以及vio操纵子基因顺序改变;③叉号表示要敲除的与色氨酸积累途径有关的基因;④vio基因及调控基因的突变。G6P—葡萄糖-6-磷酸;FDP—果糖-1,6-二磷酸;DHAP—磷酸二羟基丙酮;G3P—甘油醛3-磷酸;PEP—磷酸烯醇丙酮酸;PYR—丙酮酸;AcCoA—乙酰辅酶A;CIT—柠檬酸;MAL—苹果酸;OAA—草酰乙酸;E4P—4-磷酸赤藓糖丙酮酸;DS—3-脱氧-D-阿拉伯-庚酮糖-7-磷酸合酶 ;DAHP—3-脱氧-D-5可拉伯庚酮糖-7-磷酸;CM—分支酸变位酶;CA—鸟叉酸;Trp—色氨酸图2 紫色杆菌素的生物合成途径和与生产途径调控有关的基因操作Fig.2 Biosynthetic pathway of violacein and the genetic manipulations related to the regulatory pathway of violacein
3.2 vio操纵子与基因顺序对紫色杆菌素合成基因表达的影响
通过改变基因操纵子元件以及基因顺序可以对紫色杆菌素的产量进行调控。Sun等[42]发现J.lividum中的vio操纵子具有重叠基因,这种操纵子结构有可能会阻碍vio基因的异源表达,为了验证这一假设,将重叠基因分开表达,并引入了谷氨酸棒杆菌RBS序列(GAAAGGAGGTTTGGACA)与vio基因重构操纵子单元(图2通路②),将vioABCDE与质粒pEC-XK99E构建载体pEC-J-vio2转入谷氨酸棒杆菌,结果重组谷氨酸棒杆菌ATCC 21850(pEC-J-vio2)的紫色杆菌素产量为815 mg/L,生物量为20 g/L,均高于未在基因之前添加谷氨酸棒杆菌RBS序列的菌株(629 mg/L和15 g/L)。为了研究基因顺序是否影响谷氨酸棒杆菌中的紫色杆菌素产生,Sun等[42]按照vioB、vioA、vioE、vioC、vioD的先后顺序构建了与原始菌株中紫色杆菌素合成基因催化顺序不同的新序列,与质粒pEC-XK99E连接构建质粒pEC-C-vio2后发现,含有此重组子的谷氨酸棒杆菌的生物量和紫色杆菌素产量反而不如原先构建的菌株。这证明了不同基因顺序对谷氨酸棒杆菌内的紫色杆菌素含量具有影响,不合适的基因顺序反而降低了紫色杆菌素产量。Immanuel等[53]针对紫色杆菌素的5个基因设计了人工合成操纵子并利用计算模型进行预测,最后在不同大肠杆菌宿主中验证,最终获得了33.8 mg/L的紫色杆菌素,与野生型操纵子相比产量提高了6倍。Geier等[54]利用1个2A多肽在酵母中构建了1个9个基因表达的多顺反子,实现了β-胡萝卜素和紫色杆菌素的共同合成,同时还发现,多顺反子结构中基因的顺序对途径的合成效率有显著影响:当把紫色杆菌素合成基因放在β-胡萝卜素合成基因之前,培养60 h后的菌株已经显示出明显的棕色表型(类胡萝卜素和紫色杆菌素颜色叠加的效果);如果反过来,将类胡萝卜素基因放在前面,则需要更长的时间才能达到类似的结果。由此可见,操纵子的组成以及其不同顺序的组合,对紫色杆菌素的合成具有一定的影响。
3.3 通过调控色氨酸前体供给途径改变紫色杆菌素合成
增加紫色杆菌素合成的前体物质色氨酸供应,有助于在大肠杆菌细胞工厂中异源生产紫色杆菌素,调控分为两方面:从基因水平上进行改造和外源前体添加。在基因水平上,Fang等[37]通过敲除色氨酸合成途径中的编码色氨酸酶的tnaA基因、编码酪氨酸酶和苯丙氨酸酶的pheA基因以及trpR基因和过表达关键基因TrpEfbr和TrpD,以产生具有不同色氨酸生产力的菌株B1~B8(图2通路③)。随后,将紫色杆菌素合成途径的vio基因簇连接到载体pRSFDuet上后,转入工程菌株B1~B8进行培养,最终菌株B2产生紫色杆菌素产量最高,在摇瓶中产量为(600±10) mg/L,比未调控色氨酸合成途径的对照菌株产量提高4倍。在5 L发酵罐中以葡萄糖作为碳源进行分批发酵,产量达到1 750 mg/L,生产强度达到36 mg/(L·h),这是目前在相同的培养条件下,不额外添加前体色氨酸的最高产量。为了提高色氨酸在细胞内的利用率,Rodrigues等[35]敲除了色氨酸操纵子的阻遏子基因trpR、降解色氨酸的tnaA基因和参与丝氨酸降解的sdaA基因,消除与色氨酸和丝氨酸的降解有关途径从而增加色氨酸的供给,所构建的大肠杆菌dVio-2产色氨酸和丝氨酸水平分别增加了69.6%和21.0%,产生了202.8 mg/L的脱氧紫色杆菌素,在此基础上引入vioD基因将脱氧紫色杆菌素转化为紫色杆菌素,分批发酵最终获得了700 mg/L的紫色杆菌素。
针对基因工程菌株进行外源添加色氨酸的研究较少,Gwon等[55]构建了能够产生紫色杆菌素的重组大肠杆菌,并考察额外添加色氨酸对紫色杆菌素产生的影响。与不添加任何其他补充剂相比,添加0.1 g/L色氨酸时,紫色杆菌素的产量增加了1.23倍。He等[56]发现在培养基中添加色氨酸可以提高具有较低紫色杆菌素产量的大肠杆菌工程菌的生产能力,但是却对具有高产量的菌株有抑制作用。
因此,如何建立针对紫色杆菌素的生产过程进行外源添加色氨酸底物的模式使得底物转化率提高从而获得高产量,还需要进一步研究。
3.4 vio基因及调控基因的突变影响紫色杆菌素的合成
基因本身的突变或改变会导致所表达的蛋白发生变化,从而对紫色杆菌素的合成造成影响。Jiang等[57]将来源于Duganallasp.B2的vio基因簇构建重组载体pCOM10Vio,采用电转化法导入C.freundiiL,作为出发菌株送入太空进行诱发突变,经过96孔板初筛后,再用三角板复筛,最终确定高产诱变菌,所筛选获得的高产菌株紫色杆菌素产量比原始菌株产量提高了50%以上。提取原始菌株、高产菌株和低产菌株质粒进行紫色杆菌素生物合成基因簇序列分析后发现,3种菌株的质粒大小以及基因簇完全相同,因此推测可能是由于染色体上其他位置的调控基因发生变化而导致了“适应性突变”。Ahmetagic等[58]将来源于C.violaceum的基因簇vioABCDE克隆至质粒形成pPSX-vioABCDE,转入大肠杆菌后发现,有少数菌株不仅大量产生紫色杆菌素,而且还保持了高稳定性;对质粒进行测序分析发现,在vioABCDE操纵子的启动子区域中具有单碱基对缺失,形成突变质粒pPSX-VioABCDE opv-1(图2通路④),最终重组菌的紫色杆菌素产量是含有未突变质粒菌株的4倍。Englaender等[59]将编码紫色杆菌素的基因vioB和vioC进行定点突变,获得突变体vioB*和vioC*(图2通路④),将含有突变体的基因簇vioABCDE与质粒pETM6连接,通过多步克隆构建载体pETM6-m-vioA-m-vioB*-m-vioE-m-vioC*-m-vioD和整合载体pTKDP-m-vioA-m-vioB*-m-vioE-m-vioC*-m-vioD;通过整合载体分别将紫色杆菌素基因簇整合到大肠杆菌染色体上的4个基因组基因座LacZ、AtpI-gidB、RecA和YbbD上,并测量蛋白质表达的差异,结果发现,在RecA基因组位点所产生的整合导致突变重组体产生了紫色杆菌素。由此可见,通过基因突变,不仅是基因簇本身,而且还包括基因组上其他调控基因及转座位点的突变都会对紫色杆菌素的合成途径产生一定的影响。
3.5 菌株的培养条件对紫色杆菌素产量的影响
菌株的外部调控也是影响基因工程菌产生次级代谢产物的重要因素,一些发酵条件也影响着紫色杆菌素的产量。为了检测溶氧量(DO)和pH对重组菌株C.freundiipCOM10vio的细胞生长和紫色杆菌素产量的影响,Yang等[60]将DO控制在≤5%、10%±5%、25%±5%和≥40%(空气饱和度)的相对恒定值,且pH控制在5.0、6.0、7.0和8.0进行重组菌的培养,结果发现:当DO约为25%时获得紫色杆菌素产量超过900 mg/L;当DO低于5%时,产量低于100 mg/L;当pH控制在7.0时,紫色杆菌素浓度达到最高,且生产强度为30.6 mg/(L·h);在更高或更低的pH下,紫色杆菌素产量和细胞生物量均降低。Sun等[42]对谷氨酸棒杆菌基因工程菌从温度、培养时间及诱导剂等方面进行条件优化后找到最佳发酵条件,谷氨酸棒杆菌21850在20 ℃条件下发酵18 h,然后添加终浓度为0.5 mmol/L的IPTG进行诱导,得到2 344 mg/L的紫色杆菌素。Lee等[61]构建了含有完整紫色杆菌素生物合成基因簇(vioABCDE)的重组大肠杆菌,通过3种不同培养基(LB、TB和TB添加色氨酸)、不同培养温度(20、30和37 ℃)的比较,最终在含5 g/L色氨酸的TB培养基中,20 ℃发酵培养紫色杆菌素产量较高,为后续进行糖基化修饰紫色杆菌素合成增加水溶性的葡萄糖苷衍生物奠定了基础。
由于紫色杆菌素的产生菌大多是从较冷的环境中筛选获得,因此对于紫色杆菌素的工程菌来说,温度是一个重要的影响因素,除了温度外,IPTG在异源蛋白表达中也起着重要作用,并影响宿主菌株的生产力。紫色杆菌素这种次级代谢产物的产生往往是先满足菌株的生长再合成产物,因此发酵时间也是一个需要考虑的因素。通过这些条件的优化,对紫色杆菌素的产生起到了一定的提高效果。
综上所述,紫色杆菌素的产生除了受到自身基因簇的影响外,还涉及各种因素调控:通过敲除作为前体物质的色氨酸合成途径中的编码色氨酸酶基因,可使紫色杆菌素工程菌生物合成能力在原始基础上大幅度增强。而基因簇及关键基因的突变可对菌落形态以及蛋白质的表达产生差异,从而影响紫色杆菌素的合成能力。目前针对紫色杆菌素工程菌的发酵条件因素的研究较为深入,通过确定最佳培养条件可以实现紫色杆菌素合成基因的高表达。这些调控模式在一定程度上实现了紫色杆菌素产量的优化,我们将上述各种调控方式、产量及生产强度归纳在表2之中,希望能够在将来开发出一些新的调控模式,摸索紫色杆菌素在多酶合成上的调控机制,并进一步提高其产量。
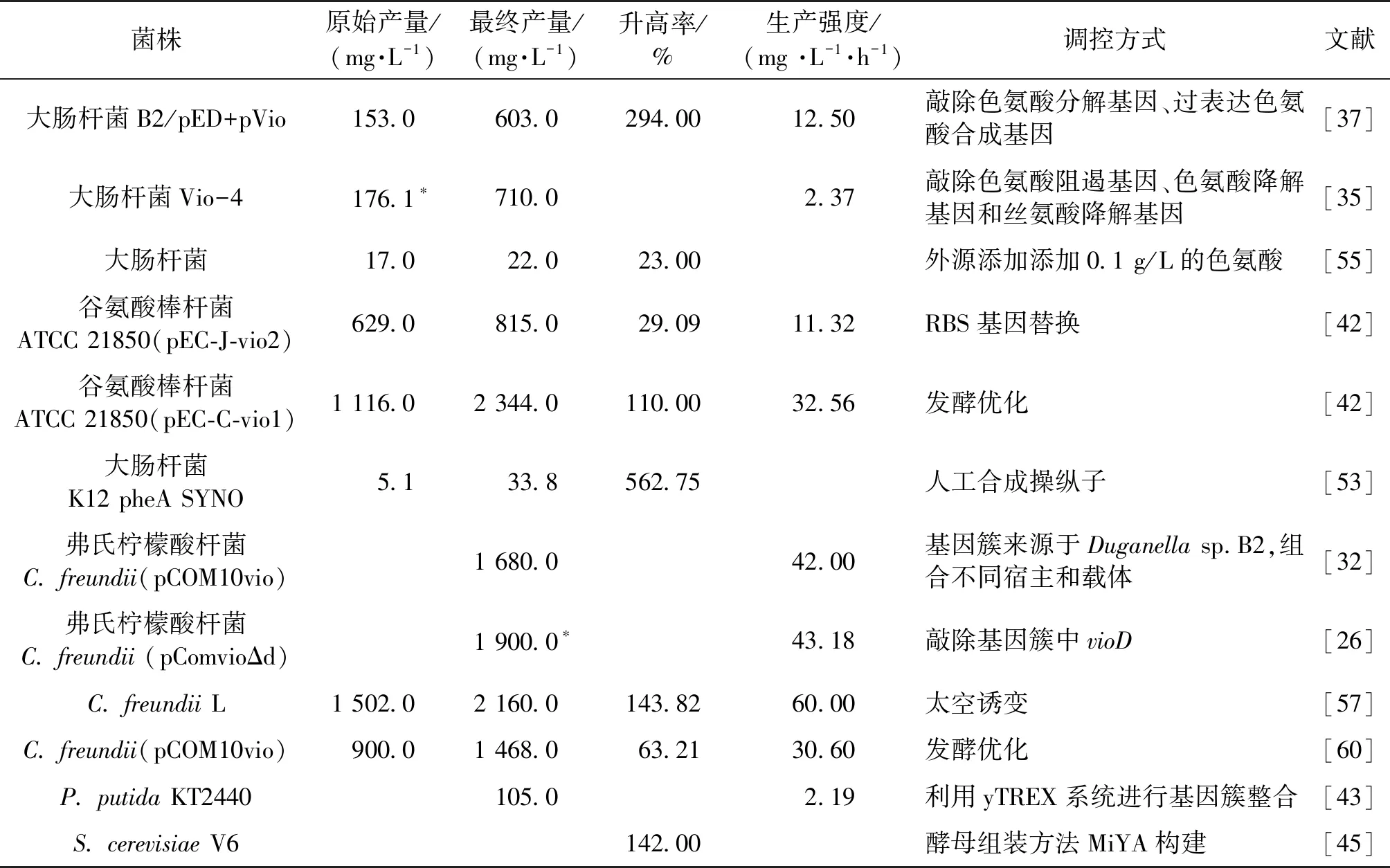
表2 不同基因工程菌株紫色杆菌素及衍生物产量Table 2 Yields of violacein and its derivatives from different genetically engineered strains
4 结论及展望
作为次级代谢产物的紫色杆菌素有多种生物活性,尤其是特有的抗癌和抗菌特性,近年来引起了科学家们的广泛关注。天然产紫色杆菌素的菌株不仅种类丰富,而且在基因组上的基因簇也是呈现多样化的特征。通过基因工程和合成生物学手段构建基因工程菌株是现阶段提高紫色杆菌素产量的有效手段。目前,已成功在大肠杆菌、谷氨酸棒杆菌、柠檬酸杆菌、恶臭假单胞菌和酿酒酵母等常用表达宿主中构建了紫色杆菌素的合成途径。针对这些基因工程菌株,从群体感应机制、操纵子与基因顺序、色氨酸前体供给、相关基因突变和外部培养条件等方面进行调控会对紫色杆菌素的产量产生较大的影响。
紫色杆菌素的生物合成由5个基因组成的基因簇调控合成,由于其来源的多样性和基因之间的差异性,存在多基因协同表达的复杂性和多酶级联反应催化的低效性的问题,因此在细胞和分子水平上的作用机制等仍需进一步深入探索。迄今为止,针对紫色杆菌素的研究工作主要在国外展开,国内针对其研究较少。同时,目前研究都集中在紫色杆菌素本身的合成、结构和功能解析上,针对vio基因簇在多基因合成中所生成紫色杆菌素的副产物衍生物——脱氧紫色杆菌素和羟基紫色杆菌素等研究相对较少,它们的生物活性和合成调控机制尚不明确,这也是需要深入探索的研究方向。
未来,借助多基因和多酶协同催化技术,如无细胞表达体系、蛋白和DNA支架、DNA纳米技术等,解析紫色杆菌素的多酶合成的协同机制,以解决多酶级联反应普遍存在的催化效率低等问题;同时结合多酶催化协同作用和基因簇的多样性,拓展其合成范围,有望能获得具有新型结构或功能的化合物,为紫色杆菌素的应用和研究奠定基础。
