盐炙车前子多糖抗痛风性肾病作用研究
2022-07-22彭东辉张志宏王洋洋孙延平曾元宁王秋红匡海学
彭东辉 ,张志宏 ,王洋洋 ,孙延平,曾元宁 ,,王秋红 ,匡海学
(1.黑龙江中医药大学/教育部北药基础与应用研究重点实验室,黑龙江 哈尔滨 150040;2.广东药科大学中药学院,广东 广州 510006)
车前子为车前科车前PlantagoasiaticaL.或平车前PlantagodepressaWilld.的干燥成熟种子[1],主要含有苯乙醇苷、黄酮、环烯醚萜和多糖等成分,具有清热、利尿、通淋、明目的功效[2]。现代药理研究发现车前子提取物对痛风有一定的治疗效果,能够显著降低患者的血尿酸(UA)水平,同时抑制炎症因子的分泌[3-5]。车前子炮制方法历史悠久,如《幼幼集成》中“青盐水炒七次”。现代炮制规范和药典中,关于车前子炮制方法的一般有3种,即净制、炒制和盐炙。车前子盐炙后,能引药下行而入肾经,泄热利尿而不伤阴,增强车前子的泄热利尿作用[1,6-7]。
痛风性肾病是由于体内UA产生过多或排泄减少,血UA水平长期处于过饱和状态,尿酸结晶沉积于肾脏的肾髓质、间质以及远端集合管,最终导致肾实质性病变,临床主要表现有水肿、尿结石、多尿、夜尿、血、尿UA升高、高血压及肾小管的功能性损害等[8]。车前子多糖具有免疫调节功能,抗氧化和降尿酸作用[9-11],但目前关于盐炙车前子多糖的研究很少。因此,本研究采用水提醇沉法提取盐炙车前子多糖,并采用苯酚-硫酸法、硫酸-咔唑法、考马斯亮蓝法和PMP衍生化法,对多糖进行初步研究;采用腺嘌呤和酵母联用的方法制备痛风性肾病模型大鼠,来研究盐炙车前子多糖的抗痛风性肾病作用,为开发治疗痛风的新型、有效、低毒药物提供依据[12]。
1 材料与仪器
1.1 实验动物
5~6周龄SPF级SD雄性大鼠60只,购于广东省医学实验动物中心,生产许可证号:SCXK(粤)2018-0002,体质量(200±20)g,适应性喂养1周后开展实验。
1.2 药物与试剂
药材:车前子药材产地江西(批号YCB0F000 1),经中药学院李书渊教授鉴定为车前科车前PlantagoasiaticaL.的干燥成熟种子。
试剂:牛血清白蛋白(批号224V055),北京博奥拓达科技有限公司;考马斯亮蓝G-250(批号626M035),天津市光复精细化工研究所;咔唑(批号C10196252),美国 Sigma公司;葡萄糖(Glc批号CHB180929)、岩藻糖(Fuc批号CHB1800602)、阿拉伯糖(Ara批号 CHB180206)、半乳糖(Gal批号CHB180227)、鼠李糖(Rha批号CHB190217)、木糖(Xyl批号CHB180301)、甘露糖(Man批号CHB180615)等单糖标准品均购自成都克洛玛生物科技有限公司,纯度均不低于98%;1-苯基-3-甲基-5-吡唑啉酮(PMP)(批号C10661531),上海麦克林生化科技有限公司;三氟乙酸(批号76-05-1),上海阿拉丁生化科技有限公司;腺嘌呤(批号A6279),Macklin公司;酵母干粉(批号050090),广东环凯微生物科技有限公司;别嘌醇片(国药准字H34021248),合肥久联制药有限公司;尿蛋白定量试剂盒(批号C035-2-1)、尿素氮(BUN)测试盒(批号C013-2)、UA检测试剂盒(批号C012-2)、肌酐(CRE)测定试剂盒(批号C011-2-1),南京建成生物工程研究所;浓硫酸、苯酚、95%乙醇等试剂均为分析纯,水为超纯水。
1.3 主要仪器
UV-1800紫外可见分光光度仪(日本岛津公司);N1300旋转蒸发仪(东京理化株式会社);98-1-B调温电热套(天津泰斯特仪器有限公司);H1750R高速台式离心机(湖南湘仪实验室仪器开发有限公司);ME104电子分析天平(梅特勒-托利多国际贸易有限公司);X-15R台式离心机(美国贝克曼库尔特有限公司);Epoch-2酶标仪(美国Bio-Rad公司);ACQUITYArc超高效液相色谱仪、2489 UV紫外检测器、SunFire 5 μm 4.6×250 mm C18反向柱(美国Waters公司)。
2 方法
2.1 盐炙车前子多糖的提取
取盐炙车前子500 g,先醇提3次,将醇提后的车前子按照料液比(g∶mL)1∶10,热水回流提取3次,每次2 h,过滤,合并提取液,减压浓缩,4℃条件下醇沉过夜,连续醇沉3次,将所得醇沉部分,无水乙醇和丙酮交替洗3次,低温烘干,即得盐炙车前子多糖。
2.2 盐炙车前子多糖总糖、糖醛酸、蛋白含量测定
采用苯酚-硫酸法[13]、硫酸-咔唑法[14]、考马斯亮蓝法[15],测定车前子多糖中总糖、糖醛酸、蛋白的含量。
定量称取105℃干燥1 h的葡萄糖标准品,配制成质量浓度为0.04 mg/mL的标准品溶液。精密量取葡萄糖标准品溶液0.4,0.6,0.8,1.0,1.2,1.4,1.6及1.8 mL分别置于10 mL具塞试管中,加双馏水补充至2.0 mL,再分别加入6%苯酚试剂1.0 mL,浓硫酸5.0 mL,摇匀后常温放置5 min,水浴加热15 min,取出,冷却至室温(25℃)。另取蒸馏水2.0 mL,作空白对照,在490 nm处测定吸光度值(A)。同法操作3次,以Glc含量(μg)为横坐标,以吸光度值为纵坐标,绘制标准曲线,计算回归方程。精确定量称取盐炙车前子多糖,配制成浓度为0.08 mg/mL的样品溶液,按上述测定方法操作,平行测量3次,通过回归方程计算多糖的葡萄糖含量。
精密定量称取半乳糖醛酸对照品,配制成质量浓度为0.2 mg/mL的半乳糖醛酸标准品溶液。精密吸取半乳糖醛酸标准品溶液0.15、0.30、0.45、0.60、0.75 mL,置于10 mL具塞刻度试管中,加水至1.00 mL,另取1.00 mL水作为空白对照,每管中加入浓硫酸5.00 mL,摇匀后,水浴加热25 min,取出,冷却到室温。再加0.1%咔唑乙醇溶液0.20 mL,摇匀,于沸水条件下水浴加热10 min,取出,冷却至室温,加入浓硫酸至10.00 mL,摇匀,在530 nm波长处测定吸光度值。同法操作3次,以半乳糖醛酸含量(μg)为横坐标,吸光度(A)为纵坐标,绘制标准曲线,计算回归方程。精确定量称取盐炙车前子多糖,配制成2.0 mg/mL的盐炙车前子多糖样品溶液,按上述步骤操作,平行测量3次,依据回归方程计算多糖的糖醛酸含量。
精密定量称取牛血清白蛋白BSA-Ⅴ,配制成质量浓度为0.1 mg/mL的牛血清白蛋白BSA-Ⅴ溶液。精密吸取 BSA-Ⅴ溶液 0.10、0.20、0.30、0.40、0.50、0.60 mL,加入到10 mL具塞刻度试管中,补充水至1.00 mL,另取1.00 mL水作为空白对照,每管加入5 mL考马斯亮蓝染液,30℃恒温条件下水浴5 min,取出冷却,在595 nm处测定各管的吸光度。同法操作3次,以牛血清白蛋白BSA-Ⅴ(μg)为横坐标,吸光度(A)为纵坐标,绘制标准曲线,计算回归方程。精确称取盐炙车前子多糖,配制成2.0 mg/mL的盐炙车前子多糖样品溶液。按上述步骤操作,平行测量3次,依据回归方程计算多糖的蛋白含量。
2.3 盐炙车前子多糖单糖组成分析
采用PMP柱前衍生超高效液相色谱法对盐炙车前子多糖进行单糖组成分析[16]。
2.3.1 多糖水解 取多糖样品10 mg,置于10 mL具塞试管中,加入2 mol/L三氟乙酸(TFA)溶液2 mL,加盖密封,于120°C水解160 min,取出放置室温,减压蒸馏除去TFA,期间加入甲醇,反复蒸馏3~4次至无酸味,加入双蒸水2.0 mL溶解。
2.3.2 多糖衍生化 取配置好的标准单糖对照品,混合单糖对照品1.0 mL,分别置于5.0 mL离心管中,依次加入 500 μL 0.5 mol/L PMP 甲醇溶液和 500 μL 0.3 mol/L NaOH溶液,70°C水浴加热60 min,室温放置10 min;再加入500 μL 0.3 mol/L HCl溶液中和,混匀后加入等体积的乙酸异戊酯萃取2次,氯仿萃取1次,取上层(甲醇-水相)过有机滤膜,供UPLC进样分析。液相方法:0~10~25~30 min,B相:20%~23%~24%~30%乙腈,D相:0.1%甲酸水,柱温35℃,检测波长254 nm。
2.4 痛风性肾病大鼠模型的建立、给药及取材
痛风性肾病模型建立[4,12,17]:大鼠适应性喂养后,随机挑选10只作为空白组,其余大鼠分为模型组、阳性药组、盐炙车前子多糖低、中、高剂量组,每组10只,建立痛风性肾病大鼠模型,采用酵母和腺嘌呤联用的方法,给药剂量分别为腺嘌呤100 mg/(kg·d)、酵母10 g/(kg·d),给药体积为10 mL/kg;连续造模给药28 d。
给药:实验开始后,除空白组外,各组大鼠上午灌胃给予腺嘌呤和酵母混悬液,下午灌胃给予阳性药(别嘌醇)和盐炙车前子多糖,给药剂量参考2020年版《中国药典》,结合人与大鼠给药折算比例换算,确定车前子多糖低、中、高剂量组分别为0.135 g/(kg·d)、0.270 g/(kg·d)、0.540 g/(kg·d),阳性药组别嘌醇的给药剂量为50 mg/(kg·d),其余两组给予相同体积蒸馏水,连续给药28 d。
取材:分别于实验正式前、实验开始后的第7天、14天、21天、28天,收集大鼠24 h尿液,4℃,3 000 r/min离心10 min去除沉淀,取上清分装于ep管中。实验进行28 d后,各组大鼠麻醉后,腹主动脉取血,快速取大鼠双肾拍照并称质量。取右肾置于组织固定液中固定。大鼠血液在4℃,3 000 r/min的条件下,离心15 min,取上清液(血清),分装于不同规格的ep管中,尿液和血清均置于-80℃冰箱中保存。
2.5 肾表观特征
28 d后,麻醉取血,快速取大鼠双肾,观察表观特征并取双肾置于白纸上拍照记录。称重,计算肾质量指数。
大鼠的肾质量指数=(双肾质量/大鼠体质量)×100%。
2.6 肾组织病理学
固定液中的肾组织,石蜡包埋并切片,苏木素-伊红(HE)染色,光学显微镜(×100)下观察肾组织病理变化。
2.7 24 h尿蛋白及血生化检测
取离心后的各组血清,按照UA、CRE、BUN这3种试剂盒说明书的具体操作步骤,来检测其含量。将各组大鼠的24 h尿液,按尿蛋白定量试剂盒说明书的步骤方法,检测各个时间段各组大鼠尿液的24 h尿蛋白水平。
2.8 统计学处理
实验数据以xˉ±s表示,采用SPSS22.0统计软件对数据进行统计分析。组间比较采用t检验,P<0.05为差异有统计学意义。
3 结果
3.1 盐炙车前子多糖的提取
按上述方法提取得到盐炙车前子多糖,其中多糖得率为10.90%。
3.2 盐炙车前子多糖总糖、糖醛酸、蛋白含量测定结果
采用苯酚-硫酸法、硫酸-咔唑法、考马斯亮蓝法,测定车前子多糖中总糖、糖醛酸、蛋白的含量,得到葡萄糖标准曲线的回归方程为Y=0.007 2x+0.030 5(R2=0.999 3)、半乳糖醛酸标准曲线的回归方程为Y=0.002x+0.032 2(R2=0.999 5)、蛋白标准曲线的回归方程为Y=0.004 7x-0.0075(R2=0.999 7);经过计算,盐炙车前子多糖中总糖含量为32.27%,糖醛酸含量为30.71%,蛋白质的含量为3.46%。
3.3 盐炙车前子多糖单糖组成分析结果
采用PMP柱前衍生化法,测得7种单糖标准品的标准曲线分别是:Rha:Y=5E+08x+205 889(R2=0.999 5)、Gal:Y=5E+08x+249 206(R2=0.999 8)、Glc:Y=5E+08x+252 490(R2=0.999 8)、Ara:Y=6E+08x-139 516(R2=0.999 9)、Xyl:Y=6E+08x+212 922(R2=0.9997)、Fuc:Y=5E+08x+107768(R2=0.9999)、Man:Y=5E+08x+3E+06(R2=0.999 0)。盐炙车前子多糖主要由 Man、Rha、Gal、Glc、Ara、Xyl、Fuc组成,通过标准曲线计算可知其摩尔比为Man∶Rha∶Gal∶Glc∶Ara∶Xyl∶Fuc=1.07∶1.49∶5.46∶14.94∶14.34∶42.86∶3.63,由此可知,盐炙车前子多糖主要由Glc、Ara和Xyl组成,是阿拉伯木聚糖,与文献报道[18-20]一致。
3.4 肾表观特征
如图1所示,空白组大鼠双肾肾脏组织体积正常,表面呈红褐色,双肾表皮平滑,未见任何异常(图1-A)。模型组大鼠肾脏体积显著增大,表面可见十分密集的小白点,呈石斑样,伴有充血和水肿(图1-B)。阳性药组大鼠肾脏体积增大,表面充血,出现水肿,偶见小白点(图1-C)。多糖低剂量组大鼠肾脏体积增大,表面可见小白点,有水肿和充血(图1-D)。多糖中剂量组大鼠肾脏体积增大不明显,表面可见稀疏小白点,有轻微充血(图1-E)。多糖高剂量组大鼠肾脏体积基本无增大,表面呈红褐色,偶尔可见小白点,基本无水肿和充血(图1-F)。

图1 盐炙车前子多糖对痛风性肾病大鼠双肾表观特征的影响Figure 1 Effect of salt-processed Plantain seeds polysaccharides on the apparent characteristics of both kidneys in gouty nephropathy rats
3.5 肾质量指数
由表1可知,与空白组比较,模型组肾质量指数明显增大,差异有统计学意义(P<0.01);与模型组比较,多糖高剂量组肾质量指数降低十分明显,差异有统计学意义(P<0.01),阳性药组和多糖中剂量组肾重指数降低明显,差异有统计学意义(P<0.05)。结果提示阳性药别嘌醇、多糖中、高剂量均能降低痛风性肾病模型大鼠的肾质量指数。
表1 盐炙车前子多糖对痛风性肾病大鼠肾质量指数的影响Table 1 Effect of salt-processed Plantain seeds polysaccharides on renal weight index in rats with gouty nephropathy(±s,n=10)
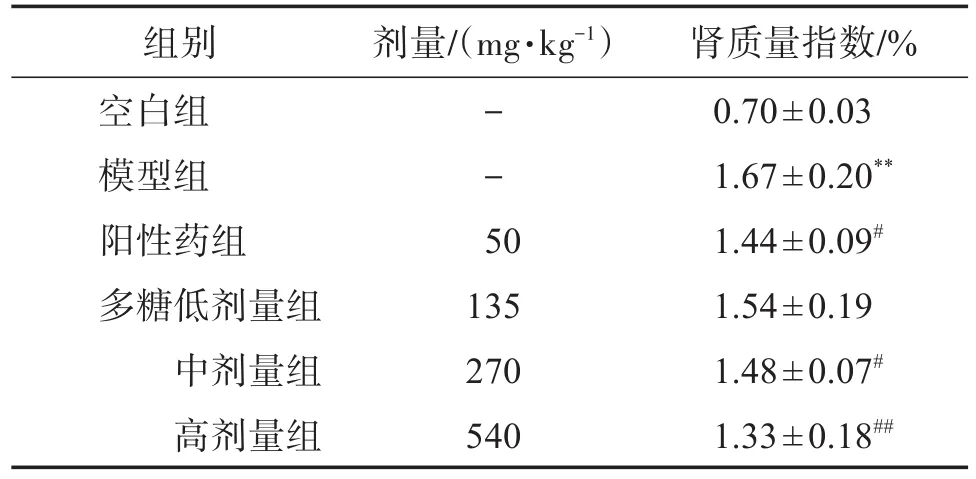
表1 盐炙车前子多糖对痛风性肾病大鼠肾质量指数的影响Table 1 Effect of salt-processed Plantain seeds polysaccharides on renal weight index in rats with gouty nephropathy(±s,n=10)
与空白组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01。
组别空白组模型组阳性药组多糖低剂量组中剂量组高剂量组剂量/(mg·kg-1)--5 0 135 270 540肾质量指数/%0.70±0.03 1.67±0.20**1.44±0.09#1.54±0.19 1.48±0.07#1.33±0.18##
3.6 肾组织病理学
如图2所示,空白组大鼠右肾肾组织结构正常,肾小球形态正常,肾小管上皮细胞排列较为整齐,无炎症细胞浸润现象(图2-A)。模型组大鼠右肾肾组织产生显著病变,肾小球数目减少,肾小管上皮细胞有水肿现象,肾组织中随处可见大量尿酸盐结晶,炎症细胞大量浸润,并伴有肾间质纤维化(图2-B)。阳性药别嘌醇给药组与空白组比较,有较轻程度的肾组织病变,尿酸盐结晶减少,有一定程度的炎症细胞浸润,伴有轻微的肾间质纤维化(图2-C)。多糖低剂量组呈现稍微有点明显的肾组织病变,有较多尿酸盐结晶,有一定程度的炎症细胞浸润,伴有肾间质纤维化(见图2-D)。多糖中剂量组呈现一定程度的肾组织病变,有一定量的尿酸盐结晶,有一定程度的炎症细胞浸润,伴有一定程度的肾间质纤维化(图2-E)。多糖高剂量组呈现轻微程度的肾组织病变,偶见少量的尿酸盐结晶,有轻微的炎症细胞浸润,基本无肾间质纤维化现象(图2-F)。
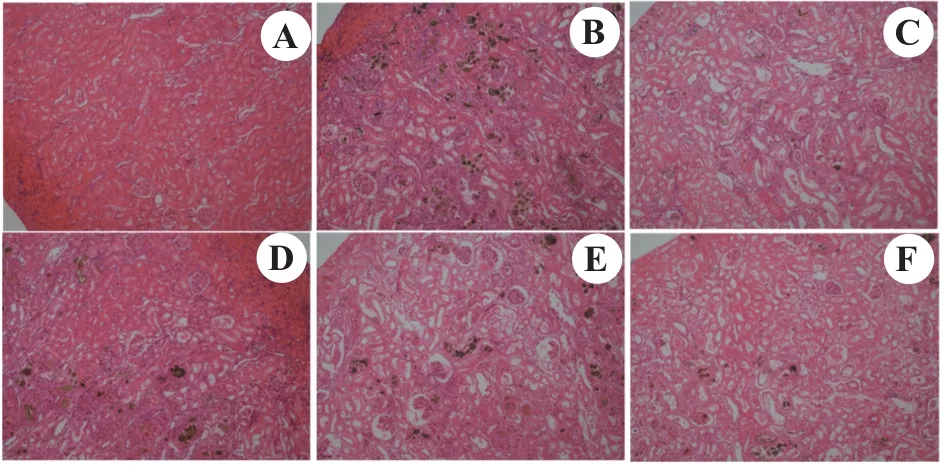
图2 盐炙车前子多糖对痛风性肾病大鼠肾组织病理结构的影响Figure 2 Effect of salt-processed Plantain seeds polysaccharides on renal pathological structure of gouty nephropathy rats
3.7 24 h尿蛋白及血生化检测
由表2可知,实验前,各组大鼠24 h尿蛋白水平差异均无统计学意义(P>0.05)。造模7 d后,与空白组比较,模型组的尿蛋白水平有一定的升高趋势,但差异无统计学意义(P>0.05);造模14 d后,模型组的尿蛋白水平显著升高,与空白组比较,差异有统计学意义(P<0.01);造模21 d后,与空白组比较,模型组24 h尿蛋白水平,持续升高,差异有统计学意义(P<0.01);阳性药组、多糖高剂量组与模型组比较,24 h尿蛋白含量有所降低,差异有统计学意义(P<0.05);造模28 d后,模型组24 h尿蛋白水平与空白对照组相比,差异有统计学意义(P<0.01);阳性药组、多糖中、高剂量组24 h尿蛋白水平显著降低,与模型组比较,差异均有统计学意义(P<0.01)。见表2。
表2 盐炙车前子多糖对痛风性肾病大鼠24 h尿蛋白水平的影响Table 2 Effect of salt-processed Plantain seeds polysaccharides on 24-hour urinary protein level in rats with gouty nephropathy(±s,n=10)

表2 盐炙车前子多糖对痛风性肾病大鼠24 h尿蛋白水平的影响Table 2 Effect of salt-processed Plantain seeds polysaccharides on 24-hour urinary protein level in rats with gouty nephropathy(±s,n=10)
与空白组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01。
组别空白组模型组阳性药组多糖低剂量组中剂量组高剂量组剂量/(mg·kg-1)24 h尿蛋白/(mg·L-1)--5 0 135 270 540 0 d 27.50±6.44 26.13±3.46 26.10±4.09 25.73±6.98 26.46±3.50 24.09±6.17 7 d 24.77±8.59 41.54±11.76 34.68±8.47 39.26±8.89 36.87±7.62 33.25±8.07 14 d 24.97±7.06 63.55±5.88**54.53±6.98 56.53±6.76 54.84±7.49 49.66±11.15 21 d 29.08±4.37 90.34±10.02**74.09±6.09#84.39±11.50 76.25±11.38 72.86±8.97#28 d 27.48±5.65 122.94±14.94**84.47±6.00##102.90±8.68 78.40±10.53##68.60±10.56##
由表3可知,模型组血清中UA、CRE、BUN水平显著升高,与空白组比较,差异有统计学意义(P<0.01);阳性药组、多糖中、高剂量组血清中UA、CRE、BUN水平降低,与模型组比较差异有统计学意义(P<0.05或P<0.01)。见表3。
表3 盐炙车前子多糖对痛风性肾病大鼠血清中UA、CRE和BUN水平影响Table 3 Effect of salt-processed Plantain seeds polysaccharides on the levels of UA,CRE and BUN in serum of gouty nephropathy rats(±s,n=10) c/(μmol·L-1)

表3 盐炙车前子多糖对痛风性肾病大鼠血清中UA、CRE和BUN水平影响Table 3 Effect of salt-processed Plantain seeds polysaccharides on the levels of UA,CRE and BUN in serum of gouty nephropathy rats(±s,n=10) c/(μmol·L-1)
与空白组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01。
组别空白组模型组阳性药组多糖低剂量组中剂量组高剂量组剂量--5 0 135 270 540 UA 74.52±11.30 142.42±31.54**93.94±20.58##115.15±24.16 87.88±20.77##82.83±30.70##CRE 56.05±10.58 106.59±26.58**80.82±13.88#85.75±25.43 80.58±6.97#71.58±7.84##BUN 18.27±3.01 47.75±6.44**35.90±4.91##38.98±7.48#33.62±5.61##26.36±7.14##
4 讨论
在本研究中,通过水提醇沉法,提取得到盐炙车前子多糖,多糖得率为10.90%。采用苯酚-硫酸法、硫酸-咔唑法、考马斯亮蓝法,测得盐炙车前子多糖中总糖含量为32.27%、糖醛酸含量为30.71%、蛋白质的含量为3.46%。采用PMP衍生化法对多糖进行单糖组成分析,测得盐炙车前子多糖主要由Glc、Ara和Xyl组成,其摩尔比为Man∶Rha∶Gal∶Glc∶Ara∶Xyl∶Fuc=1.07∶1.49∶5.46∶14.94∶14.34∶42.86∶3.63,是一种阿拉伯木聚糖。
痛风性肾病是由于嘌呤代谢紊乱,体内血UA水平过高,UA结晶沉积于肾脏的肾髓质、间质以及远端集合管,引发肾实质性病变。目前临床上治疗痛风性肾病的主要药物也多为降UA或抑制UA生成的药物,来控制血UA的水平,进而缓解症状[21-23]。本研究结果显示,与模型组比较,阳性药组、盐炙多糖中、高剂量组血UA的水平均显著降低。
多种肾脏损伤疾病可表现为尿蛋白阳性,而尿蛋白本身又能加重肾小球硬化和肾间质纤维化的进程,进一步诱导肾脏损伤。因此常用尿蛋白的水平来判断肾脏是否有病变[24]。血清中的BUN和CRE是考察肾功能是否正常的重要指标。BUN是人体蛋白代谢的重要产物,肾脏是其主要的排泄器官,当肾功能受损时,BUN的浓度会升高。CRE是肌肉代谢的最终产物,可通过肾小球滤过排出体外,人体每日体内产生的肌酐,一般不受尿量影响可全部随尿排出。当肾功能衰退时,血清中CRE含量升高。因此,如果BUN和CRE二者同时升高,说明肾脏有严重损害[25-26]。本研究结果显示,模型组大鼠24 h尿蛋白水平,随造模时间的延长不断升高,血清中BUN和CRE的水平显著升高,与空白组比较,均有统计学意义。与模型组比较,阳性药组、盐炙车前子多糖中、高剂量组大鼠24 h尿蛋白水平,血BUN和CRE的水平均有所降低,具有统计学意义。综上所述,结合肾脏组织表观特征和肾组织病理变化观察结果表明,阳性药别嘌醇、盐炙车前子多糖可以改善肾小球滤过功能,降低痛风性肾病模型大鼠的血UA、BUN和CRE的水平,改善肾功能。提示盐炙车前子多糖对痛风性肾病大鼠具有预防作用,为盐炙车前子多糖用于治疗痛风性肾病奠定了基础。
