基于药物警戒视角的河南省中药不良反应实证分析
2022-07-22王干一焦筱雨方舒婷刘媛媛安康熙李佳颖彭仁贤饶惠霞
王干一,焦筱雨,方舒婷,刘媛媛,安康熙,李佳颖,彭仁贤,饶惠霞
(1.河南省药品评价中心,河南 郑州 450018;2.河南中医药大学管理学院,河南 郑州 450046;3.广东药科大学医药商学院,广东 中山 528000)
我国《药品管理法》第12条规定,国家实施药物警戒制度。近年来国家对药物警戒日益重视:2018年发布的《关于药品上市许可持有人直接报告不良反应事宜的公告》中的“还应包括其他与用药相关的有害反应”,扩大了药品不良反应监测的范围,涉及到了药物警戒的内容;2019年新修订的《药品管理法》提出国家应建立药物警戒制度,正式提出从药品不良反应监测向药物警戒过渡;2021年12月1日开始实施《药物警戒质量管理规范》,标志着我国药物警戒制度进入落地实施阶段,并对落实持有人的主体责任做出了新规定。河南省有深厚的中医药群众基础,由于中成药、代煎药的使用提升了中药的便捷性,所以目前中药的使用范围更加广泛,基于药物警戒视角的中药不良反应现状分析与实证研究亟待开展。目前研究大多通过对国外药物警戒进行分析,为我国药物警戒发展提出相应建议,或是以某一医院的不良反应报告进行回顾性分析,为药品使用规避风险。另外,大多研究关注于发达省份,以河南省为研究对象的药物警戒研究目前较少。本文从药物警戒视角分析河南省中药的药物不良反应(adverse drug reaction,ADR)现状,综合国内外药物警戒经验和实证分析,针对河南省中药ADR监测存在问题提供建议。
1 药物警戒概述
WHO对药物警戒的界定是发现、评估、理解和预防各种不良反应或与其他任何可能与药物问题有关的科学研究与活动[1]。2004年药物警戒理念被引进中国以来,我国的药物警戒工作逐步推进[2]。健全的药物警戒体系由药物警戒法律法规制度、组织结构、监测系统及风险管理4部分组成[2],根据已有研究,本文比较分析了美国、欧盟、日本的药物警戒体系,见表1。可见,相较于欧盟、日本等国家的药物警戒体系建设,我国起步较晚,需进一步借鉴国外先进经验。具体地,法律法规方面,我国正逐步由概括性论述向针对性规范转变,相关规范强调全流程药物警戒的同时,需重点关注药品上市后安全性的再审查、再评价问题[3-4],并加强基于药品上市许可人制度的安全责任分配体系研究[5]。组织机构方面,大部分相关机构仅被动上报,对报告数据利用不够且分析缺乏针对性[6],部门间应加强在职能与流程上的逻辑关系、共享药物警戒信息[7-8]。监测系统方面,我国已从被动的自发报告系统(spontaneous reporting system,SRS)转变为主动的医院药物警戒系统(Chinese hospital pharmacovigilance system,CHPS)[9],有利于提高医院上报的ADR数量与质量[10]。风险管理方面,我国的药品风险管理缺乏部门间风险信息沟通和监测数据整合利用,有待提升针对性。因此,本研究基于数据可及性较强的组织机构与风险管理两个方面开展相关研究,旨在为提升河南省的药物警戒水平提供参考。

表1 国内外药物警戒的发展状况Table 1 Development status comparison of pharmacovigilance at home and abroad
2 数据来源与方法
本文数据来源于河南省药品评价中心,主要基于2019年12月份的2 174例中药ADR报告进行数据分析。利用SPSS软件进行数据分析,聚焦于组织机构与风险管理两个方面,具体对报告单位、报告人职业和报告及时性等进行描述性统计分析,再采用χ2检验、z检验和二元logistic回归分析对数据进行统计分析。P<0.05认为差异有统计学意义。
3 结果
3.1 描述性分析
2 174例不良反应案例基本情况:根据报告中报告类型的两个维度是否新发以及严重程度的分类(即一般、严重),本研究将ADR报告严重情况分为4个等级,即新的一般、已知一般、新的严重与已知严重。新发(即报告类型为新的)ADR共1 016例,占46.73%;严重(即报告类型为严重)ADR共146例,占6.72%,见表2。2 174例中,中药饮片(中药颗粒)219例,占10.1%,其中126例为新发ADR,严重ADR仅占3例;其他中成药1 955例,占89.9%,其中890例为新发ADR、143例为严重ADR。可见,相对于中成药,传统的中药饮片(中药颗粒)更为安全。

表2 ADR报告严重情况分级Table 2 Severity rating of ADR reports n(%)
风险管理方面,需注意口服给药和静脉给药的不良反应发生率较高。口服给药共1 391例,占63.98%,静脉给药有646例,占29.72%,外用和其他方式分别有68例和69例,占3.13%和3.17%。与已有研究结果一致,口服给药不良反应多为恶心、腹泻等症状,而静脉给药的不良反应多为全身性反应、皮疹与瘙痒等皮肤损害症状,所以应进一步加强中药注射剂的质量再评价[14-15]。此外,2 174例不良反应案例中有420例是属于临床不合理用药导致的,占比19.3%。其中活血化瘀类中药注射剂所致的不合理用药现象占大多数,因此医生需谨慎使用;对于患者而言,需警惕不辨证论治便乱用中药的不合理用药现象。
组织机构方面,医疗机构中的工作人员为ADR报告主体。医疗机构共上报2 013例,占92.60%;而经营企业与个人分别上报157例(占7.22%)、4例(占0.18%)。上报人员方面,医生、药师、护士为不良反应报告的上报主体,分别占63.15%、19.64%与11.78%;包括药店负责人、营业员等在内的其他职业人员仅占比5.43%。
3.2 报告及时性与不同职业上报及时率的比较
我国法律规定,新发严重的不良反应事件应在发现之日起15天内上报,一般药品不良反应的报告期限是发现之日起30天内。ADR报告类型为一般的报告中,及时报告比例为93.11%;ADR报告类型为新的、严重的报告中及时上报比例为82.28%。见表3。

表3 4个等级报告及时性情况Table 3 The timeliness of ADR reports
报告人不同职业上报的及时性差异无统计学意义(χ2=2.711,P>0.05,见表4),因此尚不能认为医生、药师、护士、其他人员报告的及时性有差别。

表4 不同职业报告人上报的及时性比较Table 4 The timeliness comparison of different ADR reporters
3.3 不同报告主体关联性评价的差异分析
不同报告主体对ADR的关联性评价中很可能、可能的比例均较高,见表5-6。由于存在报告人、报告单位和市级关联性评价均为空的情况,因此剔除此部分缺失值样本,对剩余1 924个样本进行描述统计与z检验。采用z检验对不同主体关联性评价的差异进行分析,结果显示报告人与报告单位的评价差异无统计学意义(P>0.05),但市级的评价与报告人、报告单位的评价差异均有统计学意义(P<0.05)。可见,现行报告制度下,报告单位与报告人的评价一般高度一致,而市一级的评价与二者均有差异,可能的原因如下:一是更高级别的评价者更有消除不确定性的能力,因为到了市一级已经没有“待评价”与“无法评价”等评价存在;二是报告单位的评价有重复报告人评价的嫌疑,如果事实如此,则在报告流程上也许报告单位评价环节的存在稍显冗余。因此,建议加强对首次报告人的培训,实行首次报告人负责制;同时,建议简化报告流程,实行信息系统申报时建立警戒线,使不良反应依严重程度与是否新出现得到不同程度的关注。

表5 不同报告主体的关联性评价情况Table 5 The relevance evaluation of different ADR reporters

表6 不同报告主体评价的差异性分析Table 6 Comparison analysis of the ADR evaluation from different reporters
3.4 中药ADR严重与否的logistic回归分析
以中药ADR是否严重作为被解释变量。根据已有研究,将人口统计学变量(性别、年龄),既往史(即有无过敏史、饮酒史、吸烟史、肝肾疾病等)、给药途径(注射给药、非注射给药)作为解释变量,因为这些变量会对ADR是否严重产生影响。赋值情况见表7。因变量中药ADR是否严重是二分类变量,因此采用logistic回归对数据进行分析。将人口统计学变量(性别、年龄),既往史(即有无过敏史、饮酒史、吸烟史、肝肾疾病等)、给药途径(注射给药与否)作为解释变量进行logistic回归分析。
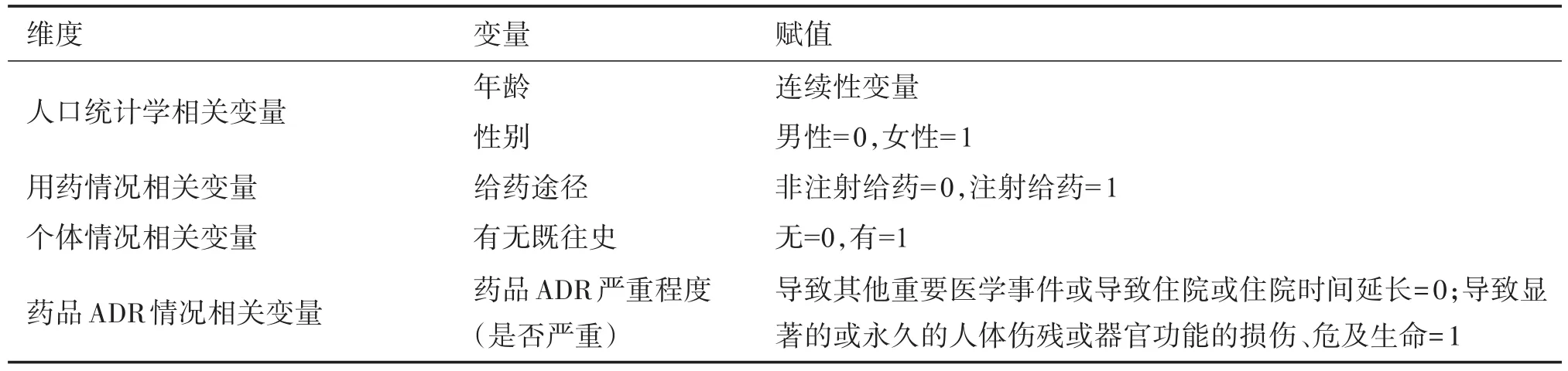
表7 二元logistic回归的变量赋值Table 7 Explanation of variables of binary logistic regression analysis
Logistic回归分析结果见表8。最终纳入模型的解释变量包括人口统计学相关变量(年龄),用药情况相关变量(给药途径是否是注射给药),个体情况相关变量(是否有既往史)。根据模型综合系数检验结果的P值小于0.01,证明logistic回归模型合理,即解释变量对中药ADR严重程度影响有显著意义。既往史与注射途径给药是严重ADR的危险因子;年龄与性别无显著性影响。注射给药的OR值为9.21,这表明注射给药发生更严重ADR的概率是其他给药途径的9.21倍。注射给药包含静脉注射、泵内注射等形式,是患者主要的治疗手段,因此医务人员在使用注射途径治疗疾病时,应密切关注患者情况、及时处理ADR,减轻ADR严重程度。既往史方面,患者具有过敏史、饮酒史、吸烟史、肝肾疾病等情况的更容易发生严重ADR。有既往史对应的OR值为3.01。这表明患者自身身体状况与所患基础疾病等因素是发生严重ADR的重要因素,可见诊治患者时应全面考虑患者自身健康情况等个体异质性。
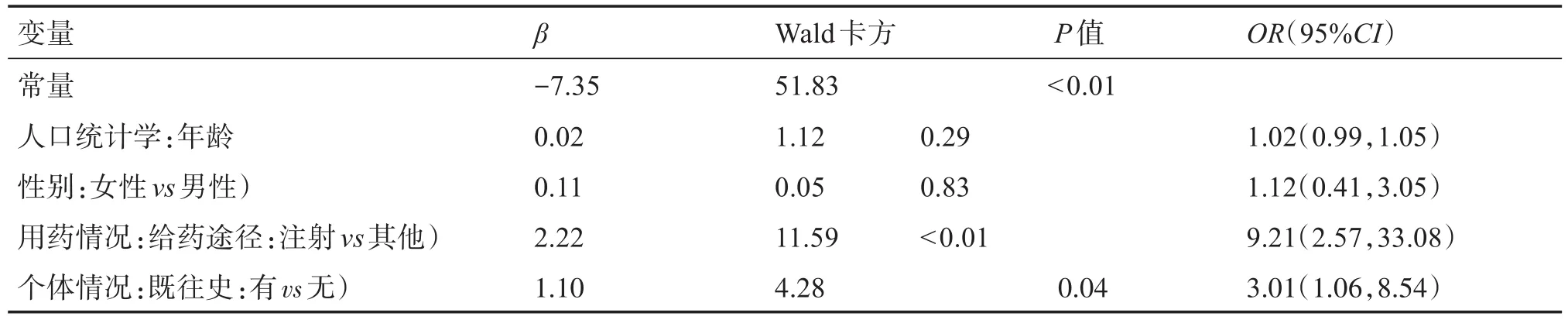
表8 二元logistic回归分析的结果Table 8 Results of binary logistic regression analysis
4 讨论
针对结果分析,重点关注上报者的专业性、患者既往史与给药途径等方面进行风险管理。第一,上报者的专业性是关联性评价合理性的有力保证,市关联性评价更集中于可能和很可能,没有待评价和无法评价,这可能是因为医疗机构或经营企业对不良反应认知不足,无法判定,因此应提升首次报告人的专业性以及时反应避免严重ADR造成的医疗事故。第二,患者个体方面,有既往史的患者应该作为ADR监测的重点人群。第三,传统上,中药的给药途径是口服等非注射途径,根据数据分析可知注射给药容易产生严重ADR,因此对需要重点关注的患者应谨慎使用注射给药途径,尤其需警惕活血化瘀类等中药注射剂的使用,减少乱用中药导致ADR的现象。
组织机构方面,中药不良反应报告以医疗机构为主要报告单位、生产经营企业报告较少,职能部门之间缺乏有效的信息沟通。首先,鉴于药物警戒涵盖药品全生命周期,因此应针对药品监管环节,借鉴国外先进经验,对各上报单位进行量化考评;进一步明确相关部门的职责,加强生产经营企业报告的主体责任,增加其报告数量。其次,充分发挥医疗机构的优势。针对医疗机构目前存在的影响不良反应报告质量的因素,医疗机构应该优化报告方式并将报告质量计入绩效考核项目中,鼓励医务人员积极上报;向生产企业反馈ADR信息、积极推进哨点联盟建设,探索主动监测模式。最后,建议加强药物警戒相关宣传培训,提升药品全产业链相关人员的药物警戒意识与能力,同时依托信息化提升医院间患者既往史等相关信息的互联互通水平。总之,应从组织机构与风险管理两方面着手提升河南省的中药药物警戒水平。
