核桃青皮提取物对CNE-2细胞增殖、迁移和侵袭的影响
2022-07-22胡丽霞
陈 辰,胡丽霞
(武汉市第一医院,湖北 武汉 430000)
核桃JuglansregiaL.归于桃属植物,广泛分布于世界各地,不仅使用干种子(坚果),还使用绿色核桃、贝壳、树皮、绿壳和叶子,这些已用于化妆品和制药行业[1]。核桃在传统医学中广泛用于治疗皮肤炎性反应、多汗症、溃疡及止泻、抗蠕虫、防腐和收敛等[2],在一些欧洲国家,干核桃叶用于制备输液[3]。核桃青皮又称青龙衣,是植物核桃未成熟果实的外果皮,其为核桃果实收获后的废弃物,原料来源丰富。核桃在多种癌中均具有一定的抗癌功能,但其在鼻咽癌中的功能及机制尚未完全清楚。虽已有大量研究验证miRNA在鼻咽癌中具有调控功能,但其中miR-564与鼻咽癌进展中的关系知之甚少。本研究拟以鼻咽癌细胞系CNE-2为研究对象,观察核桃青皮提取物对鼻咽癌细胞增殖、迁移、侵袭及miR-564、TPX2表达的影响。
1 材料与方法
1.1 材料 核桃(产地四川广元)。人鼻咽癌细胞系CNE-2(中国科学院上海细胞库)。DMEM培养基(美国Thermo公司);胎牛血清(杭州四季青生物工程材料有限公司);MTT(北京康为世纪生物科技有限公司);胰蛋白酶(美国Sellect公司);反转录试剂盒(日本TaKaRa公司);PVDF膜(瑞士Roche公司);SDS-PAGE 试剂盒(北京索莱宝科技有限公司);ECL发光液(上海碧云天生物技术有限公司);双荧光素酶报告基因检测试剂盒(美国Promega公司);Matrigel基质胶、Transwell小室(美国Corning公司)。
1.2 方法
1.2.1 核桃青皮提取物制备 将核桃剥去核桃青皮,在50 ℃下烘干,粉碎至90目筛,按照粉料比1∶15用无水甲醇在65 ℃下回流提取3次,减压浓缩提取液至膏状,即得,配制成100 mg/mL,再稀释至20、40、80 μg/mL。
1.2.2 细胞培养与分组 将CNE-2细胞用DMEM培养基(10%胎牛血清+1%青链霉素)培养,置于37 ℃、5% CO2恒温培养箱中培养、传代,随机分为对照组和核桃青皮提取物组(0、20、40、80 μg/mL),与对数增殖期的CNE-2细胞共培养48 h,选取40 μg/mL组细胞作为核桃青皮提取物组。采用脂质体法将miR-564 mimics、miR-NC转染CNE-2细胞,作为miR-564 组、miR-NC组;将anti-miR-564、anti-miR-NC转染CNE-2细胞,再用40 μg/mL核桃青皮提取物处理后,作为核桃青皮提取物+anti-miR-564组、核桃青皮提取物+anti-miR-NC组。
1.2.3 MTT法检测细胞抑制率 将细胞密度调至1.0×105/mL,加入MTT溶液(5 g/L)和DMSO(0.5 g/L)反应,结束后在490 nm波长下检测吸光度(A),计算细胞抑制率,公式为细胞抑制率=[1-A490样品/A490对照]×100%。
1.2.4 Western blot检测TPX2、CyclinD1、p21、p27、MMP-2、MMP-9、MMP-14蛋白表达 将细胞充分裂解后提取总蛋白,作为蛋白电泳的上样模板,电泳结束后用转膜仪将蛋白转移至PVDF膜,一抗(兔单克隆TPX2、CyclinD1、p21、p27、MMP-2、MMP-9、MMP-14抗体,1∶500~1∶2 000)稀释液孵育(4 ℃)过夜,二抗(辣根过氧化物酶标记的二抗,1∶500)稀释液(37 ℃)孵育1 h,采用电化学发光试剂盒对膜进行显影曝光。
1.2.5 细胞迁移、侵袭测定 采用伤口愈合测定法评估细胞迁移。细胞在6孔板中培养,每孔5×104个,达到90%~95%汇合后以无菌塑料微量移液器吸头刮擦单层细胞,在标准条件下培养24 h。培养结束后,在显微镜观察伤口恢复情况,计算划痕愈合率。
采用Transwell实验检测细胞的迁移和侵袭。先将细胞用不含血清的培养基培养12 h,密度调至1.0×105个/mL,取100 μL涂抹到小室的聚碳酸酯膜上表面,再取600 μL含血清的培养基置入小室(表面涂抹一层基质胶),在37 ℃下培养12 h,缓缓移出小室,拭去膜上表面的多余细胞,甲醇固定,结晶紫染色,将膜下表面朝上置于载玻片进行封片,在显微镜下计数,取平均值。
1.2.6 qRT-PCR检测miR-564、TPX2 mRNA表达 提取总RNA,合成cDNA,在-20 ℃下保存,作为qRT-PCR实验模板。以U6、GAPDH为内参,采用2-△△Ct法检测miR-564、TPX2 mRNA表达。
1.2.7 双荧光素酶报告基因检测 通过在线靶基因预测miRcode预测miR-564的潜在结合靶标,将预测到的TPX2-3 UTR互补结合位点[委托深圳华大基因设计合成TPX2-3 UTR WT(含有结合位点的TPX2-3 UTR片段)]和TPX2-3 UTR MUT(不含有结合位点的TPX2-3 UTR片段)克隆至荧光素酶报告载体psiCHECK2,构建荧光素酶报告基因载体质粒。按双荧光素酶报告基因检测试剂盒说明书要求操作,记录萤火虫和海肾的荧光素酶发光强度,以两者比值表示细胞荧光活性。

2 结果
2.1 核桃青皮提取物对CNE-2细胞增殖的影响 与对照组比较,20 μg/mL组细胞抑制率升高,CyclinD1蛋白表达降低,p21、p27蛋白表达升高(P<0.05);与20 μg/mL组比较,40 μg/mL组细胞抑制率升高,CyclinD1蛋白表达降低,p21、p27蛋白表达升高(P<0.05);与40 μg/mL组比较,80 μg/mL组细胞抑制率升高,CyclinD1蛋白表达降低,p21、p27蛋白表达升高(P<0.05),见图1、表1。

图1 各组CNE-2细胞增殖相关蛋白表达
表1 核桃青皮提取物对CNE-2细胞增殖的影响
2.2 核桃青皮提取物对CNE-2细胞迁移、侵袭的影响 与对照组比较,20 μg/mL组细胞划痕愈合率、迁移数和侵袭数、MMP-2、MMP-9、MMP-14蛋白表达均降低(P<0.05);与20 μg/mL组比较,40 μg/mL组细胞划痕愈合率、迁移数和侵袭数、MMP-2、MMP-9、MMP-14蛋白表达均降低(P<0.05);与40 μg/mL组比较,80 μg/mL组细胞划痕愈合率、迁移数和侵袭数、MMP-2、MMP-9、MMP-14蛋白表达均降低(P<0.05),见图2、表2。
表2 核桃青皮提取物对CNE-2细胞迁移、侵袭的影响
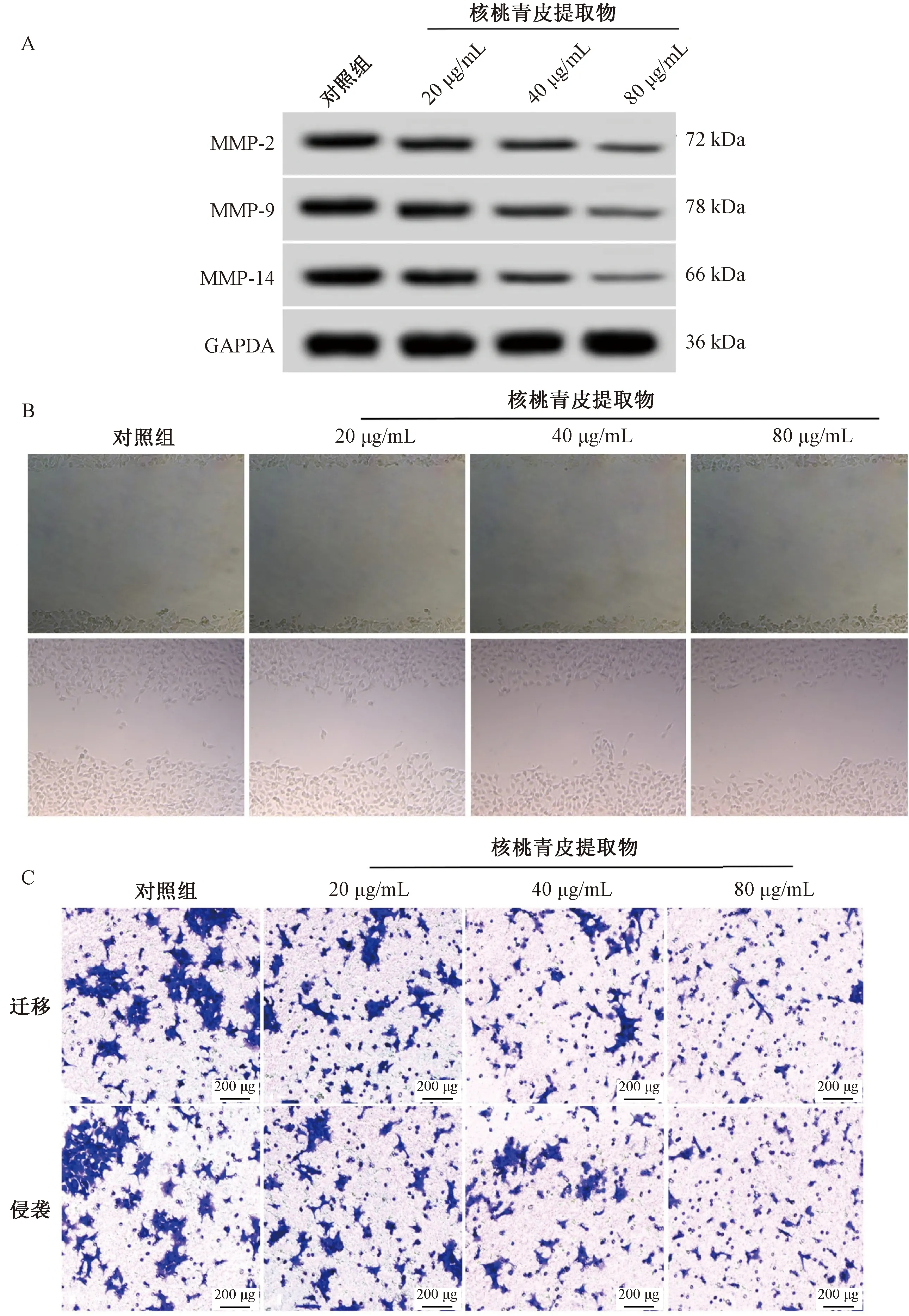
注:A为迁移、侵袭相关蛋白表达,B为划痕,C为Transwell检测CNE-2细胞迁移、侵袭。图2 各组CNE-2细胞迁移、侵袭
2.3 核桃青皮提取物对miR-564、TPX2表达的影响 与对照组比较,20 μg/mL组miR-564表达升高,TPX2 mRNA、蛋白表达均降低(P<0.05);与20 μg/mL组比较,40 μg/mL组miR-564表达升高,TPX2 mRNA、蛋白表达均降低(P<0.05);与40 μg/mL组比较,80 μg/mL组miR-564表达升高,TPX2 mRNA、蛋白表达均降低(P<0.05),见图3、表3。

图3 各组TPX2蛋白表达
2.4 miR-564靶向调控TPX2表达 miR-564与TPX2 3 UTR存在的结合位点见图4A。miR-564可抑制WT-TPX2细胞荧光活性(P<0.05),而不影响MUT-TPX2细胞的荧光活性,见图4B,并且能负向调控TPX2表达(P<0.05),见表4~5。
2.5 miR-564过表达对CNE-2细胞增殖、迁移、侵袭的影响 与miR-NC组比较,miR-564组miR-564表达、细胞抑制率升高,划痕愈合率、细胞迁移数、侵袭数降低,CyclinD1、MMP-2、MMP-9蛋白表达减少,p21蛋白表达增加(P<0.05),见图5、表6。
2.6 抑制miR-564表达逆转CNE-2细胞增殖、迁移、侵袭 与对照组比较,核桃青皮提取物组miR-564表达、细胞抑制率、p21蛋白表达升高,TPX2蛋白表达、划痕愈合率、细胞迁移量、侵袭量及CyclinD1、MMP-2、MMP-9蛋白表达降低(P<0.05);与核桃青皮提取物+ anti-miR-NC组比较,核桃青皮提取物+anti-miR-564组miR-564表达、细胞抑制率、p21蛋白表达降低,TPX2蛋白表达、划痕愈合率、细胞迁移量、侵袭量及CyclinD1、MMP-2、MMP-9蛋白表达量均升高(P<0.05),见图6、表7。
表3 核桃青皮提取物对miR-564、TPX2表达的影响
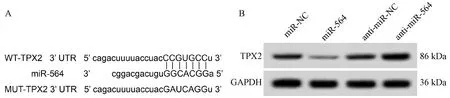
图4 各组TPX2表达
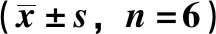
表4 双荧光素酶报告实验结果
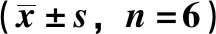
表5 miR-564对TPX2表达的影响

图5 各组CNE-2细胞增殖、迁移、侵袭相关蛋白表达(Ⅰ)
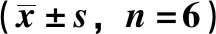
表6 miR-564过表达对CNE-2细胞增殖、迁移、侵袭的影响
表7 抑制miR-564表达逆转CNE-2细胞增殖、迁移、侵袭
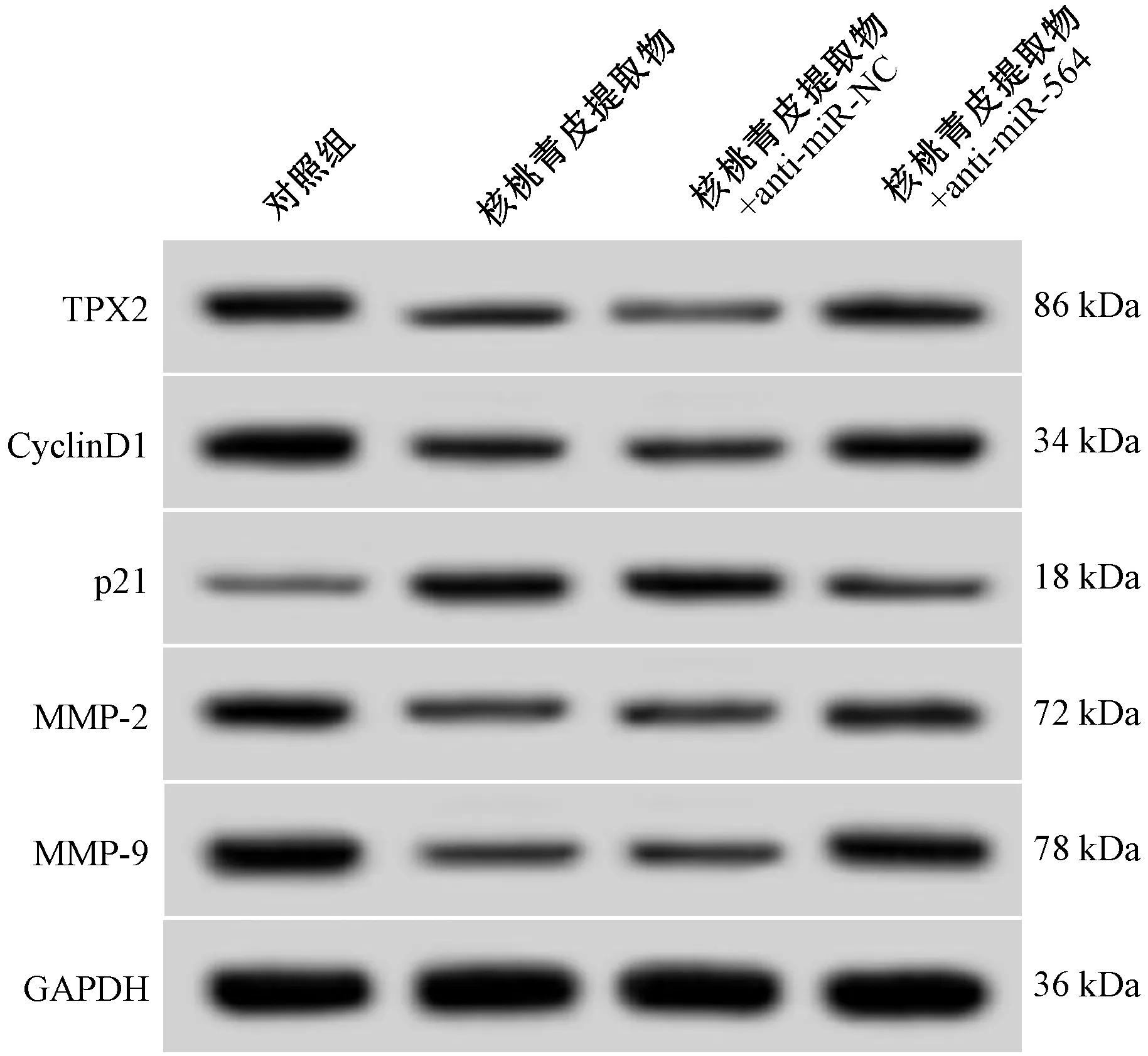
图6 各组CNE-2细胞增殖、迁移、侵袭相关蛋白表达(Ⅱ)
3 讨论
核桃种子(核桃)、绿壳和叶子中甲醇和石油醚提取物具有对肾癌细胞和结直肠癌细胞相同的抗增殖活性[4]。核桃青皮提取物通过调节凋亡相关基因的表达,以剂量和时间依赖的方式抑制前列腺癌细胞增殖并诱导细胞凋亡,表明核桃青皮提取物中存在活性化合物,是抗癌药物的候选来源[5]。核桃青皮提取物呈浓度依赖性抑制结直肠癌细胞的增殖、迁移和侵袭;抗增殖和抗迁移侵袭功能与抑制增殖相关蛋白CyclinD1,促进p21、p27的表达和抑制迁移侵袭相关蛋白MMP-2、MMP-9、MMP-14的蛋白表达密切相关。
miR-564在人骨肉瘤细胞和组织中下调,且miR-564的过表达抑制癌细胞增殖并诱导细胞凋亡,Akt被鉴定为miR-564的直接靶标,受miR-564的负向调控,表明miR-564通过直接靶向Akt抑制糖酵解和细胞增殖[6]。miR-564的表达量与核桃青皮提取物的浓度呈正相关;过表达miR-564可抑制结直肠癌细胞的增殖、迁移和侵袭,并调控增殖相关蛋白和迁移侵袭相关蛋白的表达,miR-564可靶向TPX2。
TPX2在多种肿瘤中的表达发生异常,TPX2在癌细胞和组织中表达增加[7]。TPX2在多种恶性肿瘤中表现出异常的升高,抑制TPX2不仅可抑制癌细胞的增殖、迁移和侵袭,甚至可增强放化疗的面感性[8]。TPX2和AURKA的下调显示出抑制癌细胞侵袭的作用,揭示了TPX2促进结肠直肠腺瘤的恶性化进展[9]。TPX2在结直肠癌中有促进癌症恶化作用[10-11]。TPX2在结肠癌组织中过度表达,且与结肠癌的分期、转移及生存率显著相关,抑制TPX2在体外和体内均抑制结肠癌细胞的增殖和致肿瘤性,TPX2敲低可减弱结肠癌细胞的迁移和侵袭能力,显示与AKT介导的MMP2活性在机制上相关,表明TPX2在促进人结肠癌的肿瘤发生和转移中起重要作用,并且具有成为新的预后生物标志物和治疗靶标[12]。TPX2的表达量与核桃青皮提取物的浓度呈负相关,且抑制TPX2具有与过表达miR-564相同的抑制鼻咽癌细胞细胞增殖,促进凋亡的作用;过表达TPX2可逆转过表达miR-564对鼻咽癌细胞增殖抑制和凋亡促进的作用。
综上所述,核桃青皮提取物具有抑制鼻咽癌细胞增殖、迁移和侵袭,其机制可能与调节miR-564/TPX2表达密切相关,为核桃青皮提取物治疗鼻咽癌提供支持。
