清胰Ⅱ号颗粒对急性胰腺炎小鼠的作用及其机制
2022-07-22杨晓燕杜艺玫张倩茹何芋岐郑传痴周旭美
杨晓燕,雷 蕾,杜艺玫,4,秦 琳,4,张倩茹,4,何芋岐,郑传痴,周旭美
(1.遵义医科大学药学院,贵州 遵义 563003;2.遵义医科大学附属医院,贵州 遵义 563003;3.遵义医科大学药学院药学实验室,贵州 遵义 563003;4.遵义医科大学教育部药理重点实验室,贵州 遵义 563003;5.遵义医科大学第二附属医院药剂科,贵州 遵义 563003)
清胰Ⅱ号颗粒临床上用于治疗急性胰腺炎或重症急性胰腺炎。该方以大黄为君药,配伍栀子、延胡索、木香、赤芍等药材,具有利胆退黄、清热解毒、活血化瘀等功效[1-2]。清胰Ⅱ号颗粒在保护胰腺细胞、保护肠黏膜、调节炎性因子等方面具有显著活性[3-4]。为方便给药并提高患者依从性,清胰Ⅱ号颗粒已被开发成为复方颗粒制剂。
急性胰腺炎(acute pancreatitis,AP)是一种由多病因诱导的胰腺局部及全身炎症性疾病,病死率较高、并发症较多,是消化系统危急重症之一[5]。AP发病机制较为复杂,主要有胰酶自身消化、炎性因子、胆源性胰腺炎等[6],但机制尚不明确。胆汁淤积倒流引起的胰蛋白酶对胰腺组织的自身消化与AP发病直接相关[7-8]。胆汁酸是胆汁的重要组分,在AP发病过程中起到重要作用。法尼醇受体(Farnesoid X receptor,FXR)是胆汁酸代谢通路的关键酶,可调节胆汁酸代谢通路上OATP、OSTα/β、NTCP等代谢酶的表达进而控制胆固醇代谢成为胆汁酸[9-10],维持胆汁酸稳态。研究表明,清胰Ⅱ号颗粒对急性胰腺炎的治疗作用与调节胆汁酸代谢、调节胆汁酸平衡有关。研究清胰Ⅱ号颗粒对FXR介导的胆汁酸代谢通路的影响,分析关键的调控靶点。
1 材料
1.1 动物 雌性KM昆明种小鼠,体质量(20±2) g,由第三军医大学大坪医学实验动物中心提供,实验动物生产许可证号为SCXK渝2012-0005,实验前适应性喂养1周。
1.2 试剂与药物 大黄(批号150323)、栀子(批号150327)、延胡索(批号150323)、木香(批号150323)、赤芍(批号150327)、牡丹皮(批号150323)、厚朴(批号150323)、芒硝(批号150203)由遵义医科大学附属医院中药房提供,经遵义医科大学附属医院杨建文教授鉴定为正品。清胰Ⅱ号颗粒根据文献[11]报道的工艺制备。胆碱乙硫氨酸饲料(江苏协同饲料有限公司)。醋酸奥曲肽注射液(北京诺华制药有限公司)。引物(上海捷瑞生物工程有限公司);Trizol(北京索莱宝科技有限公司);SYBR green(美国Bio-Rad公司)。
1.3 仪器 AU5800全自动生化分析仪(美国贝克曼库尔特公司);Thermo微量分光光度计(美国Thermo公司);逆转录仪、实时荧光定量PCR仪(美国Bio-Rad公司)。
2 方法
2.1 模型建立 40只小鼠分为4批,每批10只,分别给予无胆碱乙硫氨酸(CDE)饲料1、2、3、4 d,眼眶取血,3 000 r/min离心10 min,取血清,检测血清淀粉酶水平,根据其变化及小鼠死亡率来对造模时间进行筛选。
2.2 分组与给药 105只小鼠随机分为正常组,模型组,清胰Ⅱ号颗粒低、中、高剂量组,阳性对照组,阴性对照组,每组15只,除正常组外,其余各组小鼠按“2.1”项下方法造模,然后模型组立即处死。清胰Ⅱ号颗粒低、中、高剂量组,阳性对照组,阴性对照组立即停止饲喂CDE饲料,改为普通饲料。根据临床治疗时间,清胰Ⅱ号颗粒低、中、高剂量组分别按3.9、7.8、15.6 g/kg剂量给药3 d,阳性对照组给予醋酸奥曲肽(20 μg/kg)3 d,正常组、阴性对照组给予等体积生理盐水3 d,并且阴性对照组不给予药物治疗,用于观察急性胰腺炎发展。给药3 d后,检测小鼠血清淀粉酶水平,10%甲醛固定胰腺,HE染色观察其病理变化,肝脏在-80 ℃下冷冻保存。
2.3 qRT-PCR检测胆汁酸通路关键蛋白编码基因mRNA表达 取小鼠肝脏组织10~30 mg,Trizol法提取总RNA,取2 μL,采用超微量分光光度计测定OD260/OD280值及RNA浓度,逆转录为cDNA。以Gapdh为内参,反应条件为95 ℃ 预变性30 s,95 ℃复性10 s,60 ℃退火45 s,循环39次,55 ℃延伸5 s,读取样本Ct值,计算基因相对表达。

3 结果
3.1 造模时间 图1显示,给予CDE饲料后,模型组小鼠血清淀粉酶水平持续升高,3 d后更明显(P<0.05,P<0.05),表明造模成功,但继续饲喂会导致小鼠大量死亡,故确定造模时间为3 d。
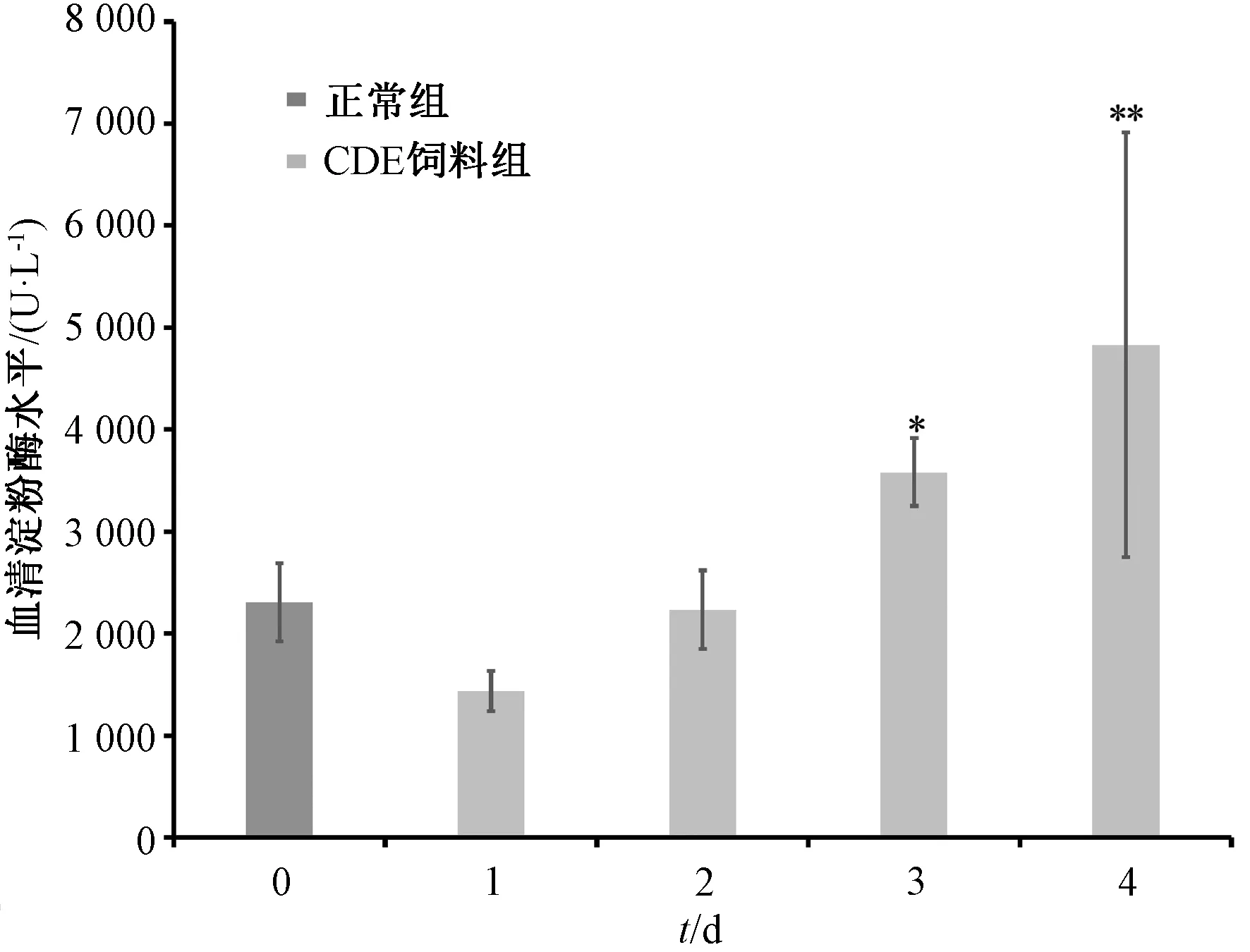
注:与正常组比较,*P<0.05,**P<0.01。图1 造模时间对小鼠血清淀粉酶水平的影响
3.2 清胰Ⅱ号颗粒对小鼠血清淀粉酶水平的影响 图2显示,与模型组、阴性对照组比较,清胰Ⅱ号颗粒高、中、低剂量组小鼠血清淀粉酶水平降低(P<0.05),但无明显量效关系。
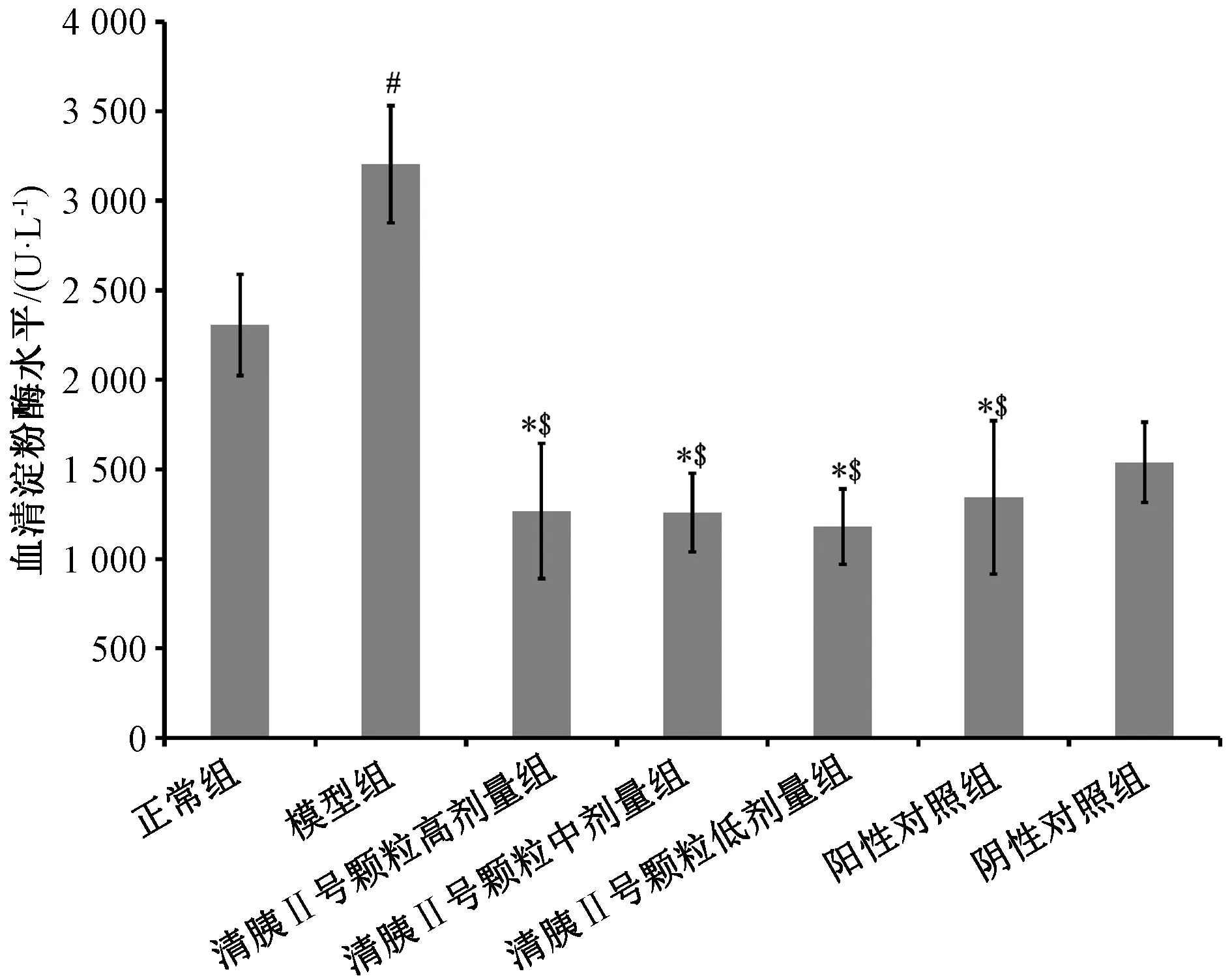
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05;与阴性对照组比较,$P<0.05。图2 清胰Ⅱ号颗粒对小鼠血清淀粉酶水平的影响
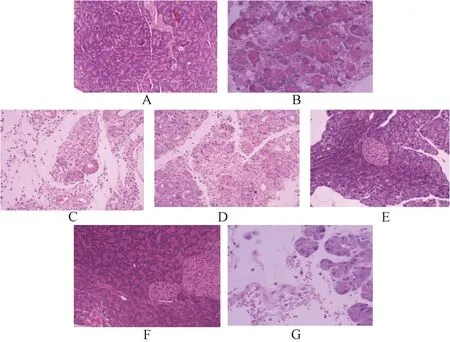
注:A为正常组,B为模型组,C为清胰Ⅱ号颗粒低剂量组(3.9 g/kg),D为清胰Ⅱ号颗粒中剂量组(7.8 g/kg),E为清胰Ⅱ号颗粒高剂量组(15.6 g/kg),F为阳性对照组,G为阴性对照组。图3 各组小鼠胰腺组织病理变化
3.3 小鼠胰腺组织病理变化 图3显示,正常组小鼠未见胰腺肿大、变硬、充血、炎细胞浸润等胰腺炎症状;模型组小鼠胰腺组织出现大片凝固性坏死、细胞结构不清、出血及炎细胞浸润;清胰Ⅱ号颗粒低、中剂量组小鼠可见少量炎细胞浸润和肉芽组织增生,而高剂量组小鼠胰腺组织水肿减轻,出血明显改善,炎细胞浸润不显著;阳性对照组小鼠炎症、出血等症状得以改善;阴性对照组小鼠可见明显出血、炎细胞浸润,细胞轮廓不清晰等病理变化。
3.4 聚类分析 采用RT-PCR测定胆汁酸通路上46个关键蛋白编码基因mRNA表达,并对其进行聚类分析,结果见图4,可知清胰Ⅱ号颗粒高剂量组与正常组聚为一类,清胰Ⅱ号颗粒中、低剂量组聚为一类并与清胰Ⅱ号颗粒高剂量组、正常组共聚为一类,阴性对照组与模型组聚为一类。由此表明,小鼠给予高剂量清胰Ⅱ号颗粒后,其胆汁酸通路的整体基因轮廓可回调至近正常状态,而中、低剂量组作用不显著;与模型组比较,阴性对照组小鼠胆汁酸通路基因轮廓未明显改善。
3.5 主成分分析 图5A显示,阴性对照组与正常组在图上分布于不同的象限,表明急性胰腺炎小鼠在胆汁酸代谢通路的基因调控上有显著变化;不同剂量清胰Ⅱ号颗粒干预后,对上述变化均表现出一定回调,并且与正常组在得分图上重合。图5B显示,Mapk1对组间区分贡献最大,即为受清胰Ⅱ号颗粒复方颗粒影响最明显的基因。另外,虽然Slco1a1在聚类分析中表现出较大变化,但主成分分析表明它对组间区分的贡献明显弱于Mapk1。
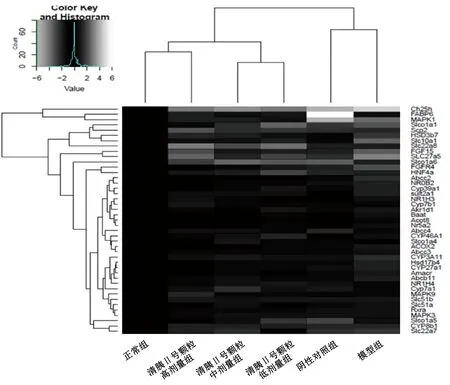
注:白色表示上调,灰色表示下调,黑色代表无明显变化。图4 清胰Ⅱ号颗粒对小鼠胆汁酸通路基因表达调控的聚类分析图
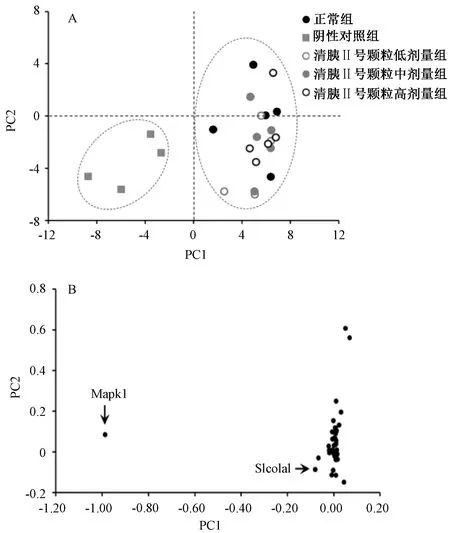
图5 清胰Ⅱ号颗粒对小鼠胆汁酸通路基因表达调控的主成分分析图

图6 清胰Ⅱ号颗粒对Mapk1、Slcola1基因表达的调控作用
3.6 基因表达分析 图6显示,Mapk1、Slco1a1基因表达调控与清胰Ⅱ号颗粒疗效呈正相关,前者在模型组中显著上调,在阴性对照组中无回调,而在清胰Ⅱ号颗粒高、中、低剂量组中显著下调;后者在模型组、阴性对照组中显著上调,在清胰Ⅱ号颗粒高剂量组中显著下调。由此表明,Mapk1、Slco1a1可能是胰腺炎发病及治疗的关键靶点基因。
4 讨论
本实验采用CDE饲料诱导小鼠急性胰腺炎,给予不同剂量的清胰Ⅱ号颗粒,通过测定血清淀粉酶并结合病理观察。结果发现,清胰Ⅱ号颗粒可显著改善胰腺病理情况、降低血清淀粉酶、改善胰腺出血、减少单核细胞等炎性细胞渗出。
胰腺炎患者胰腺组织广泛坏死后,其血清淀粉酶水平可能与正常水平持平甚至更低,检测结果易受其他因素影响而出现误差[12]。当急性胰腺炎发病后,血清淀粉酶可上升,但在3 d后血清淀粉酶的水平也会逐渐降低[13],本实验表现出相应的趋势,阴性对照组的AMS低于正常组。因此,为避免实验误差,采用AMS、病理切片对清胰Ⅱ号颗粒的药理作用进行综合评价。
胆汁的分泌、吸收、代谢受到疾病因素、不良饮食习惯等影响[14],胆道中的胆汁酸和胆固醇严重失衡,造成胆固醇在胆管沉积形成结石[15]而滞留于胆道系统。持续的胆结石累积或胆结石摩擦导致胰胆管共同解剖通路堵塞,胆汁及胰液流入十二指肠的过程受阻[7]。胆汁酸等消化液返流回胰腺,激活的胰酶原对胰腺自身组织结构进行消化,从而导致胰腺炎的发生[8]。清胰Ⅱ号颗粒给药之后,小鼠胆汁酸通路的Mapk1和Slco1a1显著下调。
Mapk1是一组能被内源性物质激活的蛋白激酶,是细胞内重要的信号传导系统。在胆汁酸代谢通路(图7)中,Mapk1信号通路是通过肠道调节肝脏胆汁酸合成与转运的重要途径,在胰腺炎中起到重要的作用[16]。肝脏合成的胆汁酸会通过转运蛋白转运至胆管,通过胆管进入小肠,在小肠内激活肠道FXR,肠道FXR上调肠上皮成纤维细胞因子(Fibroblast growth factors,FGF15)的表达[17],而后者会随着门静脉血流进入肝脏并转运至肝细胞内诱导Mapk1表达进而抑制Cyp7a1和Cyp8b1的表达[18],抑制胆固醇代谢为胆汁酸。Slco1a1是动物及人体内重要的膜转运蛋白,介导了胆汁酸的细胞转运[19],胆汁酸是OATP1的配体,FXR可以抑制OATP1表达减少胆汁酸的吸收[20]。

图7 胆汁酸通路的肝肠循环(KEGG map04976)
基于胰腺炎与胆汁酸通路的关系探讨清胰Ⅱ号颗粒的作用机制,发现清胰Ⅱ号颗粒能显著下调Mapk1并上调Cyp7a1和Cyp8b1,促进胆固醇分解代谢为胆汁酸,同时下调Slco1a1,减少胆汁酸的吸收,使胆汁酸通路恢复平衡,避免胆结石的形成堵塞胰胆管,最终改善胰腺炎症状。
清胰Ⅱ号颗粒高剂量给药时可明显减轻胰腺炎的症状,可能通过调节肝脏和血液循环之间的胆汁酸转运而实现[21]。但长期、大剂量的使用可能会对机体造成损害,易导致消化道不良反应[22]。长期毒性实验表明清胰Ⅱ号颗粒无消化道的功能性损害,说明该制剂具有安全性[23]。
综上所述,清胰Ⅱ号颗粒治疗急性胰腺炎的潜在机制可能是通过调控胆汁酸通路来调节胆固醇代谢以及胆汁酸转运,促使胆汁酸通路恢复平衡。
