泽漆水提物对LPS诱导的急性肺损伤的影响
2022-07-22刘雅慧陈兰英周朦静罗颖颖崔亚茹
刘雅慧,陈兰英,周朦静,尹 力,罗颖颖,崔亚茹
(江西中医药大学中药固体制剂制造技术国家工程研究中心,江西 南昌 330006)
急性肺损伤(acute lung injury,ALI)是一种以肺水肿和急性炎症为特征的综合征,是重症患者发病和死亡的重要原因之一,临床表现为进行性低氧血症和呼吸窘迫[1]。最新研究表明,在急性肺损伤的发生发展过程中炎症反应发挥着关键的作用。脂多糖(LPS)是革兰氏阴性细菌细胞壁的主要生物活性成分,在急性肺损伤动物模型中,机体受到LPS刺激后出现肺水肿和炎性细胞浸润,炎性细胞浸润进一步导致活性氧和炎症因子的释放,最终出现急性肺损伤病变[2]。
泽漆是大戟科植物泽漆EuphorbiahelioscopiaL.的干燥全草,其性微寒、味苦,归肺、小肠、大肠经,具有利水消肿、消痰退热、散结杀虫等功效,为民间常用中草药,被广泛用于治疗慢性阻塞性肺疾病等[3-4]。现代研究表明泽漆的活性成分主要为二萜、黄酮、多酚等,具有抗肿瘤、抗炎、抗菌、清除自由基等药理作用[5]。本实验旨在研究泽漆在体内外对LPS诱导的急性肺损伤炎症因子TNF-α、IL-1β、IL-6及调控蛋白JNK、p38、ERK1/2的干预效应,进一步探讨泽漆防治急性肺损伤的作用机制。
1 材料
1.1 动物 SPF级雄性SD大鼠,体质量180~220 g,共40只;SPF级雄性BALB/c小鼠,体质量16~18 g,共50只,均购自湖南斯莱克景达实验动物有限公司,动物生产许可证号SCXK(湘)2016-0002。本研究所涉及的动物实验均经江西中医药大学实验动物科技中心动物实验伦理委员会审查批准,批准号为JZLLSC2018-0131。
1.2 细胞 RAW264.7细胞,购买于中国科学院上海生命科学研究院细胞资源中心。
1.3 试剂与药物 实验用泽漆药材购自北京仟草中药饮片有限公司,由江西中医药大学刘荣华教授鉴定为正品。醋酸地塞米松片(批号170203)购自浙江仙琚制药股份有限公司;脂多糖(货号L2880)购自美国Sigma公司;苏木素-伊红(HE)染色试剂盒(批号517-28-2)购自北京索莱宝科技有限公司;p-ERK1/2抗体(批号GR3192740-17)、p-p38抗体(批号GR223651-16)、p38 抗体(批号GR305364-10)、ERK1/2抗体(批号GR2971047-12)、JNK抗体(批号GR32333-11)、p-JNK抗体(批号GR3187606-5)均购自英国Abcam公司;β-tubulin抗体(批号01270/30251)、辣根过氧化物酶(HRP)标记的羊抗兔(批号01334/40243)、羊抗鼠二抗(批号01325/50237)、化学发光试剂盒(批号10245)均购自北京康为世纪生物科技有限公司;小鼠细胞因子检测试剂盒(批号741043、740136)购自美国 Biolegend 公司。
1.4 仪器 RWD510型小动物麻醉机(深圳市瑞沃德生命科技有限公司);RM2016型轮转式切片机(德国 Leica公司);Gallios型流式细胞仪(美国Beckman公司);Spectra Max i3型酶标仪(德国Molecular Devices公司);Chemi Doc XRS型凝胶成像仪(美国Bio-Rad公司)。
2 方法
2.1 泽漆水提物制备 取泽漆干燥全草,按1∶8的料液比,加水置于圆底烧瓶中,加热提取2次,每次连续回流2 h,用纱布过滤合并滤液,减压回收溶剂浓缩得稠浸膏,在真空条件下低温干燥,即得泽漆水提物。
2.2 含药血清制备 40只SD大鼠适应性饲养7 d后,按体质量随机分成空白血清组、地塞米松含药血清组(1.0 mg/kg)、泽漆水提物高剂量含药血清组(5 g/kg)和泽漆水提物低剂量含药血清组(2.5 g/kg),每组10只[6]。每天灌胃给药2次,灌胃剂量为10 mL/kg,灌胃给药每次间隔12 h,连续灌胃给药3 d,其中空白血清组灌胃等体积的生理盐水。末次给药前8 h,禁食不禁水。末次给药1 h后,腹主动脉取血,室温静置2 h,待血清析出后,3 000 r/min离心10 min,取上层血清,56 ℃水浴灭菌30 min,采用0.22 μm微孔滤膜过滤,-80 ℃保存备用。
2.3 细胞培养 RAW264.7细胞用含10%胎牛血清和1%青霉素、链霉素的DMEM培养基培养,放于37 ℃、5% CO2恒温培养箱培养。
2.4 CCK-8法检测含药血清毒性 取对数生长期的RAW264.7细胞,细胞密度调整为2×104/mL,每孔100 μL接种在96孔板中,待细胞贴壁生长后,开始分组给药,共5组,分别为正常对照组、空白血清组、地塞米松含药血清组、泽漆水提物高剂量含药血清组和泽漆水提物低剂量含药血清组,其中正常对照组更换成新鲜的DMEM培养基,其余各组分别更换成含10%对应血清的DMEM培养基。培养24 h后,向每孔添加10 μL CCK-8试剂,放置培养箱中继续孵育1~4 h,使用酶标仪于450 nm波长处检测吸光度,并计算细胞存活率。
2.5 RT-PCR法检测细胞内iNOS、TNF-ɑ、IL-6、IL-1βmRNA表达 取对数生长期的RAW264.7细胞,细胞密度调整为2×105/mL,待细胞贴壁生长后,分组预给药,其中空白血清组、模型组都更换成含10%空白血清的DMEM培养基,地塞米松含药血清组、泽漆水提物高剂量含药血清组、泽漆水提物低剂量含药血清组则分别更换成含10%对应含药血清的DMEM培养基。37 ℃、5% CO2培养箱中培养,预给药1 h后,模型组以及各含药血清组都添加LPS(1 μg/mL)刺激细胞,共孵育18 h[7]。收集各组RAW264.7细胞,用Trizol试剂提取总RNA,检测RNA浓度后,用逆转录试剂盒进行逆转录反应。本实验所涉及的引物均由南京金斯瑞生物科技有限公司合成,引物序列见表1。将cDNA作为模板进行RT-PCR反应,根据RT-qPCR试剂盒说明书,配置反应体系,其反应条件为95 ℃ 2 min,95 ℃ 10 s,60 ℃ 30 s,共40个循环,用2-△△CT法计算iNOS、TNF-ɑ、IL-6、IL-1βmRNA相对表达量。

表1 引物序列Tab.1 Primer sequences
2.6 动物模型复制及给药 50只BALB/c小鼠适应性饲养7 d后,按体质量随机分为正常组、模型组、地塞米松组(1.5 mg/kg)、泽漆水提物高剂量组(7.5 g/kg)和泽漆水提物低剂量组(3.75 g/kg),每组10只。给药组灌胃给予相应药物(灌胃体积10 mL/kg),每天1次,连续灌胃给药3 d;其中正常组与模型组灌胃等体积的磷酸盐缓冲液(PBS)[8]。末次给药1 h后,用移液枪吸取含LPS(1 mg/kg)的PBS溶液,滴入模型组与各给药组小鼠鼻腔内,每只50 μL,复制急性肺损伤模型;正常组则给予等量生理盐水。鼻腔滴入LPS 12 h后,处死小鼠,收集支气管肺泡灌洗液(BALF)和肺组织用于后续各项指标的检测[8]。
2.7 流式细胞术检测BALF中炎症因子水平 取冷冻保存的BALF,采用小鼠细胞因子检测试剂盒,按照说明书使用流式细胞仪检测BALF中TNF-α、IL-6、IL-1β水平。
2.8 HE染色观察肺组织病理学变化 取右肺组织,置于10%中性甲醛中固定,石蜡包埋,切片,HE染色,光学显微镜观察肺组织病理形态变化。参照文献[8]报道方法,根据肺泡充血、出血、肺泡腔或血管壁炎性细胞浸润或聚集、肺泡壁增厚或透明膜形成进行检查,分别进行0~4分半定量分析。0分为无病变或非常轻微;1分为轻度病病变;2分为中度病变;3分为重度病变;4分为极重度病变。
2.9 Western blot法检测小鼠肺组织中JNK、p38、ERK1/2蛋白表达 取冷冻保存的小鼠肺组织,添加RIPA裂解液充分研磨以提取蛋白,采用BCA法检测各组蛋白浓度,并调适至相同蛋白浓度,沸水浴加热5 min,使其变性。参照文献[9]方法操作,最后用Image J软件统计分析蛋白条带的灰度值。

3 结果
3.1 含药血清的毒性实验结果 使用空白血清及各含药血清干预RAW264.7细胞24 h后,采用CCK-8法检测细胞活性,发现各组细胞存活率无明显变化(P>0.05),见图1。说明空白血清及各含药血清对RAW264.7细胞均没有毒性作用。
3.2 泽漆水提物含药血清对RAW264.7细胞内iNOS、TNF-α、IL-6、IL-1βmRNA表达的影响 与空白血清组比较,模型组RAW264.7细胞内iNOS、TNF-α、IL-6、IL-1βmRNA表达均升高(P<0.05,P<0.01),表明已成功构建RAW264.7细胞炎症模型;与模型组比较,地塞米松含药血清组和泽漆水提物高剂量含药血清组RAW264.7细胞内iNOS、TNF-α、IL-1βmRNA表达均降低(P<0.05,P<0.01),IL-6 mRNA表达也有一定的降低趋势;与模型组比较,泽漆水提物低剂量含药血清组RAW264.7细胞内iNOS、TNF-α、IL-6、IL-1βmRNA表达均有一定的降低趋势,见图2。上述结果表明,泽漆水提物含药血清能干预LPS刺激RAW264.7细胞引起胞内炎症因子TNF-α、IL-6、IL-1β的异常表达。
图1 各组细胞存活率Fig.1 Survival rate of cells in each
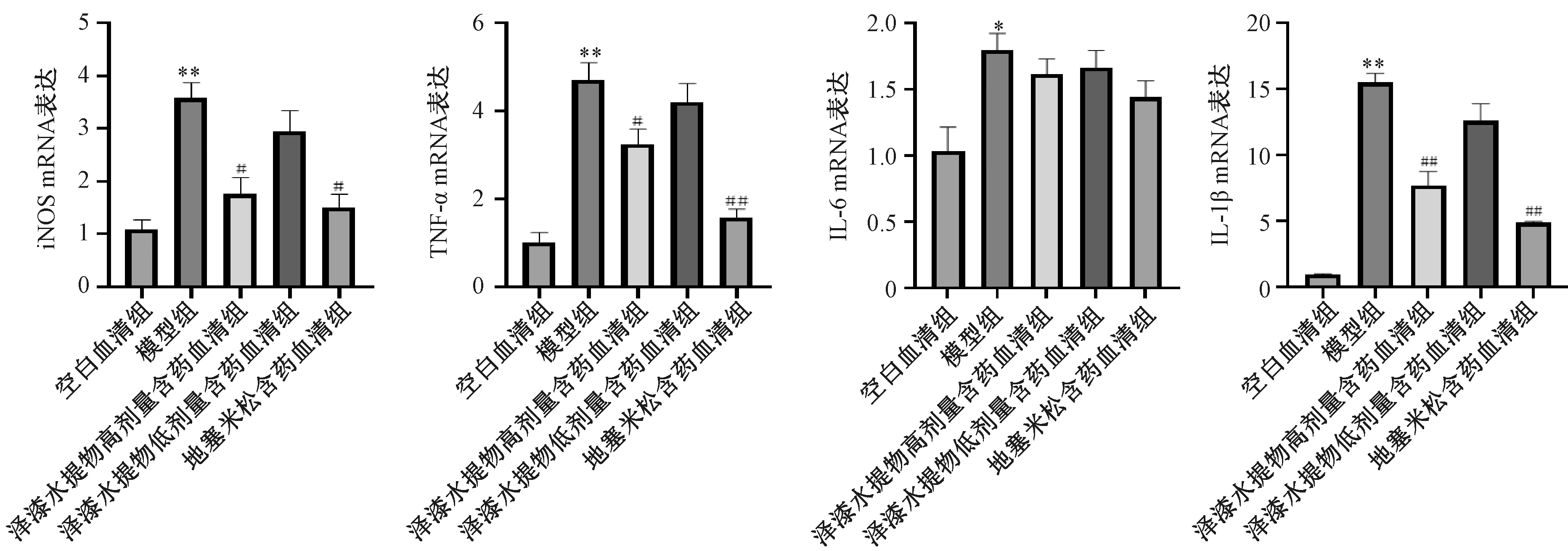
注:与空白血清组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。图2 各组细胞内iNOS、TNF-α、IL-6、IL-1β的mRNA表达Fig.2 mRNA expressions of iNOS,TNF-ɑ,IL-6 and IL-1β of cells in each
3.3 泽漆水提物对LPS诱导急性肺损伤小鼠BALF中TNF-α、IL-6、IL-1β水平的影响 与正常组比较,模型组小鼠BALF中TNF-α、IL-6、IL-1β水平均升高(P<0.01);与模型组比较,泽漆水提物高剂量组和地塞米松组小鼠BALF中TNF-α、IL-6、IL-1β水平均降低(P<0.01);与模型组比较,泽漆水提物低剂量组小鼠BALF中TNF-α、IL-6、IL-1β水平也有下降趋势,见表2。
3.4 泽漆水提物对LPS诱导ALI小鼠肺组织病理学的影响 HE染色结果显示,正常组小鼠肺泡大小正常未见充血,肺组织未见出血,肺泡腔和血管壁无明显的炎性细胞或红细胞浸润或聚集,未见肺泡壁增厚;与正常组比较,模型组小鼠部分肺泡断裂且未见完整肺泡结构,肺泡变小,肺泡壁增厚,肺泡腔或血管壁有大量炎性细胞和红细胞聚集;与模型组比较泽漆水提物高剂量组与地塞米松组均得到明显改善,泽漆水提物低剂量组也有一定的改善作用,见图3。小鼠ALI病理评分结果显示,与正常组比较,模型组小鼠ALI病理评分升高(P<0.01);与模型组比较,泽漆水提物高剂量组与地塞米松组ALI病理评分降低(P<0.05,P<0.01),泽漆水提物低剂量组ALI病理评分亦有一定的降低趋势,图4。
表2 各组小鼠BALF中TNF-α、IL-6、IL-1β水平Tab.2 Levels of TNF-α,IL-6 and IL-1β in BALF of mice in each

图3 各组小鼠肺组织病理学变化(HE,×100)Fig.3 Pulmonary pathological changes of mice in each group(HE,×100)
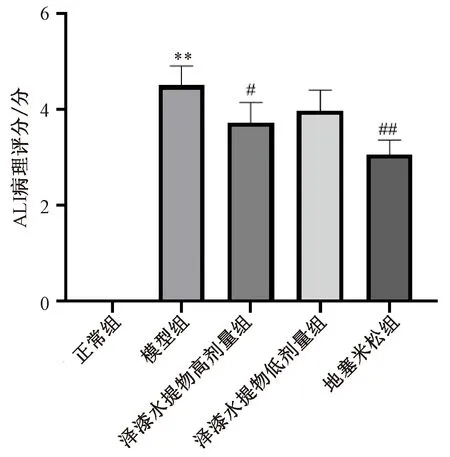
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。图4 各组小鼠肺组织病理评分Fig.4 Pulmonary pathological scores of mice in each
3.5 泽漆水提物对LPS诱导ALI小鼠肺组织中JNK、p38、ERK1/2蛋白表达的影响 与正常组比较,模型组小鼠肺组织中p-JNK、p-ERK1/2、p-p38蛋白表达均升高(P<0.05,P<0.01);与模型组比较,地塞米松组与泽漆水提高剂量组小鼠肺组织中p-JNK、p-ERK1/2、p-p38蛋白表达均降低(P<0.05,P<0.01),泽漆水提低剂量组亦有一定的降低趋势,见图5。

注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。图5 各组小鼠肺组织中JNK、p38、ERK1/2的蛋白表达Fig.5 Protein expressions of pulmonary JNK,p38 and ERK1/2 of mice in each
4 讨论
急性肺损伤是临床上常见的重症呼吸系统疾病,发病率与死亡率都较高[10],其特征是呼吸困难,间质性水肿,活化的炎症细胞积聚,中性粒细胞大量迁移以及弥漫性肺泡损伤[11]。泽漆具有利水消肿、消痰退热等功效,现有研究发现,泽漆对LPS诱导的急性肺损伤小鼠具有保护作用,但目前泽漆对LPS诱导的急性肺损伤发挥保护作用的机制尚未完全明确。因此,本实验从干预LPS诱导的急性肺损伤炎症因子TNF-α、IL-6、IL-1β及调控蛋白JNK、ERK、p38异常表达的角度出发,探讨泽漆对LPS诱导的急性肺损伤发挥保护作用的可能作用机制。
在急性肺损伤期间,肺炎症因子主要是由肺泡巨噬细胞分泌,LPS可激活肺泡巨噬细胞,释放大量的TNF-α、IL-6、IL-1β等炎症因子,从而导致机体细胞免疫反应和体液免疫反应,使肺部免疫反应过度亢进,最终导致急性肺损伤病变[12-13]。TNF-α、IL-1β和IL-6是急性肺损伤的重要生物标志物[14]。其中TNF-α是肿瘤坏死因子家族重要成员,是最早参与急性肺损伤的炎症因子,主要由单核巨噬细胞分泌,并通过模拟巨噬细胞诱导IL-1β、IL-6等炎症因子大量分泌。此外,TNF-α还能影响肺水肿的形成,加重肺损伤[15]。IL-6在炎症的急性期反应中起着重要的作用,它可以扩大炎症级联反应,促进炎症爆发,从而加速急性肺损伤病变。IL-1β在急性肺损伤的进展中发挥着重要作用,它能增加跨肺泡-毛细血管屏障的蛋白渗透性,促进肺泡上皮修复,并能模拟其他炎症因子的产生[16]。本实验中,由LPS诱导的RAW264.7细胞炎症模型胞内TNF-α、IL-6、IL-1β的mRNA表达升高;与模型组比较,泽漆水提物高剂量含药血清和地塞米松含药血清能降低TNF-α、IL-1β的mRNA表达。泽漆水提物含药血清与地塞米松含药血清对LPS刺激RAW264.7细胞引起的胞内IL-6 mRNA高表达也有一定降低趋势,但无统计学差异,可能与含药血清干预细胞的时间点有关。此外,iNOS被认为是炎症发展过程中的细胞内信使,在炎症反应过程中,巨噬细胞可通过iNOS的催化作用产生大量的NO,而过量的NO可能会导致氧化应激,从而加剧组织损伤,加速急性肺损伤病变[12]。本实验中,泽漆水提物含药血清与地塞米松含药血清均能降低LPS刺激RAW264.7细胞引起的胞内iNOSmRNA高表达。基于上述结果,初步推断泽漆水提物对LPS诱导的急性肺损伤炎症因子TNF-α、IL-6、IL-1β的异常高表达有干预作用。
为进一步探讨泽漆水提物对LPS诱导的急性肺损伤炎症因子TNF-α、IL-6、IL-1β的影响及其潜在机制,本实验在动物水平上展开验证。有研究报道,急性肺损伤患者中,BALF中TNF-α、IL-1β、IL-6的浓度均升高,并且与不良预后有关[17]。本实验中,模型组小鼠BALF中TNF-α、IL-6、IL-1β水平升高,与文献结果相一致;而泽漆水提物组和地塞米松组小鼠BALF中TNF-α、IL-6、IL-1β水平均降低,与之前的体外实验结果基本一致。这表明,泽漆水提物能改善LPS诱导的急性肺损伤炎症因子TNF-α、IL-6、IL-1β的异常表达,减轻LPS诱导的急性肺损伤的炎症反应。
JNK蛋白在各种组织中广泛表达,调控细胞对外来刺激所产生的生物学效应。当受到LPS刺激后,JNK磷酸化并转移至细胞核内,调控AP-1的活性,使其下游细胞细胞因子TNF-α、iNOS等表达异常[18-19]。有研究发现,在急性肺损伤病变过程中,JNK活化还增加了急性肺损伤小鼠血清中IL-6的表达,加重急性肺损伤模型小鼠肺水肿[20]。p38作为MAPK家族中调控炎症反应的最主要成员,在急性肺损伤发生发展过程中发挥着重要的作用。在急性肺损伤病变过程中,p38磷酸化,导致TNF-α、IL-6、IL-1等炎症因子异常高表达,增加肺内皮细胞通透性并形成肺水肿[21-23]。ERK1/2与细胞的生长、增殖、分化、迁移和存活密切相关,其激活后从胞质转移至细胞核,作用于核内的转录因子,调节细胞各种生命活动。有研究发现,在 LPS 诱导的急性肺损伤模型中,下调TLR4表达可以抑制ERK1/2活化,从而减少TNF-α、IL-6、IL-1β等炎症因子释放,减轻炎症反应[24]。本实验中,模型组肺组织中JNK、ERK、p38磷酸化蛋白表达均升高,BALF中TNF-α、IL-6、IL-1β炎症因子水平也随着升高。这表明,急性肺损伤模型组小鼠肺组织中JNK、ERK、p38被激活,活化的JNK、ERK、p38蛋白上调下游炎症因子TNF-α、IL-6、IL-1β的表达。而泽漆水提物高剂量和地塞米松均能下调小鼠肺组织中JNK、ERK、p38磷酸化蛋白表达,降低BALF中TNF-α、IL-6、IL-1β水平。这表明泽漆水提物可能通过下调JNK、ERK、p38蛋白表达,进而抑制炎症因子TNF-α、IL-6、IL-1β的异常分泌,减轻LPS诱导的急性肺损伤肺部炎症反应,改善肺损伤。
综上所述,本实验主要揭示了泽漆水提物可以通过干预LPS诱导的急性肺损伤炎症因子TNF-α、IL-1β、IL-6及调控蛋白JNK、p38、ERK1/2的异常表达从而保护LPS诱导的急性肺损伤的作用机制,为其成为防治急性肺损伤药物的研发提供了新思路。
