超声引导下EnCor微创旋切术在切除单发性触诊阴性BI-RADS 4a类乳腺微小病变中的应用效果
2022-07-22陈富龙陈计赏李晓文林显君陈丽佳林昭伶
陈富龙 陈计赏 李晓文 林显君 陈丽佳 林昭伶
广东省阳江市人民医院乳腺外科,广东阳江 529500
乳腺癌发病率和致死率高居我国女性恶性肿瘤首位。随着我国经济社会的快速发展,广大女性的防癌治癌意识逐渐增强,对乳腺内恶性病变早发现、早治疗以提高远期生存率已成为普遍共识[1]。乳腺彩超广泛应用于我国女性乳腺疾病的早期筛查中,在女性健康体检的乳腺彩超图像可出现一种单发性触诊阴性的特殊乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)4a 类乳腺微小病变。研究显示,该类病变恶性的可能性为2%~10%[2],恶变率虽不高,但患者心理负担重,容易产生焦虑情绪,治疗方面仍需引起足够重视。对触诊阴性的乳腺内病变,传统开放性肿物切除活检术由于定位不准,盲切范围广,乳腺创伤大,术后乳腺易出现畸形,影响美观。近年来,超声引导下乳腺微创旋切术越来越多地被应用于乳腺病变的微创诊疗中[3-4]。本研究应用超声引导下EnCor 乳腺微创旋切术对BI-RADS 4a 类乳腺微小病变进行局部精准切除和病理活检,以研究EnCor 微创旋切术在触诊阴性BI-RADS 4a 类乳腺微小病变早期诊治中的临床应用价值。
1 资料与方法
1.1 一般资料
回顾性选取2019年1月至2020年9月阳江市人民医院乳腺外科收治的96 例出现单发性触诊阴性经乳腺彩超检查诊断为BI-RADS 4a 类乳腺微小病变女性患者为研究对象。入组患者按照治疗方式的不同分为观察组(47 例)和对照组(49 例)。观察组中,年龄26~59 岁,平均(45.91±9.83)岁;BI-RADS 4a 类微小病变直径0.5~1.2 cm,平均(0.79±0.19)cm。对照组中,年龄23~57 岁,平均(43.84±10.11)岁;BI-RADS 4a 类微小病变直径0.6~1.3 cm,平均(0.85±0.17)cm。两组患者的年龄、BI-RADS 4a 类微小病变直径等一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:①依据超声BI-RADS 分类标准[2],乳腺彩超检查发现单侧乳房单个孤立性BI-RADS 4a 类乳腺病变;②触诊阴性的乳腺内微小病变;③40 岁以上患者乳腺病变经乳腺钼靶检查为BI-RADS 3 类以下;④患者知情同意下行乳腺微创旋切术或传统开放性乳腺内局部病变切除术治疗。排除标准:①出现双侧乳房肿痛的乳腺纤维囊性增生;②出现红肿热痛明显的乳腺炎;③触诊阳性的乳腺大肿物;④乳腺彩超示BI-RADS 1~3 类的乳腺良性肿物;⑤乳腺彩超示BIRADS 4b~6 类的乳腺恶性肿瘤。本研究经医院医学伦理委员会批准进行,患者治疗前均签署知情同意书。
1.2 方法
观察组患者知情同意后进行超声引导下EnCor乳腺微创旋切术治疗,患者取平卧位,术前应用乳腺彩超探查乳腺内微小病变,乳腺体表标记病变位置;病变乳房皮肤常规消毒、铺巾,利多卡因局部浸润麻醉病变乳房,彩超引导下重点麻醉乳腺内微小病变周围腺体组织;选用美国巴德公司安珂(EnCor)乳腺全自动旋切系统,在预先选定的穿刺点做1 个3~5 mm手术切口,插入8G 微创旋切刀头,在超声引导下将旋切刀头刀槽放置于乳腺内微小病变底部,调整旋切刀头和超声探头,促使旋切刀槽、超声探头和乳腺内微小病变保持在同一平面;启动旋切系统,打开旋切刀槽,吸入乳腺内微小病变组织于刀槽内,逐条对乳腺内微小病变组织进行旋切切除,超声探查无病变残留后启动负压吸引系统充分吸引干净术腔积血后退出旋切刀;术腔局部压迫止血后闭合手术刀口,术后弹力绷带加压包扎48 h。
对照组患者知情同意后进行传统开放性乳腺内局部病变切除术治疗,患者取平卧位,术前乳腺彩超定位,体表标记病变位置;皮肤消毒、铺巾后,局部麻醉下于发现病变的乳房上方做皮肤切口,电刀游离皮下腺体组织,完整切除乳腺内微小病灶,电凝充分止血后缝合手术切口,术后加压包扎1 周。
1.3 观察指标
观察记录两组患者的术后病理结果情况,观察两组患者的手术切口长度、组织切除量、术中出血量、手术时间、术后疼痛缓解时间、伤口愈合时间和瘢痕长度等情况,记录两组患者的术后伤口感染、术区血肿、皮肤瘀斑和乳房变形等并发症发生率。
1.4 统计学方法
采用SPSS 22.0 统计学软件进行数据分析,计数资料以率表示,采用χ2检验;计量资料以均数±标准差(±s)表示,采用t 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者乳腺内微小病变术后病理结果分析
观察组47 例患者47 个单发病灶术后病理结果显示,乳腺纤维腺瘤、乳腺腺病等良性病变43 例,乳腺原位癌、乳腺浸润性癌等恶性病变4 例,恶性病变发生率为8.5%(4/47)。对照组49 例患者49 个单发病灶术后病理结果显示,乳腺纤维腺瘤、乳腺腺病等良性病变44 例,乳腺原位癌、乳腺浸润性癌等恶性病变5 例,恶性病变发生率为10.2%(5/49)。两组的恶性病变发生率比较,差异无统计学意义(χ2=0.081,P=0.776)。病理结果为乳腺导管内乳头状瘤等良性病变患者术后每3 个月随访复查乳腺彩超,随访1年均未见肿物残留。病理结果为乳腺原位癌、乳腺浸润性癌等恶性病变的患者和家属充分沟通后决定待伤口愈合后在全身麻醉下行乳腺癌保乳术或乳腺癌改良根治术进一步处理,其中观察组保乳3 例,乳房切除1 例,微创切口和穿刺针道未见癌组织细胞残留;对照组保乳2 例,乳房切除3 例,术后随访1年均未见癌局部复发或远处转移(表1)。

表1 两组患者乳腺内微小病变术后病理结果分析[n(%)]
2.2 两组患者手术指标的比较
观察组的切口长度短于对照组,组织切除量和术中出血量均少于对照组,手术时间短于对照组,差异有统计学意义(P<0.05)(表2)。
表2 两组患者手术指标的比较(±s)
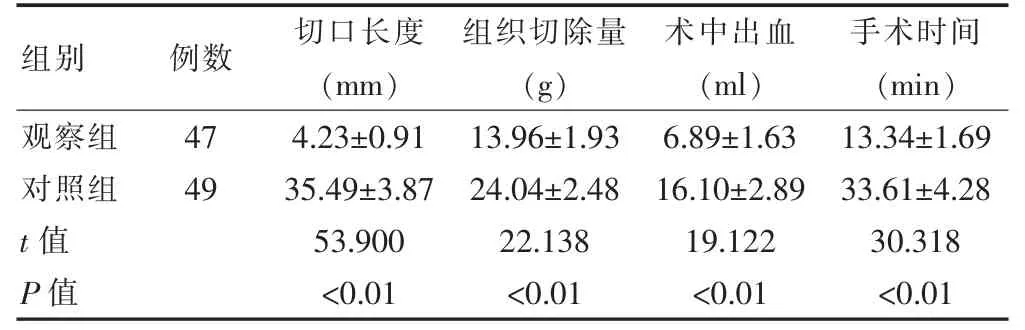
表2 两组患者手术指标的比较(±s)
组别 例数 切口长度(mm)组织切除量(g)术中出血(ml)手术时间(min)观察组对照组t 值P 值47 49 4.23±0.91 35.49±3.87 53.900<0.01 13.96±1.93 24.04±2.48 22.138<0.01 6.89±1.63 16.10±2.89 19.122<0.01 13.34±1.69 33.61±4.28 30.318<0.01
2.3 两组患者术后愈合情况的比较
观察组的术后疼痛缓解时间短于对照组,伤口愈合时间短于对照组,术后瘢痕长度短于对照组,差异有统计学意义(P<0.05)(表3)。
表3 两组患者术后愈合情况的比较(±s)
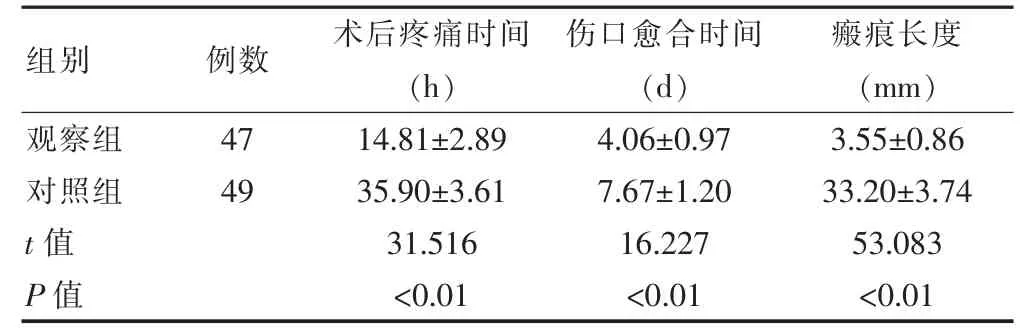
表3 两组患者术后愈合情况的比较(±s)
组别 例数 术后疼痛时间(h)伤口愈合时间(d)瘢痕长度(mm)观察组对照组t 值P 值47 49 14.81±2.89 35.90±3.61 31.516<0.01 4.06±0.97 7.67±1.20 16.227<0.01 3.55±0.86 33.20±3.74 53.083<0.01
2.4 两组患者术后并发症总发生率的比较
观察组的伤口感染、术区血肿、皮肤瘀斑、乳房变形等并发症总发生率低于对照组,差异有统计学意义(P<0.05)(表4)。
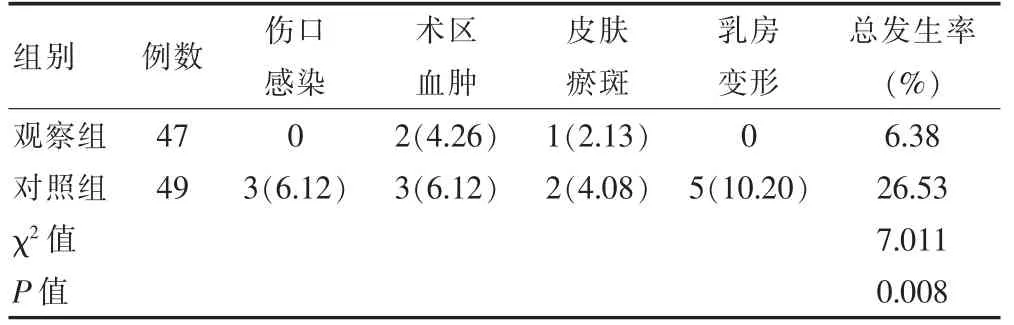
表4 两组患者术后并发症总发生率的比较[n(%)]
3 讨论
乳腺内病变按病理类型的不同大体可分为良性病变和恶性病变两大类,乳腺良性病变常见于乳腺纤维腺瘤、乳腺腺病等病理类型,乳腺恶性病变包括乳腺原位癌和乳腺浸润性癌等病理类型。不同类型乳腺良恶性病变在乳腺彩超图像方面有各自特征性表现,其中肿块圆形或椭圆形,表面光滑,边界清楚,纵横比<1,肿块内见粗大钙化,肿块内血流呈低速低阻等是乳腺良性病变的特有表现;而肿块不规则形,边缘模糊、细分叶、成角、毛刺或蟹足状,纵横比>1,肿块不均匀低回声,肿块后方回声衰减,肿块内见微小钙化,肿块内血流呈高速高阻等是乳腺恶性病变的特有表现[5-7]。
由美国放射学会创立的BI-RADS 被用于规范对乳腺内病变的超声特征描述[8]。BI-RADS 分类诊断标准中,乳腺内良恶性病变的超声影像表现分为0~6类。0 类为不完全评估,指应用超声检查不能全面评估病变,需进一步采用其他影像学检查手段评估。1~6 类为完全评估,其中1 类指阴性或正常;2 类指良性征象,基本可以排除恶性,建议半年至1年随访;3 类指可能良性征象,恶性的可能性<2%,建议3~6 个月短期随访;4 类指可疑的恶性病变,恶性的可能性为2%~95%,细分为4a(3%~10%恶性可能)、4b(>10%~50%恶性可能)和4c(>50%~<95%恶性可能),建议手术活检;5 类指高度可疑恶性病变,恶性可能性≥95%,应积极进行手术治疗;6 类指活检已证实为恶性,可用于评价术前新辅助化疗的影像改变等[2,9]。总体而言,BI-RADS 1~3 类病变基本考虑良性病变,建议随访即可;若病变体积较大,影响生活或外观,患者存有心理负担,再考虑手术切除治疗;而BI-RADS 4 类以上病变需警惕恶性肿瘤可能,建议手术活检或切除治疗[10]。
乳腺癌体积越小,分期越低,越早发现越早治疗,预后越好[11]。随着我国经济社会的高速发展,我国女性的健康保健意识越来越强,广大女性逐渐认识到定期健康体检能够早期预防乳腺癌[1,12],很多日常触诊不到的BI-RADS 4a 类乳腺内微小病变通过乳腺彩超筛查出来。BI-RADS 4a 类乳腺病变处于良恶性病变的交界状态,统计资料显示BI-RADS 4a 类乳腺病变恶性率为3%~10%。本研究96 例BI-RADS 4a 类患者中,9 例患者为乳腺恶性病变,恶变率9.4%,与文献报道一致[2,13-14]。BI-RADS 4a 类病变恶性率不高,但仍有恶变可能,治疗方面需引起足够重视,尤其是存在焦虑情绪和抑郁心理的女性患者,更应积极早期干预处理。触诊阴性的BI-RADS 4a 类乳腺病变体积微小,细针穿刺活检或空芯针粗针穿刺活检组织量少,容易漏诊误诊,可采取手术完整切除活检,但传统的开放性乳腺病变切除活检术定位不准,盲切范围广,组织切除量大,术后乳腺畸形发生率高[15]。近年来,麦默通(Mammotome)或安珂(EnCor)乳腺微创旋切术在乳腺外科手术中得到越来越多的临床应用,其在乳腺良性肿物的微创手术治疗中因创伤小、愈合快、术后美观度高特别受到年轻女性的青睐[4,16]。同时,微创旋切术因切取乳腺组织量多,活检诊断敏感性和特异性高,假阳性和假阴性率低,也可用于乳腺恶性肿瘤的病理筛查活检中[17-19]。本研究结果显示,EnCor 微创旋切术在触诊阴性BI-RADS 4a 类乳腺微小恶性病变的检出率方面与传统开放性乳腺病变切除术相当,但耗时短,切口小,乳腺组织损伤少,可增加早期乳腺癌保乳机会。研究显示,部分Mammotome 微创旋切术后病理活检为乳腺癌的患者后续乳腺癌保乳术或乳腺癌改良根治术标本中可发现乳腺癌组织残留[17]。因此,本研究对于微创旋切术后病理为乳腺恶性病变的患者,为保证肿瘤安全性,后续需进一步行乳腺癌保乳术或乳腺癌改良根治术处理。本研究中,观察组4例乳腺癌患者EnCor 微创旋切术后微创切口和穿刺针道未见癌细胞残留,患者术后随访1年未出现癌复发转移,提示EnCor 微创旋切术用于触诊阴性BI-RADS 4a 类乳腺微小恶性病变切除活检的可靠性较高。
乳腺微创旋切术定位精确,手术范围小,术中在实时超声引导下操作,术野清晰可辨,可对乳腺内肉眼可见微小病变进行局部精准切除,避免过度损伤病变周围正常腺体组织,有效减少了术后乳房变形的发生,美容效果较好,患者术后痛苦少,满意度高[20]。对于术腔出血,术中利用旋切负压吸引系统在超声引导下可充分吸收干净,术后通过局部加压包扎并冰敷等措施可有效阻止术腔血肿和皮肤瘀斑的形成[4,21]。本研究将超声引导下EnCor 乳腺微创旋切术应用于单发性触诊阴性BI-RADS 4a 类乳腺微小病变的外科手术治疗中,结果显示,微创旋切术切口长度、组织切除量、术中出血量、手术时间、术后疼痛缓解时间、伤口愈合时间和瘢痕长度等均显著优于传统的开放性乳腺局部病变切除术,同时术后伤口感染、术区血肿、皮肤瘀斑和乳房变形等并发症发生率低,显示了微创旋切术在此类特殊类型乳腺微小病变的微创外科手术治疗中的有效性和安全性。
综上所述,触诊阴性BI-RADS 4a 类乳腺微小病变有恶变可能,不能低估。超声引导下EnCor 乳腺微创旋切术在触诊阴性BI-RADS 4a 类乳腺良性微小病变的外科手术治疗中优势明显,耗时短,创伤小,痛苦少,恢复快,并发症低,美观度可;而对触诊阴性BI-RADS 4a 类乳腺恶性微小病变,EnCor 微创旋切术可有助于早期发现乳腺癌,可靠性高,安全性好,值得临床推广应用。
