陕北黄土丘陵沟壑区苔藓内生细菌群落多样性分析
2022-07-22邓振山薛军艳郭旻皓柳晓东姜影影贺晓龙
邓振山,薛军艳,郭旻皓,柳晓东,姜影影,贺晓龙,陈 浩
(1. 延安大学 生命科学学院,陕西延安 716000; 2. 西北大学 生命科学学院,西安 710069)
苔藓植物植株微小,呈垫状丛生且为非维管植物,仅仅具有拟茎、拟叶和假根,但是能在高寒、干旱和盐碱等极端环境下生长繁衍,同时也是生态系统演替初期主要的先锋植物以及藓结皮的优势种,作为生物结皮的最高和最终发育阶段的藓结皮在生态系统中扮演着重要的角色,能够为土壤表层提供一种天然屏障,对干旱半干旱地区的生态恢复具有极其重要的作用[1]。苔藓植物在生物结皮形成过程中会产生众多的依附于沙土上的假根来固定沙土,且耐蚀,同时保持结皮水分、减少蒸散作用的效果明显[2-3]。由于陕北黄土高原黄土质地疏松和主要由气候等多方面因素所致的较低植被覆盖率以及不合理的开发利用,致使水土流失和土壤侵蚀日益严重。因此,苔藓植物在防沙治沙、改善微环境、防护黄土边坡坡面、景观应用以及结皮层的形成等方面有着非凡意义[4-6],尤其能够改善土壤表层养分、增加土壤稳定性、降低土壤侵蚀量、抗干扰、抗机械能力以及保护物种多样性等作用[5-7]。
植物内生细菌(endophytic bacteria)是指栖居于健康的植物组织内但不会对宿主产生明显病害的一类微生物[8]。它们在宿主植物的生长发育过程中发挥有益作用,如促进植物生长、抗病、抗逆境以及植物修复等[9-11]。同时也有研究表明苔藓植物原丝体阶段的生长发育与内生细菌的次生代谢物密切相关[12],部分苔藓内生菌及其次生代谢物具有较好的抑菌和抗肿瘤效果[13]。因此,苔藓植物的内生菌资源的发掘和利用在农业生产应用上具有非常重要的意义。
延安市宝塔区地处陕北黄土高原中部丘陵沟壑区与高原沟壑区交接的过渡地带,黄土丘陵沟壑区乔灌木主要优势种群有黄刺玫(Rosaxanthina)、三角槭(Acerbuergerianum)、狼牙刺(Sophoraviciifolia)和侧柏(Platycladusorientalis)等[14],同时苔藓植物优势种为丛藓科(Pottiaceae)、真藓科(Bryaceae)和青藓科(Brachytheciaceae)等[15-16]。目前国内外对苔藓植物的研究主要集中于其分布、形成机理以及生态功能等方面,但对其内生细菌群落结构和多样性的研究却鲜有报道。高通量测序技术具有检测快速、成本低、覆盖度深、信息全面丰富等特点,它克服了传统培养方法不能真实地反映植物内生菌多样性的缺陷,近年来已被广泛应用于微生物分子生态学研究中[17]。鉴于此,本试验以延安市常见的土生对齿藓、反扭藓和青藓为研究对象,利用高通量测序技术对此3种苔藓植物的内生细菌的群落组成、多样性差异及其影响因素进行研究,以期为苔藓内生细菌菌种资源的开发及其对陕北黄土丘陵沟壑区生态系统环境的修复提供理论支持。
1 材料与方法
1.1 样品的采集及处理
样品的采集工作于2020年8至10月进行,采样地点位于陕西省延安市宝塔区杨家岭附近(N 36°10′97″,E 109°20′07″)。选取3块相对平坦并且生物藓结皮发育较好的区域作为样地,利用5点采样法,各采样点相距约800~1 000 m,使用无菌刀片采集生长状况良好的且有着明显不同优势种的藓结皮(0.5~3.0 cm厚度的绿色表层)及结皮下层3.0~5.0 cm剖面土壤作为试验样品。每种藓结皮分别采集3个样品(藓结皮组织)。同时,分别将收集3个品种藓结皮周围的原始土壤过孔径为2 mm筛子,风干后装入灭菌的聚乙烯封口袋于-80 ℃保存,将植株体置于4 ℃的冷藏中备用。各种样本采样地的地理位置和气候信息见表 1。

表1 样地概况Table 1 Sampling plots
1.2 样品鉴定与土壤理化性质分析
参考苔藓植物图鉴(第一册)和贺兰山苔藓植物等书籍资料以及黄土丘陵区藓结皮优势种形态结构差异[18-20]等文献对采集到的藓结皮样品种类进行鉴定。将采集的土壤样品自然风干并过孔径为0.25 mm的筛子,土壤经过前期处理,参照SL-3A型土壤养分测试仪说明书并使用SL-3A型土壤养分测试仪器分别测定土壤有效氮(Available nitrogen,AN)和有机质(Organic matter,OM)的含量以及使用FE28酸度计分别测定土壤的pH。
1.3 苔藓整株样品的表面消毒
首先用镊子分别将苔藓整株植物样品内肉眼可见的杂质去除掉,再用流动的自来水冲洗掉苔藓表面残留的沙土,然后将其置于超净工作台中的灭菌的培养皿之中,用无菌水数次洗涤,再用无菌滤纸吸干苔藓表面液体。将预处理过的苔藓整株植物样品置于灭菌平板上,分别在75%的乙醇中浸泡30 s,CY、DX样品在1%的次氯酸钠中分别浸泡30 s,KA样品在1%次氯酸钠中分别浸泡60 s,然后用无菌水冲洗5次,将最后一次洗涤液作为对照,28 ℃培养3~5 d,根据有无菌落的生长确认表面消毒是否彻底。
1.4 样品总DNA的提取
取表面消毒彻底苔藓样品,每种藓结皮样品3个分别进行测序。根据MoBio PowerSoil○RDNA isolation kit 提 取 试 剂 盒(MO BIO Laboratories,Carlsbad,CA,USA)的说明书进行总DNA抽提[21]。每个样品做 3 个重复,将所得DNA 混匀,DNA浓度和纯度使用NanoDrop2000进行检测,评价提取的总 DNA的质量,检测ODA260/A280 在1.8~2.0之间,质量合格的样品,置于-80 ℃保藏、备用。
1.5 高通量测序分析
取适量各样品的总DNA于离心管中,使用无菌水稀释样本至1 ng/μL,再以稀释后的总DNA为模板,用338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGG-GTWTCTAAT-3′) 引物对V3~V4可变区进行PCR扩增,扩增程序为:95 ℃预变性3 min,27个循环(95 ℃ 变性30 s,55 ℃ 退火30 s, 72 ℃ 延伸30 s),最后72 ℃延伸10 min (PCR仪:ABI GeneAmp○R9700型)。扩增体系为20 μL,4 μL 5×FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μL FastPfu聚合酶,10 ng DNA模板。使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, Union City, CA, USA) 进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST (Promega, USA) 进行检测定量。测序委托北京诺禾致源生物信息科技有限公司使用 Illumina Miseq 测序平台进行PCR 产品的高通量测序分析。
1.6 生物信息学分析
对原始数据首先采用FLASH、FASTQ软件对序列做前期处理,筛选原始序列中含有完整barcode标签的完整序列,弃掉小于150 bp的短小序列,然后采用QIIME 1.9.0(http://qiime.org/tutorials/tutorial.html)结合Mothur软件(Version 1.31.2,https://www.mothur.org/) 中Uchime方法对所得序列进行嵌合体筛除[22],得到有效优质序列然后用QIIME 1.9.0进行生物信息学分析处理[23],采用Uclust的方法,根据97%序列相似度为进行聚类生成不同的操作分类单元(Operational Taxonomic Units, OTUs)并挑选出代表序列,用Mothur方法与SILVA132(http://www.arb-silva.de/)[23]的SSUrRNA数据库[24]对内生细菌代表性的OTUs序列进行物种注释(设定阈值为0.8~1),获得苔藓植株样品中内生细菌分别对应的物种信息和基于物种在门、纲、目等水平上的的群落分布情况。使用Qiime软件(Version 1.9.1)计算Observed-species、Shannon、Simpson等7种不同的Alpha 多样性指数,指数值的高低可直接或间接反映样品群落内的复杂度大小;同样使用Qiime软件计算Unifrac距离、构建UPGMA样本聚类树并使用R软件(Version 2.15.3)分析,进而得到样品聚类和样品主成分分析(Principal Component Analysis,PCA),来判断不同种类苔藓样品间的群落结构差异度。用Venn图反映样本共有和特有的OUTs以及通过应用典范对应分析(Canonical Correspondence Analysis,CCA) 来反映环境因子和样品、菌群之间的相关性。
2 结果与分析
2.1 样品鉴定结果
依据中国高等植物图鉴(第一册)和贺兰山苔藓植物以及相关文献[18-20]鉴定结果表明:陕北黄土丘陵沟壑区的苔藓结皮优势种分别为土生对齿藓(Didymodonvinealis)、青藓(Brachytheciumalbicans)和反扭藓(Timmiellaanomala),它们的编号依次为CY、DX和KA,其形态特征如表2和图1所示。

表2 3种苔藓的形态特征Table 2 Morphological characteristics of three species of mosses

A. 反扭藓;B.土生对齿藓; C.青藓
2.2 土壤理化性质分析
3种苔藓所生长土壤的理化性质如表3所示。结果表明:土生对齿藓土壤样品(编号为CYS)、青藓土壤样品(编号为DXS)和反扭藓土壤样品(编号为KAS)的pH极其接近(8.01~ 8.17),土壤均属于碱性土壤;CYS和DXS样品土壤有效氮的含量相近分别为36 mg·kg-1、37 mg·kg-1,KAS有效氮含量最高52 mg·kg-1;CYS、KAS、DXS 3个样品的有机质含量分别是0.5%、1.7%、0.8%,其中KAS有机质含量最高,CYS有机质含量最低,并且KAS的有机质含量约是CYS的3倍。

表3 土壤样品的理化性质Table 3 Physicochemical properties of soil samples
2.3 测序结果的质量分析
本研究通过对3种藓结皮样品(CY、KA、DX)进行 Illumina Miseq 高通量测序,共获得 184 716条原始序列,质控后分别获得53 781、 5 407、68 984条有效序列(表4)。从稀释曲线(Rarefaction Curve)(图2)可以得知,随着CY、KA、DX 3个样品测序数量的不断增加,三样品的稀释曲线逐渐趋于平缓,稀疏曲线最终趋于平滑,并结合表4的3个样本分别为96.38%、 97.44%、95.74%的文库覆盖率,表明本次取样充足合理,测序深度已经接近饱和,测序结果覆盖度很高,结果能够很好地反映出土生对齿藓、反扭藓、青藓内生细菌群落结构组成,同时也接间的反映出反扭藓的内生细菌物种丰富度远远高于土生对齿藓和青藓,而且土生对齿藓和青藓的内生细菌物种丰富度很接近。
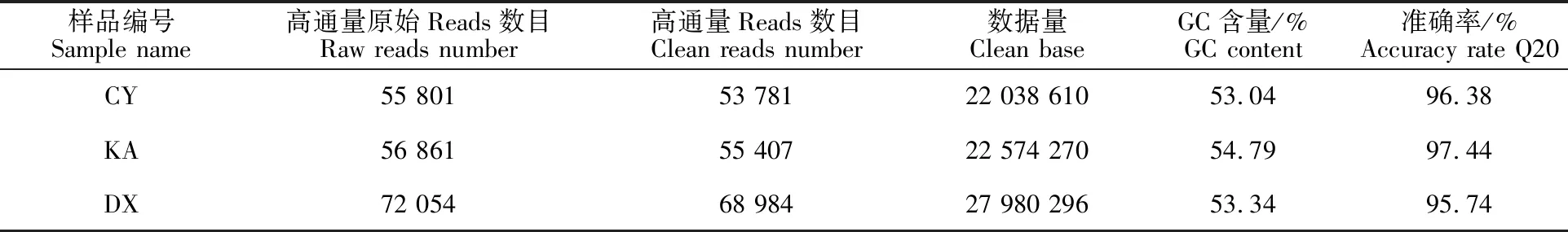
表4 3种藓结皮样品的测序结果Table 4 Sequencing results of three samples of mosses
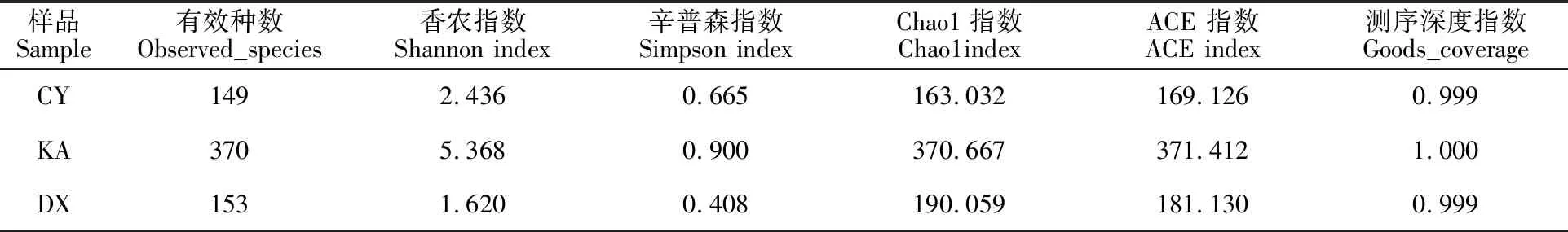
表5 3种藓结皮样品内生细菌多样性Table 5 Diversity of endophytic bacterial of three samples of mosses

CY是指土生对齿藓(Didymodon vinealis); DX是青藓(Brachythecium albicans); KA是反扭藓(Timmiella anomala)。下同
由表5可知,各样品的Chao1指数和Shannon指数等多样性指数各不相同,表明土生对齿藓、青藓、反扭藓3种苔藓内生细菌群落组成的多样性和物种丰富度存在一定的差异。其中样品KA的Chao1指数值(370.667)、ACE指数值(371.412)、Simpson指数值(0.900)和Shannon指数值(5.368)的值最高,表示反扭藓的内生细菌物种丰富度和多样性比其他两个样品高;DX的Shannon指数最低(1.620),但是Chao1指数并不是最小(190.059),青藓的内生细菌多样性相对其他2种苔藓多样性较低,但是丰富度并不是最低的。各样本测序深度指数范围为99%~100%,表明各样本文库的覆盖率很高,本次测序结果可以反映各样本中微生物的真实情况。
2.4 门水平和属水平上内生细菌群落的结构 分析
从图3中门水平来看,CY样品中蓝藻门(Cyanobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes) 所占比例分别是57.91%、41.01%、0.50%、3.24%、0.10%,其余门类别的相对丰度均低于0.10%;而在样品KA和DX中Cyanobacteria、Proteobacteria、Actinobacteria、梭杆菌门(Fusobacteria)、Bacteroidetes、Firmicutes所占比例分别是40.05%和80.50%、40.88%和15.20%、12.62%和0.44%、0.13%和 2.87%、2.68%和0.20%、1.43%和 0.75%。土生对齿藓的优势门类由Cyanobacteria和Proteobacteria组成;青藓的优势门类由Cyanobacteria、 Proteobacteria和Fusobacteria;而反扭藓的优势门有Cyanobacteria、 Proteobacteria、Actinobacteria和Bacteroidetes。所以Cyanobacteria、 Proteobacteria均为土生对齿藓、反扭藓和青藓的优势门。3个样品虽属于同一个地区 ,但由于品种和土壤微环境有所不同,门组成和相对丰度及内生细菌优势门也有所不同。
从属的分类水平上来分析细菌群落组成(图4),同一生境3种藓类内生细菌群落组成种类及优势菌群相对丰度有所差别。CY、KA、DX三个样品中相对丰度大于1%分别有,CY(土生对齿藓)中的未定属unidentified_Cyanobacteria(57.90%)、Pseudomonas(24.92%)、Massilia(6.26%)、Duganella(3.55%)、unidentified_Rickettsiales(3.91%);KA(反扭藓)中的未定属unidentified_Cyanobacteria(35.37%)、unidentified_Rickettsiales(7.18%)、Phytohabitans(4.10%)、Sphingomonas(3.93%)、Methylobacterium( 2.30%)、Pantoea(2.26%)、Pseudomonas(1.47%);DX(青藓)中的未定属unidentified_Cyanobacteria(80.49%)、Pseudomonas(6.46%)、unidentified_Rickettsiales(5.11%)、Fusobacterium(2.87%)。Fusobacterium在CY中丰度为0,在KA中为0.13%,而在DX中 2.87%。综上可知,不同品种的苔藓植物中优势内生细菌群的种类和相对丰度存在着较大差异。

图3 3种不同藓类在门水平内生细菌群落的组成Fig.3 Endophytic bacterial community composition in three species of mosses at phylum level
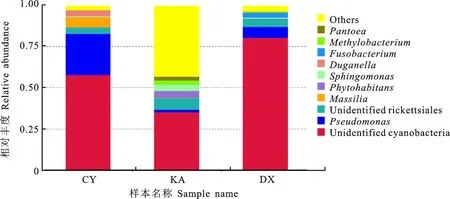
图4 3种不同藓类在属水平内生细菌群落组成Fig.4 Endophytic bacterial community composition in three species of mosses at genera level
2.5 各样本组间的相似性分析
基于Venn图来分析3个样品共有和独有的OTUs。从Venn图(图5-A)可以得出,CY、KA、DX 3种藓结皮样品中存在87个共有OTUs,各样品的独有OTUs 分别为13(DX)、175(KA)、和7(CY)个,反映出土生对齿藓、反扭藓、青藓3种藓类的内生细菌既有相似性又有差异性,这是由于这3种藓类遗传基因不同,导致其根际的微环境存在一些差异。其中KA和CY样品中的共有OTUs 142个,KA和CY样品中分别独有228和7个OTUs(图5-B);同时,两两样本相比较,DX和CY样品中存在87个共有OTUs ,并分别具有66和62个独有OTUs(图5-C);KA和DX样品中存在140个共有OTUs ,KA样品中具有230个独有OTUs,CY样品中存在13个独有OTUs(图5-D)。从特有的OTU数量可以看出,反扭藓与青藓、土生对齿藓内生细菌的差异性较大,表明反扭藓内生细菌序列多样性高,内生菌种种群数量大,而从共有的OTU数量来看,青藓与土生对齿藓之间的差异性最小。

图中数字为各样品中的 OTUs 数量,其中图A为3种藓结皮样品的Vnee图,图B-D表示2种藓结皮样品的Vnee图
对3种结皮藓类的内生细菌群落进行主成分分析(PCA)的分析结果见图6,第一、二两个排序轴对结果的解释率分别为84.42%和15.58%,3种结皮藓类内生细菌群落彼此分离,且之间的距离较远,说明基于OTUs水平上土生对齿藓、反扭藓和青藓之间内生细菌群落结构具有明显差异。

图6 3种藓类样品内生细菌群落主成分分析Fig.6 Principal component analysis (PCA) plot based on unweighted Unifrac metrics for three endophytic bacterial communities of three species of mosses
2.6 土壤理化因子对3种藓类内生细群落组成的影响分析
对土壤理化因子和内生细菌群落进行CCA相关性分析。从图7结果可以看出:土壤理化因子向量的长度可反映出有机质(OM)和有效氮(AN)土壤理化因子对藓类内生细菌菌群的分布影响,AN、OM土壤理化因子对各样品内生细菌属的变化分别解释了72.76%和27.24%,对3个样本内生细菌属的变化总解释度为100%。其中OM和AN对样品KA种属unidentified_Rickettsiales、Methylobacterium、Sphingomonas、Pantoea、Phytohabitans的相关性最大,与样品DX、CY和种属unidentified_Cyanobacteria、Fusobacterium、Pseudomonas、Duganella、Massilia成负相关性。并且向量AN和向量OM呈锐角表明两土壤理化因子可能它们之间对内生细菌属的变化可能具有协同效应。
3 讨论与结论
本试验采用高通量测序方法对CY、KA、DX 3种藓结皮样品的内生菌的群落结构和多样性进行了测序,通过相关处理总共获得178 173条有效序列,并在一致性为97%的水平下共产生705个有效的OTUs,其中每个样本的有效序列均在50 000以上,而胡素静研究的短叶对齿藓内生细菌约在30 000[25],同时结合Alpha 多样性分析结果和物种注释结果反映出3种苔藓的内生细菌物种丰富度。

图7 土壤理化因子与内生细菌类群的相关性分析Fig.7 Canonical correlation analysis (CCA) between soil physiochemical factors and endophyties groups
土生对齿藓在门水平上的主要菌群为蓝藻门(Cyanobacteria,57.91%)、变形菌门(Proteobacteria,41.00%),反扭藓在门水平的主要菌群为蓝藻门(Cyanobacteria,40.05%)、变形菌门(Proteobacteria,40.88%)、放线菌门(Actinobacteria,12.62%),青藓在门水平上的主要种群为蓝藻门(Cyanobacteria,80.49%)、变形菌门(Proteobacteria, 15.26%)、梭杆菌门(Fusobacteria, 2.87%),这些研究结果表明土生对齿藓、反扭藓和青藓3种苔藓的优势菌群在门水平上均为蓝藻门与变形菌门,前期也已有研究表明藓类内生细菌优势门为变形菌门和放线菌门[26-27],这与本研究的结果一致。在极端环境下生长的土生对齿藓、反扭藓和青藓的内生细菌中蓝藻门的相对丰度均在40%以上,而短叶对齿藓[26]和山羽藓[27]的相对丰度皆小于5%,这与本研究结果差异明显。此外,前期研究认为生物结皮中的固氮细菌的优势类群在门水平均为Cyanobacteria和Proteobacteria[27],还有研究表明寄生在藓类体内的蓝细菌具有固氮作用,且具有固氮和固碳能力的蓝细菌可以使其在恶劣和极端环境下,能够在生物结皮形成初期提供必要的营养条件[28-29]。延安地区年降雨量较少,土地贫瘠及温度极差较大,因此,这可能是造成苔藓内生细菌群落结构差异之所在。
在纲分类水平上,3种藓类的内生细菌优势纲均为α-变形菌纲、γ-变形菌纲,与细叶小羽藓的优势纲一致[29],与此研究结果相同,本研究结果表明假单胞细菌属和鞘氨醇属分别在土生对齿藓、青藓和反纽藓中占有较高比例(3.93%~ 24.92%),它们能够分泌胞外多糖黏结土壤颗粒,可以减轻土壤风蚀,变形菌纲中许多种类的细菌能在氮限制条件下具有固氮作用,可以为苔藓植物提供必要的氮素来源。此外,这2个属在其他植物上也为优势属,如吴燕燕等[30]基于高通量测序对桑树内生细菌多样性分析中同样研究表明假单胞细菌属占有重要比例,同时其他研究者对薄荷[31]、大花杓兰[32]、核桃[33]内生细菌的优势属为鞘氨醇细菌属。
生长在同一环境下的土生对齿藓、反扭藓和青藓3种藓类的内生细菌菌群结构和多样性既有相似性又有差异性,周雯娜等[34]及Koua等[35]研究表明,藓类内生菌群落会受到寄主所生活的微环境影响,如温度、湿度和有机质等。基于3个样本Alphy多样性指数比较分析,反扭藓的Shannon指数和Chao1指数值最大,反映出其内生细菌多样性和丰富度最高,并且其有效氮和有机质含量也是最高的,经过PCA分析发现环境因子有效氮(AN)、有机质(OM)对反扭藓的内生细菌有促进作用,此结果与周虹等的研究结果一致[36]。因此,藓类根际微环境的差异会对其内生细菌的结构及其比例有所影响。
综上所述,同一环境下3种藓类的内细菌物种种类丰富,群落结构复杂,且有所差异。本研究结果进一步丰富了陕北同一生境下藓类内生细菌多样性特征,本研究为认识和利用藓类内生菌提供了理论依据。然而本试验尚未探究此3种藓类与其相应的土壤根际菌的关系,还有待下一步深入研究。
