甘肃省沙棘枝枯病病原菌的分离鉴定及其生物学特性
2022-07-20王欣悦胡建忠闫晓玲吴元华韩严锋
陈 悦,王欣悦,胡建忠,闫晓玲,吴元华,韩严锋,夏 博
(1. 沈阳农业大学,辽宁 沈阳 110866;2. 水利部沙棘开发管理中心,北京 100038;3. 黄河水土保持西峰治理监督局,甘肃 庆阳 745000)
沙棘Hippophae rhamnoides是一种兼具生态价值和经济价值的多年生落叶灌木[1]。作为东北地区常用的绿化树种之一,沙棘抗旱能力强且容易繁殖[2],还具有防风固沙、耐盐耐碱的特性。在我国甘肃、青海、内蒙古等西北和西南地区大面积种植沙棘对我国生态环境建设具有重要意义[3]。沙棘果实中含有大量的营养物质,有“维生素C 之王”的美誉,较多大果沙棘品种的引进和栽培满足了人们对果品风味的要求[4]。
沙棘枝枯病又被称为干缩病,曾在俄罗斯大面积流行,是一种危害沙棘的世界性病害[5]。沙棘枝枯病导致沙棘叶片提早黄化脱落,树势早衰,缩短了沙棘的结果期,降低了果实品质,枝条全部枯死后整株死亡,严重危害了沙棘的产业发展。国内外学者对沙棘枝枯病菌进行了大量研究,据报道,具有致病性的枝孢镰刀菌Fusarium sporotrichiella和双丝孢座菌Plowightia hippophaes可能导致了辽宁地区该病害的发生[6]。然而,河西走廊地区发生的沙棘枝枯病病原菌种类鲜见报道[7]。近年来,我国沙棘的种植面积不断增加,一些大果沙棘品种在各地被广泛种植,各种沙棘病害的发生面积也不断扩大。
自2018 年,甘肃省庆阳市沙棘栽培基地内引种的20 个俄罗斯大果沙棘品种出现了严重的疑似沙棘枝枯病症状。秋季沙棘叶片提前褪绿并大量脱落,翌年春季大量枝条不再萌发,较多品种的大果沙棘死亡率超过了60%。2019 年7 月,该基地的20 个大果沙棘品种(5 ~6 年生)出现感病症状,感病沙棘叶片萎蔫黄化,枝干枯萎皱缩,大面积沙棘感病后枯死。为明确该病害的病原菌,本研究中以采集自甘肃省庆阳市的感病沙棘为材料,通过对病原菌的分离鉴定和致病性观测,明确导致该病害发生的病原菌种类,并通过观测统计不同培养基、温度、光照、pH、碳源、氮源等条件下病原菌生长情况和产孢量,对病原菌的生物学特性进行研究,旨在为该病害的防控提供参考。
1 材料与方法
1.1 供试病原样本采集和观测
采集感病沙棘病样,放置于便携式冰箱中。根据沙棘感病后枝条、叶片、根部和茎基部表现出的典型症状,对采集地沙棘枝枯病的发病症状进行观测和记录,包括如下症状的描述[8]:变色(植物组织出现叶片发黄褪绿的症状);落叶(叶片提早脱落);枝条上出现凹陷病斑;枝条干枯皱缩。观测和记录发病沙棘的生长势,感病后是否死亡,部分植株感病后同一植株的其他分株的生长有无影响,感病沙棘的树龄等。
1.2 病原菌分离和纯化
采用常规组织分离法进行病原菌的分离。将采集的沙棘病株样品用蒸馏水冲洗干净,自然晾干。在超净工作台上,用果木剪、解剖刀取病样上病健交界处的4 mm×4 mm 样品组织,并将其置于75%乙醇中浸泡消毒30 s,然后用无菌水冲洗干净,再将其放入2.5%的NaClO 溶液中3 min,用无菌水漂洗3 次后,用已灭菌的滤纸把样品表面水分吸干,最后将样品放在pH 为7.0 的PDA培养基中,25 ℃条件下避光培养3 ~5 d。待组织长出菌落后,采用单胞分离法进行纯化培养。
1.3 病原菌致病性检测
采用科赫氏法则鉴定病原菌。将健康沙棘扦插枝条栽植在含有2.5 kg 无菌土的花盆里,每盆栽植3 根插条,土壤经过福尔马林(40%甲醛)熏蒸处理,密封24 h 消毒。每4 d 向花盆中浇1 次水,其间灌以霍格兰营养液促进生根。待沙棘扦插枝条长出10 ~20 片叶时,使用75%的乙醇对沙棘茎基部进行消毒,用解剖刀在树干上划出“丁”字形伤口,用0.5 cm 打孔器将单孢纯化培养的菌株打成直径0.5 cm 的菌饼,置于伤口上,用蘸取过无菌水的脱脂棉覆盖伤口,使用保鲜膜密封保湿,以不含分离物的PDA 培养基(马铃薯葡萄糖琼脂培养基)作为对照,定期观察沙棘发病情况。取回接后发病植株的病健交界位置进行病原物的再分离。
1.4 病原菌形态特征观察和描述
使用PDA 培养基,25 ℃恒温培养单孢纯化后的待测菌株。7 d 后,对菌落形态和颜色进行观察,在显微镜下观察菌丝的形态及孢子形状和大小等形态特征,结合真菌鉴定手册和病原菌鉴定相关资料进行初步鉴定[9]。
1.5 病原菌分子鉴定
1.5.1 分离物基因组DNA 的提取
在单孢纯化后的菌落上打取直径5 mm 的菌饼,将其置于PD培养液(马铃薯葡萄糖培养液)中,封好封口膜,设置摇床参数为25 ℃、110 r/min,摇培5 d 后,用无菌滤纸过滤培养液,将过滤出的菌丝用无菌水冲洗3 次后置于50 mL 离心管中,在冻干机中冻干3 h,-20 ℃保存备用。病原菌基因组DNA 的提取方法参照真菌基因组快速抽提试剂盒(生工,上海)。
1.5.2 分离物基因组DNA 的扩增和分析
利用真菌通用引物ITS1(5′-TCCGTAGGTG AACCTGCGG-3′)、ITS4(5′-TCCTCCGCT TATTGATATGC-3′)和镰刀菌特异性引物EF-1H(5′-ATGGGTAAGGAAGACAAGAC-3′)、EF-2T(5′-GGAAGTACCAGTGATCATGTT-3′)进 行PCR 扩增反应[10]。2 对引物的PCR 扩增体系(50 μL):Taq PCR Master Mix 25 μL,模板DNA 2 μL,上下游引物各2 μL,ddH2O 19 μL。引物ITS1/ITS4反应条件:94 ℃预变性4 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸45 s,34 个循环。引物EF-1H/EF-2T 反应条件:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,34 个循环;72 ℃延伸5 min。取10 μL PCR 产物,进行1.4%琼脂糖凝胶电泳检测,并将剩余产物送至上海生工生物公司(长春)测序。将测序结果在NCBI 上进行BLAST 比对分析,下载同源性较高的序列,用MEGE 7.0 软件构建病原菌的系统发育树并进行分析。
1.6 病原菌生物学特性检测
1.6.1 培养基对菌丝生长及产孢量的影响
供试培养基为PDA、PSA(马铃薯蔗糖琼脂培养基)、PMA(马铃薯麦芽糖琼脂培养基)、OMA(燕麦琼脂培养基)、CMA(玉米粉琼脂培养基)、Czapek(察氏培养基)、WA(水琼脂培养基)[11]。使用直径5 mm 的无菌打孔器在培养5 d 的病原菌菌落边缘打取菌饼,并将其分别转接到供试的几种培养基平板中央,每种培养基设置3个重复,25 ℃条件下恒温遮光培养。每日采用十字交叉法对菌落直径进行测量,并于培养10 d 后采用血球计数法计算产孢量,重复3 次。
1.6.2 温度对菌丝生长及产孢量的影响
温度条件设置为5、10、20、25、28、30、35 ℃。使用直径5 mm 的无菌打孔器在培养5 d 的病原菌菌落边缘打取菌饼,并将其转接在PDA 培养基平板中央,用封口膜封好后分别置于不同的温度条件下培养,每种温度条件设置3 个重复,恒温遮光培养。每日采用十字交叉法对菌落直径进行测量,并于培养10 d 后采用血球计数法计算产孢量,重复3 次[12]。
1.6.3 光照对菌丝生长及产孢量的影响
光照条件设置为全天光照、全天黑暗、半天光照和半天黑暗。使用直径5 mm 的无菌打孔器在培养5 d 的病原菌菌落边缘打取菌饼,并将其转接在PDA 培养基平板中央,置于人工控制的光照条件下培养,每种光照条件设置3 个重复[13],培养温度为25 ℃。每日采用十字交叉法对菌落直径进行测量,并于培养10 d 后采用血球计数法计算产孢量,重复3 次。
1.6.4 培养基pH 对菌丝生长及产孢量的影响
使用pH 计和配置好的1% NaOH 和1% HCl母液,将PDA培养基的pH分别调至3、4、5、6、7、8、9、10、11 共9 个梯度。使用直径为5 mm 的无菌打孔器在培养5 d 的病原菌菌落边缘打取菌饼,并将其转接在处理过的PDA 培养基平板中央,每个pH 梯度设置3 个重复,25 ℃条件下恒温遮光培养。每日采用十字交叉法对菌落直径进行测量,并于培养10 d后采用血球计数法计算产孢量,重复3次。
1.6.5 碳源对菌丝生长及产孢量的影响
将葡萄糖、麦芽糖、蔗糖、D-果糖、乳糖、可溶性淀粉共6 种碳源,以相当于Czapek 培养基中20 g 蔗糖的含碳量,置换其中的蔗糖,将含不同碳源的培养基使用高压灭菌锅灭菌,倒成平板。使用直径为5 mm 的无菌打孔器在培养5 d 的病原菌菌落边缘打取菌饼,并将其转接在处理过的Czapek 培养基平板中央,每处理设置3 个重复,25 ℃恒温遮光培养。每日采用十字交叉法对菌落直径进行测量,并于培养10 d 后采用血球计数法计算产孢量,重复3 次[14]。
1.6.6 氮源对菌丝生长及产孢量的影响
以NH4Cl、(NH4)2SO4、NaNO3、牛肉膏、蛋白胨、酵母浸膏、尿素、甘氨酸共8 种物质为氮源,以相当于Czapek 培养基中2 g NaNO3的含氮量,置换其中的NaNO3,将含有不同氮源的培养基使用高压灭菌锅灭菌,倒成平板。使用直径为5 mm的无菌打孔器在培养5 d 的病原菌菌落边缘打取菌饼,并将其转接在处理过的Czapek 培养基平板中央,每处理设置3 个重复,25 ℃恒温遮光培养。每日采用十字交叉法对菌落直径进行测量,并于培养10 d后采用血球计数法计算产孢量,重复3次[15]。
2 结果与分析
2.1 感病植株症状
发病的较细侧枝通常出现树皮皱缩的症状,一些枝条表皮会出现小颗粒的黑色点状物(图1)。短期内对主枝和其他侧枝的影响较小,通常在感病2 ~3 a 后枝条长势衰弱或干枯死亡(图2)。如果发病枝条为主枝,将会导致整株沙棘逐渐发病,树体逐渐枯萎死亡(图3)。

图1 沙棘枝枯病发病初期叶片症状Fig. 1 Leaf symptoms of sea buckthorn stem wilt at the initial stage of onset

图2 沙棘枝枯病发病后期枝症状Fig. 2 Symptoms of sea buckthorn stem wilt in the later stage

图3 沙棘枝枯病田间症状Fig. 3 Field symptoms of sea buckthorn stem wilt
对所调查感病沙棘的根部进行解剖后发现,茎基部出现黑褐色病变特征(图4),但在邻近根系暂未观测到黑褐色病变症状。重度感病沙棘的结实量明显降低,病害严重影响了沙棘果实的产量和品质。

图4 沙棘枝枯病发病植株的茎基部横截面Fig. 4 Cross section of stem base of sea buckthorn stem wilt
2.2 病原菌的鉴定
2.2.1 致病性鉴定
对所采集的感病沙棘植株进行病原菌分离,共得到56 个菌株。选取经过初步形态学鉴定的9 个代表菌株,经室内纯化培养5 d 后,接种于盆栽的沙棘枝干上,试验结果见表1。由表1 可知:接种了G7-5-2、G7-5-3、G4-5-1、G6-5-2、G25-5-3菌株的沙棘植株均未表现出明显的发病症状;接种了G4-5-3、G1-5-2、G5-5-2 菌株的沙棘植株零星发病,发病率在35%以下,其发病症状为韧皮部有凹陷病斑,叶片无症状;接种了G1-5-1 菌株的沙棘植株发病率达到84.6%,发病症状均为病斑连结成片,落叶严重,后期枝条干枯,与甘肃田间沙棘植株的发病症状一致。将接种了G1-5-1 菌株的沙棘植株发病部位的病健交界处进行再分离培养,与原菌落形态一致,经显微镜观察发现其孢子形态也与原菌株孢子形态一致。根据科赫氏法则,所分离菌株G1-5-1 对沙棘存在典型的致病性,证明该菌株为沙棘枝枯病的病原菌。

表1 分离病原菌的盆栽接种试验结果Table 1 Isolation number and potted inoculation test results
2.2.2 形态学鉴定
将菌株G1-5-1 在PDA 培养基上培养5 d 后,在显微镜下进行观察,如图5 所示。PDA 培养基上的菌落生长迅速,菌丝致密且最初呈现粉白色(图5A),并在平板底部产生粉红色色素沉淀(图5B)。产生的大型孢子中度弯曲,具有3 ~5 个明显的隔膜,呈透明状,壁厚,大小为(27.8±3.6) μm×(4.8±0.5) μm(n=30,n为孢子数量)。小型孢子形态丰富,呈梨形、椭圆形或梭形,基部常有乳突,(8.4±2.2) μm×(3.1±0.3) μm(n=30)。形态学鉴定结果表明,该菌株具有镰刀菌的特征。

图5 沙棘枝枯病病原菌形态Fig. 5 Morphology of the pathogen of sea buckthorn stem wilt
2.2.3 分子鉴定
测序结果显示,ITS 片段长度为523 bp,NCBI上 登 录 号 为MN160235.1 和MN160237.1。EF 片段长度为682 bp,NCBI 上登录号为MN429075.1和MN429076.1。 将ITS 与EF 测 序 结 果 在GenBank 上进行比对,结果表明:菌株序列MN160235.1 与数据库中基因登录号AY188917 菌株的ITS 序列同源性为99.8%(图6);菌株序列MN429075.1 与数据库中基因登录号MH582286 菌株的EF 序列同源性达到100%(图7)。在基于ITS 序列所构建的系统发育树中,G1-5-1 与拟枝孢镰刀菌F. sporotrichioides的同源性达到100%;在基于EF 序列所构建的系统发育树中,G1-5-1 与拟枝孢镰刀菌的同源性达到99%。结合形态学鉴定结果,可知引起甘肃省庆阳市沙棘枝枯病且致病力较强的G1-5-1 菌株为拟枝孢镰刀菌。

图6 基于ITS序列构建的沙棘枝枯病病原菌系统发育树Fig. 6 Phylogenetic tree constructed based on ITS sequences
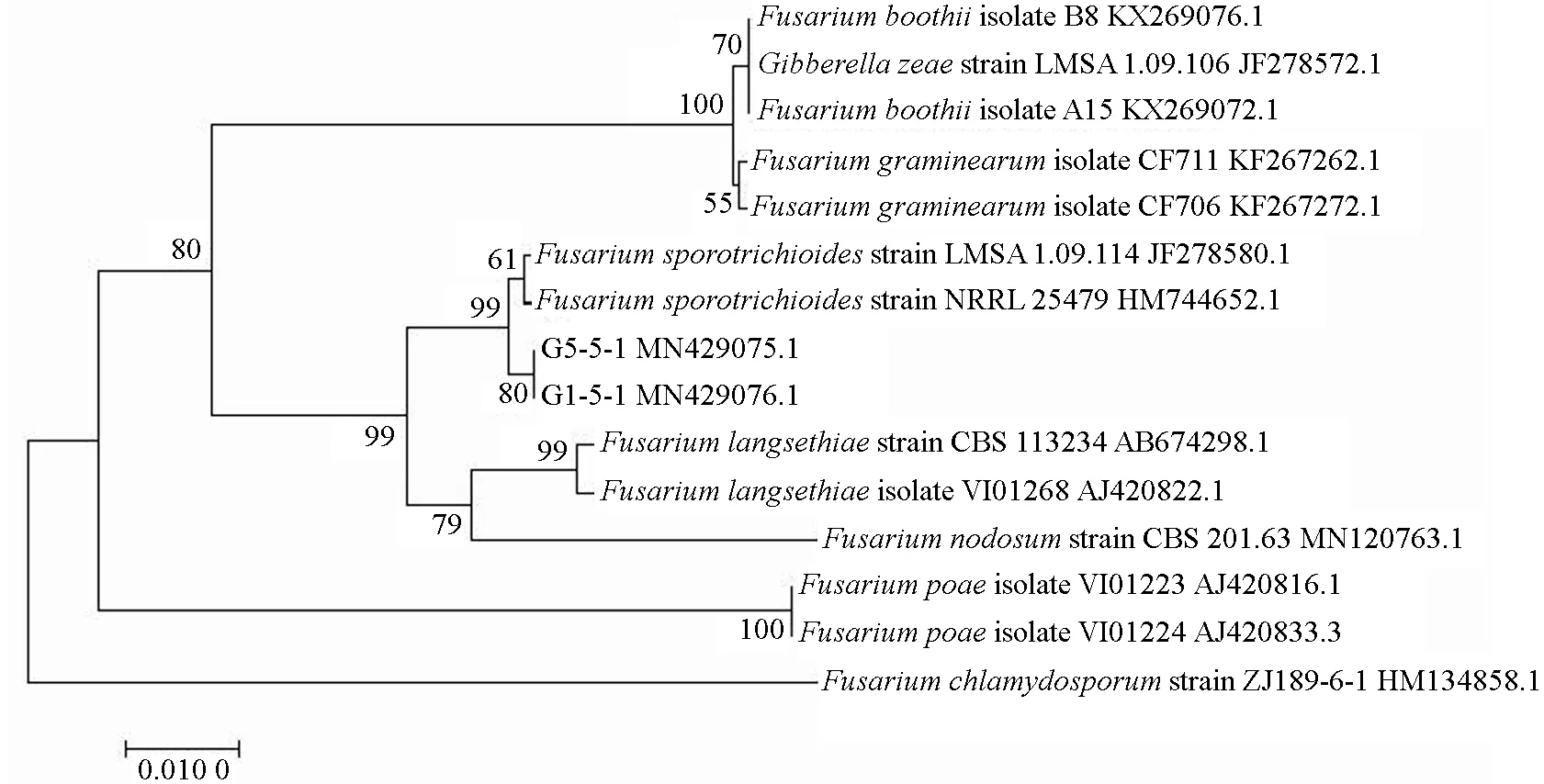
图7 基于EF序列构建的沙棘枝枯病病原菌系统发育树Fig. 7 Phylogenetic tree constructed based on EF sequences
2.3 病原菌的生物学特性
2.3.1 培养基对拟枝孢镰刀菌菌落直径和产孢量的影响
不同培养基上拟枝孢镰刀菌的菌落直径和产孢量分别如图8 ~9 所示。由图8 ~9 可见,拟枝孢镰刀菌在7 种供试培养基上均可生长,不同种类的培养基对拟枝孢镰刀菌菌丝生长的影响存在显著差异,对产孢量的影响差异显著。病原菌菌丝在WA 和OMA 培养基上生长速度较慢,且菌丝稀疏,在PDA、PSA、PMA、CMA 和Czapek培养基上生长速度相对较快,在PDA 培养基上生长速度最快,培养7 d 后菌落平均直径可达75.6 mm。病原菌在CMA 培养基上产孢量最大,培养10 d 后每毫升培养基上产孢量可达5.24×105;在WA 和Czapek 培养基上产孢量较低。

图8 不同培养基上拟枝孢镰刀菌的菌落直径Fig. 8 Effects of different media on mycelial growth of F. sporotrichioides

图9 不同培养基上拟枝孢镰刀菌产的孢量Fig. 9 Effects of different media on sporulation of F. sporotrichioides
2.3.2 温度对拟枝孢镰刀菌菌落直径和产孢量的影响
不同温度条件下拟枝孢镰刀菌的菌落直径和产孢量如图10 ~11 所示。由图10 ~11 可见,在不同温度条件下,拟枝孢镰刀菌的菌落直径和产孢量均有显著差异。15 ~30 ℃均有孢子产生,最适菌丝生长温度为25 ℃,培养7 d 后菌落平均直径达到76 mm,当温度为5 ℃时几乎不生长。产孢的最适温度为25 ℃,培养10 d 后每毫升培养基上产孢量为19.30×105。
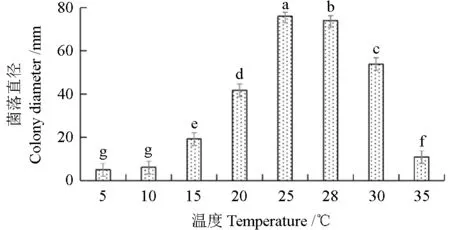
图10 不同温度条件下拟枝孢镰刀菌的菌落直径Fig. 10 Effects of different temperatures on mycelial growth of F. sporotrichioides

图11 不同温度条件下拟枝孢镰刀菌的产孢量Fig. 11 Effects of different temperatures on sporulation of F. sporotrichioides
2.3.3 光照对拟枝孢镰刀菌菌落直径和产孢量的影响
不同光照条件下拟枝孢镰刀菌的菌落直径和产孢量如图12 ~13 所示。由图12 ~13 可见,不同光照条件对拟枝孢镰刀菌的菌落直径和产孢量的影响差异显著。全黑暗的条件更有利于菌丝的生长和产孢,全黑暗培养7 d 后菌落直径可达74.6 mm,培养10 d 后每毫升培养基上产孢量为15.56×105。在全光照培养条件下每毫升培养基上产孢量最少,为2.67×105。

图12 不同光照条件下拟枝孢镰刀菌的菌落直径Fig. 12 Effects of different light on mycelial growth of F. sporotrichioides

图13 不同光照条件下拟枝孢镰刀菌的产孢量Fig. 13 Effects of different light on sporulation of F. sporotrichioides
2.3.4 培养基pH 对拟枝孢镰刀菌菌落直径和产孢量的影响
不同培养基pH 条件下拟枝孢镰刀菌的菌落直径和产孢量如图14 ~15 所示。由图14 ~15 可见,在培养基pH 为3 ~11 时拟枝孢镰刀菌的菌丝均可生长,适宜菌丝生长的培养基pH 为5 ~9,适宜产孢的培养基pH 为5 ~7。当培养基pH 为6 时,每毫升培养基上产孢量最高,可到达31.41×105。说明偏酸环境更适宜拟枝孢镰刀菌产孢。

图14 不同培养基pH条件下拟枝孢镰刀菌的菌落直径Fig. 14 Effects of different pH on mycelial growth of F. sporotrichioidess
2.3.5 碳源对拟枝孢镰刀菌菌落直径和产孢量的影响
不同碳源条件下拟枝孢镰刀菌的菌落直径和产孢量如图16 ~17 所示。由图16 ~17 可见,6 种碳源对拟枝孢镰刀菌的菌落直径和产孢量的影响存在显著差异。以蔗糖作为碳源时,拟枝孢镰刀菌菌丝的生长速度最快,其产孢量也达到最大,培养7 d 后菌落平均直径可以达到72.8 mm,培养10 d 后每毫升培养基上产孢量为10.69×105。培养10 d 后,以D-果糖为碳源的培养基上菌丝生长最慢,菌落平均直径为57.2 mm,以可溶性淀粉为碳源的每毫升培养基上产孢量最少,为2.35×105。
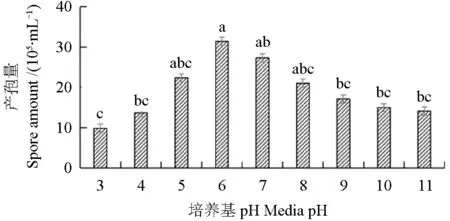
图15 不同培养基pH条件下拟枝孢镰刀菌的产孢量Fig. 15 Effects of different pH values on sporulation of F. sporotrichioides

图16 不同碳源条件下拟枝孢镰刀菌的菌落直径Fig. 16 Effects of different carbon sources on mycelial growth of F. sporotrichioides
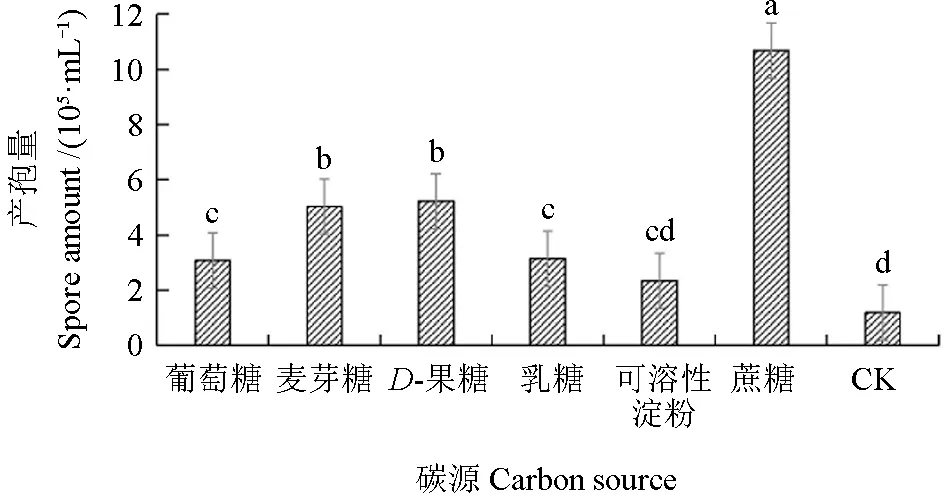
图17 不同碳源条件下拟枝孢镰刀菌的产孢量Fig. 17 Effects of different carbon sources on sporulation of F. sporotrichioides
2.3.6 氮源对拟枝孢镰刀菌菌落直径和产孢量的影响
不同氮源条件下拟枝孢镰刀菌的菌落直径和产孢量如图18 ~19 所示。由图18 ~19 可见,在8种氮源的培养基上,菌落直径和产孢量均存在显著差异。以酵母浸膏为氮源时拟枝孢镰刀菌菌丝生长最快,以甘氨酸为氮源时产孢量最大。以尿素为氮源时拟枝孢镰刀菌生长最慢,以NaNO3为氮源时产孢量最少,培养10 d 后每毫升培养基上产孢量为6.27×105。

图18 不同氮源条件下拟枝孢镰刀菌的菌落直径Fig. 18 Effects of different nitrogen sources on mycelial growth of F. sporotrichioides

图19 不同氮源条件下拟枝孢镰刀菌的产孢量Fig. 19 Effects of different nitrogen sources on sporulation of F. sporotrichioides
3 结论与讨论
研究结果表明,甘肃庆阳市沙棘枝枯病的病原菌为拟枝孢镰刀菌。在PDA 培养基上拟枝孢镰刀菌菌丝生长速度较快,菌落直径为75.6 mm;在CMA 培养基上产孢量最大,每毫升培养基上产孢量达5.24×105。利于拟枝孢镰刀菌菌丝生长的条件:全黑暗条件、25 ℃、培养基pH 6、蔗糖碳源,酵母浸膏氮源。利于拟枝孢镰刀菌菌丝产孢的条件:全黑暗条件、25 ℃、培养基pH 6、蔗糖碳源、甘氨酸氮源。拟枝孢镰刀菌在多种培养基上均可以生长、产孢,可利用多种碳源、氮源,对温度的适应性较好,能够适应不同的环境,沙棘枝枯病的防治难度较大。
沙棘病害种类众多,沙棘枝枯病是沙棘较为严重的病害之一。通过对沙棘枝枯病病原菌的分离鉴定、形态特征观察、分子生物学鉴定和致病性验证,结果表明引起甘肃沙棘枝枯病的致病菌为拟枝孢镰刀菌。据报道,引起我国黑龙江省沙棘枝枯病的致病菌也是拟枝孢镰刀菌[16])。其他种类的镰刀菌属真菌也可能引起沙棘枝枯病。致病性接种试验的结果表明,三线镰刀菌F. tricinctum和木贼镰刀菌F. equiseti未对沙棘植株表现出强致病力,接种后田间发病植株未出现枝枯病症状,这可能与本试验中分离获得的镰刀菌种类较少有关,应进一步深入研究。
镰刀菌是一类分布广泛的真菌,可侵染多种植物,造成植物萎蔫甚至死亡,严重影响作物的产量和品质[17]。镰刀菌还可分泌多种毒素,如单端孢霉烯真菌毒素、玉米赤霉烯酮毒素[18]。这2种毒素是谷类饲料和青贮料中普遍存在的霉菌毒素,与人类的健康关系密切,能引发粮食中毒症、食物中毒性白细胞缺乏(ATA)、树节孢霉中毒症等[19]。植物内生真菌对多种植物病菌具有专一拮抗作用,现已成为生物防治中主要的微生物农药,对病原菌具有较好的拮抗作用[20]。目前,生物防治是绿色防控镰刀菌病害的主要方法。例如,芽孢杆菌对镰刀菌病害的防控效果较好,并且能够对植物的生长起到促进作用[21]。
在不同碳源、氮源处理中,沙棘枝枯病的致病菌拟枝孢镰刀菌在以蔗糖为碳源的培养基上长势最佳,最适氮源为酵母浸膏;利于产孢的最适碳源为蔗糖,最适氮源为甘氨酸。前人研究结果表明:分离自紫花苜蓿根腐病的致病菌拟枝孢镰刀菌的最适生长碳源为葡萄糖,最适氮源为蛋白胨;在光暗交替的条件下,其菌丝生长最好,光照条件下最有利于该病原菌产孢[22-23]。本试验结果表明,沙棘枝枯病病原菌拟枝孢镰刀菌在25 ℃时产孢量最高,与浙江莲藕腐烂病菌的最适产孢温度相同[24]。在研究光照对病原菌生长影响的试验中发现,全黑暗的条件利于拟枝孢镰刀菌G1-5-1 菌株生长及产孢。因条件有限,本试验中仅以甘肃庆阳地区的发病沙棘为研究对象,为有效防控沙棘枝枯病,应进一步对不同品种、不同地区的发病沙棘进行研究。
