檀香组培苗瓶外微扦插研究
2022-07-20刘英
刘 英
(中国林业科学研究院 热带林业研究所,广东 广州 510520)
檀香Santalum album为檀香科Santalaceae 檀香属Santalum常绿小乔木,主要分布于印度、印度尼西亚、澳大利亚以及太平洋群岛,我国在20世纪初开始引种檀香,目前已有百余年历史。檀香是一种半寄生植物,其根端着生吸盘,吸附于寄主植物从而吸收其水分和养分。其木材可用作高级工艺雕刻品原材,亦可用于提炼檀香油。檀香油常用于香薰、香水及中药[1-2],深受人们喜爱。然而,当前我国生产上采用实生苗造林,往往出现个体分化严重、管理难度大、产量低等问题,制约了檀香的推广种植。应用经选育的优树材料,通过组培快繁将其无性系化并予以推广应用,有助于推动檀香种植业的快速发展。
众所周知,制约檀香无性系组培快繁成败的最关键之处在于生根培养,尽管已有繁殖少量植株的报道,然而其方法尚有待优化[3]。此技术瓶颈一直困扰檀香优良无性系的推广应用,学者们也重点关注其生根研究。Sanjaya 等[3]从50 ~60年生成年树上采集枝条作为外植体开展组培研究,其生根率最高达50%,生根诱导难度大。马国华等[4]亦采取成年枝开展组培研究,生根率高达87%,移植成活率达95%以上,但生根诱导需要时间长达3 个月,炼苗及田间移植成活又需要3个月;由于生根不整齐,移植成活时间长,导致管理难度大。陈伟玉等[5]采用檀香种胚开展组培试验,瓶苗能诱导出根原基,但未能长出根系,且瓶苗随培养时间的延长而落叶甚至死亡。笔者曾以1/4MS 为生根诱导基本培养基,调整AB 生根粉1 号、NAA 和IBA 的质量浓度,开展6 个优树无性系的组培生根诱导,未能成功生根,80%以上的无根瓶苗出现落叶并逐渐死亡。可见,檀香无性系间组培生根诱导差异明显,生根难度大。
组培苗瓶外微扦插是解决难生根树种优质苗木扩繁的一种主要技术措施[6-8],可缩短育苗周期,降低生产成本,提高经济效益[9-11]。微扦插成败关键在于瓶苗质量与微扦插技术。在组织快繁中,蔗糖为植物提供碳源和能源,氮为植物蛋白质合成的重要元素,以NH4NO3和KNO3为常用氮源,硝铵态氮配比显著影响植物生长[12],糖[13-16]和氮[17-18]浓度的高低直接影响瓶苗的生长及质量。组培苗瓶外微扦插过程中,基质为植物提供必要的根系生长发育环境,其成分和配比显著影响基质的物理性质[19],进而影响苗木生长[20]和生根率及根系发育[21-24]。此外,瓶苗质量亦显著影响微扦插成活率。王蓉等[25]发现,葡萄组培瓶苗茎髓部的老化程度可能影响其根源基的形成,培育40 d的瓶苗优于20 d 及60 d,扦插后生根率最高,污染率最低,宜用于瓶外扦插;澳洲茶树组培瓶苗在高度≥3 cm 时瓶外生根效果最好[26]。因此,本研究设置系列蔗糖质量浓度以及NH4NO3和KNO3质量浓度开展预生根试验,以培育健壮的预生根瓶苗;设置系列基质配比、预生根瓶苗规格开展瓶外微扦插试验,筛选适宜的微扦插基质及预生根瓶苗高度。进一步应用6 个檀香优良无性系验证研发技术的应用效果,评定其微扦插难易程度,为檀香种植业提供适宜规模推广的优良无性系及组培苗生产技术。
1 材料与方法
1.1 材 料
参试檀香无性系共6 个,其中1 号无性系选自广东省南海市林农种植的檀香林,12、18、19、21、22 号为广东省高明檀香基地8年生种源试验林内的优树无性系。所有试验于中国林业科学研究院热带林业研究所良种繁育中心完成。
1.2 方 法
基于LY 培养基[27]进行改良,将NH4NO3使用质量浓度提高为660 mg·L-1,6-BA 使用质量浓度降低为0.08 mg·L-1,作为檀香继代增殖培养的基本培养基。6 个无性系继代培养15 次。以1 号无性系继代苗为材料进行预生根培养试验及瓶外微扦插试验;应用全部6 个优良无性系的继代苗对试验结果进行验证,并开展无性系对比试验。
1.2.1 预生根培养基的筛选
剪取继代培养中高度约2.5 cm 的单芽,分别接种于预生根培养基上,于室温24±1℃、光照强度1 800 ~3 000 Lux、光照8 h/d 的条件下培养。培养30 d 后,调查苗高、基径、叶片数、落叶率(落叶数/总叶片数×100%)以及最大叶长和叶宽,筛选预生根培养基。
预生根培养基的研制考虑糖质量浓度和氮源及质量浓度筛选两个试验。每个处理重复4 次,每次重复20 个单芽。
糖质量浓度的筛选:以1/2MS 大量元素、MS微量元素和有机质为预生根诱导基本培养基,添加0.8 mg·L-1ABT 1 号 生 根 粉、0.4 mg·L-1IBA 及0.4 mg·L-1NAA。参 考 山 薯Dioscorea fordii[15]和金钻蔓绿绒Philodendron‘Con-go’[16]组培试验的蔗糖质量浓度梯度,设置0、5、10、15、20、25、30、35、40 和45 g·L-1共计10 个蔗糖质量浓度处理,参试单芽共800 个。
NH4NO3和KNO3质量浓度的筛选:基于糖质量浓度的筛选结果,选择最佳蔗糖质量浓度,参照本研究中檀香增殖培养以及茶树Camellia sinensis[17]和多花黄精Polygonatum cyrtonema[18]组培试验所使用的NH4NO3和KNO3质量浓度,设置0、330、660、1 320 mg·L-1的NH4NO3及380、760、1 520、3 040 mg·L-1的KNO3进行氮源及质量浓度筛选试验,共16 个处理(表1),KH2PO4、CaCl2、MgSO4等质量浓度、激素种类和质量浓度以及微量元素和有机质含量与蔗糖质量浓度筛选试验相同,参试单芽共1 280 个。
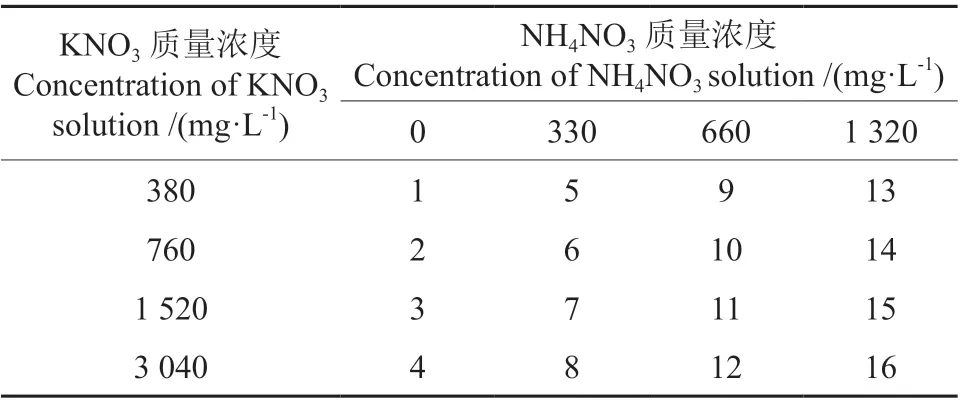
表1 氮源及质量浓度试验设计†Table 1 Tests of nitrogen sources and their concentrations
1.2.2 瓶外微扦插
瓶外微扦插共设置3 个试验,均按照随机区组设计。采取经10 d 炼苗的预生根瓶苗进行瓶外微扦插。扦插前用0.5%高锰酸钾消毒各处理基质,扦插时取出预生根瓶苗,清水清洗去除残余培养基,不修剪基部,直接插入基质,2 个星期内盖薄膜保湿,并适当遮阴。扦插25 d 后,每周喷施1 次1/4 MS 的大量元素,每月喷施1 次MS 的微量元素。
基质配比试验:以蛭石和黄心土为主、泥炭土为辅,设置不同配比的9 种基质开展微扦插试验(表2)。每个处理重复10 次,每次重复40 株,参试预生根瓶苗共3 600 株。

表2 檀香瓶外微扦插参试基质†Table 2 The tested media for the micro-cutting of Santalum album
预生根瓶苗高选择试验:依据基质配比试验结果,采用效果最佳的基质,设置2.0 ~3.0、3.1 ~3.5、3.6 ~4.0、4.1 ~4.5、4.6 ~5.0、5.1 ~5.5 cm 共6 个瓶苗高度处理,开展预生根瓶苗微扦插试验,每个处理重复3 次,每次重复50 株,参试瓶苗共900 株。
无性系对比试验:采用糖质量浓度及NH4NO3和KNO3质量浓度筛选试验得出的最佳方案培育1、12、18、19、21、22 等6 个无性系的预生根瓶苗。应用基质配比和预生根瓶苗高选择试验得出的最佳基质和瓶苗高度,布设无性系微扦插对比试验。每个无性系重复3 次,每次重复50 株,参试预生根瓶苗共1 050 株。
基质配比试验为早期试验,由于瓶苗数量有限,为了保障后期造林试验用苗,扦插2 个月后仅调查生根率。然后进行预生根瓶苗高度筛选和无性系比较试验,扦插3 个月后,调查生根条数、根长、苗高、叶片数、吸盘数,吸盘数为生根苗根系上的吸盘个数。按照如下公式计算生根率和吸盘率。

1.3 数据分析
应用SPSS13.0 软件对试验数据进行方差分析和多重比较。方差分析之前,对百分数数据进行反正切转换。
2 结果与分析
2.1 预生根瓶苗培养
2.1.1 蔗糖质量浓度对预生根瓶苗生长的影响
由表3 可以看出,蔗糖质量浓度对瓶苗生长及落叶影响极显著(P<0.01)。在0 ~45 g·L-1质量浓度范围内,落叶率、叶片长度和宽度随蔗糖质量浓度升高而降低并趋于稳定,瓶苗高、叶片数随蔗糖质量浓度升高而增大并逐渐稳定。无蔗糖培养基处理,95%的瓶苗出现基部坏死,63.75%的瓶苗死亡;5 g·L-1蔗糖质量浓度处理,1.25%的瓶苗出现基部坏死,其落叶率在各加糖处理中最高,达65.71%。这两个处理的苗高最小。苗高在25 g·L-1质量浓度处理最大,显著大于10 g·L-1及以下处理(P<0.05);叶片数在30 g·L-1质量浓度处理最多,显著高于15 g·L-1及更低蔗糖质量浓度处理。叶片长度及宽度分别在45 g·L-1及40 g·L-1质量浓度处理最小,显著小于15 g·L-1及以下处理。落叶率在40 g·L-1处理最低,为0.67%,显著低于20 g·L-1及以下处理。整体而言,40 g·L-1蔗糖质量浓度处理不仅落叶率低,而且瓶苗生长旺盛,宜用于檀香组培瓶苗的预生根培养。
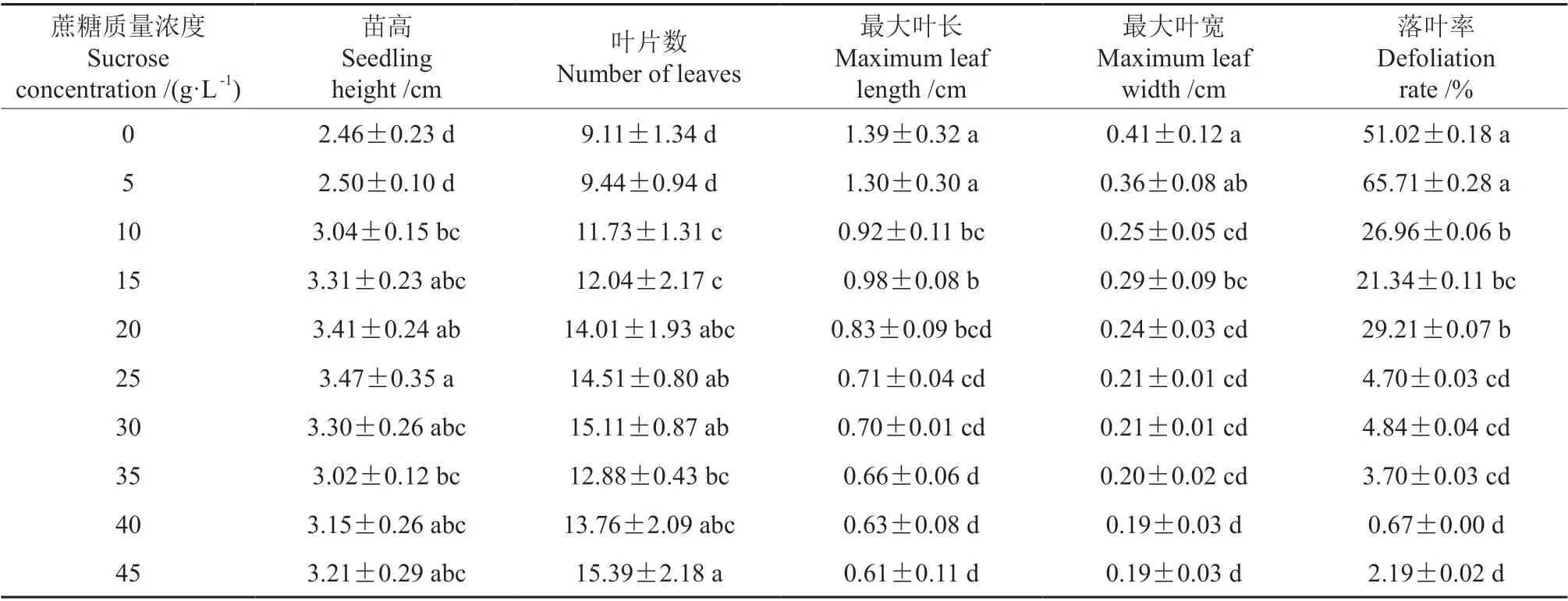
表3 蔗糖质量浓度处理间檀香预生根苗生长的比较†Table 3 Comparison of the growth of the pre-rooted Santalum album plantlets treated with different sucrose concentrations
2.1.2 NH4NO3和KNO3质量浓度对预生根瓶苗生长的影响
NH4NO3质量浓度对瓶苗生长的影响较KNO3大(表4)。参试的NH4NO3质量浓度处理间檀香瓶苗基径、苗高、叶片数、最大叶长、落叶率达到极显著差异,最大叶片宽达显著差异。参试的KNO3质量浓度处理间,最大叶片宽差异极显著,基径、最大叶长及落叶率差异显著,苗高及叶片数差异不显著(P≥0.05)。NH4NO3和KNO3质量浓度的交互作用对基径及最大叶宽生长影响极显著,对叶片数影响显著。
在参试质量浓度范围内,落叶率随NH4NO3质量浓度的增加呈先降后升的趋势,各质量浓度处理间差异极显著;在380 ~1 520 mg·L-1的KNO3质量浓度范围内落叶率基本稳定,3 040 mg·L-1处理则显著升高。基径随两氮源质量浓度的增加呈先升后降的趋势,各处理间差异极显著或显著。苗高随NH4NO3及KNO3质量浓度的增加分别呈现极显著的单调递增和无显著差异的先升后降的趋势。叶片数随NH4NO3质量浓度的增加极显著增多,随KNO3质量浓度的增加缓慢减少并趋于稳定,差异不显著。最大叶长、最大叶宽随NH4NO3及KNO3质量浓度的增加分别呈现单调递增和先升后降的趋势,各处理间差异达极显著或显著水平。
由 表4 可 知,660 mg·L-1的NH4NO3和1 520 mg·L-1的KNO3组合,不仅落叶率低,瓶苗的各项生长指标值均为最高或较高,适宜作为檀香预生根苗培养的氮源。
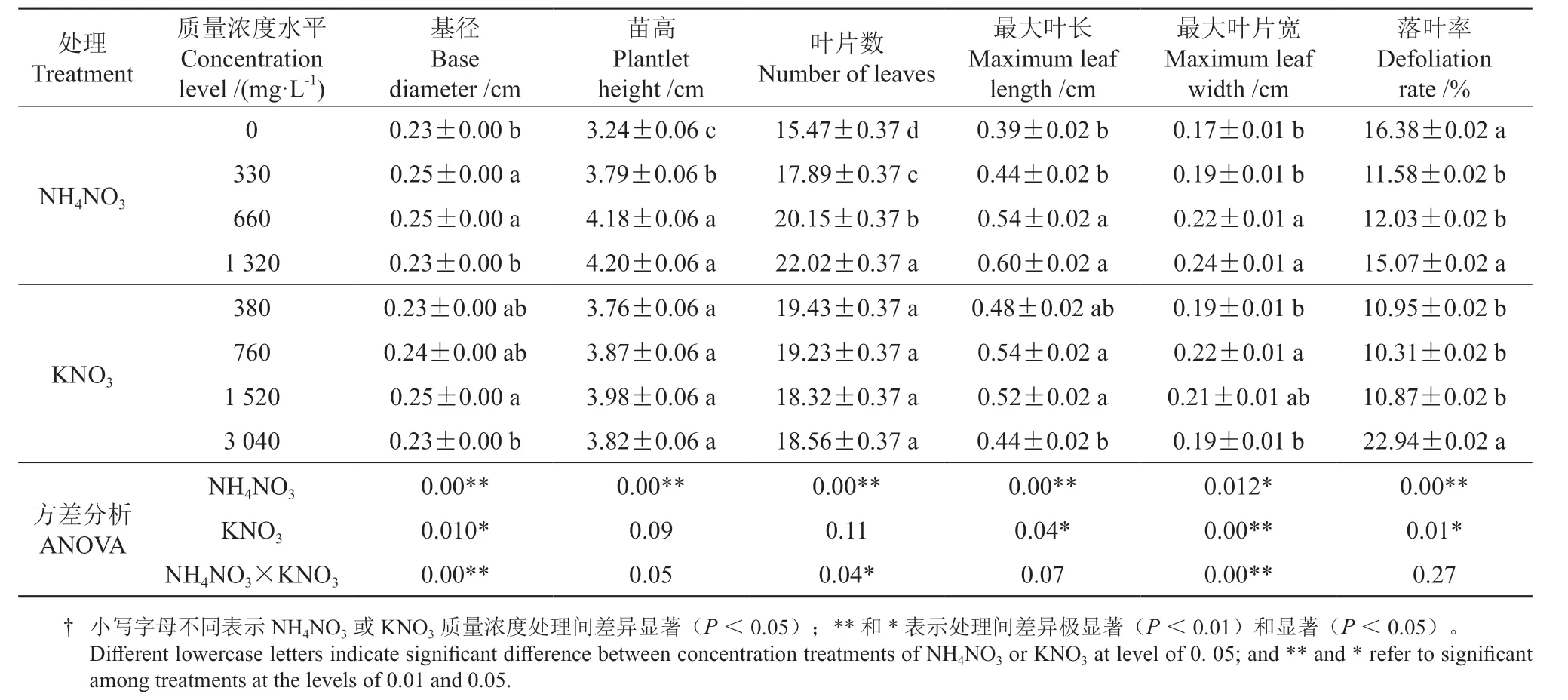
表4 NH4NO3 和KNO3 质量浓度处理间预生根瓶苗的生长差异†Table 4 Growth differences of the pre-rooted Santalum album plantlets treated with various NH4NO3 and KNO3 concentrations
2.1.3 预生根培养基的无性系验证
选取1、12、18、19、21、22 等6 个无性系,进一步对上述适宜蔗糖质量浓度及NH4NO3和KNO3质量浓度进行验证(图1),发现1、18、21、22 等4 个无性系瓶苗生长旺盛,无落叶现象出现;相对于上述4 个无性系,12 号无性系叶片较大,19 号无性系叶片较小,两者分别有约5%和13%的落叶率,仍能进行预生根瓶苗生产。

图1 6 个檀香无性系的预生根培养效果Fig. 1 The effect of pre-rooting tissue culture of the six Santalum album clones
2.2 预生根瓶苗瓶外微扦插
2.2.1 基质对微扦插生根的影响
微扦插生根率随黄心土比例的增加、蛭石比例的减少呈现先上升后下降的趋势,各处理间差异极显著(图2,P<0.01)。以4号基质处理(蛭石∶泥炭土∶黄心土=6∶1∶3,V/V)的生根率最高(68.08%±0.04%),显著高于其他处理(P<0.05),3 号(2∶1∶7)和2 号(1∶1∶8)基质处理的生根率最低,与7 号基质处理(3∶1∶6)差异不显著,而显著低于其他处理。由此可见,蛭石∶泥炭土∶黄心土按6∶1∶3 配比的混合基质适宜用于檀香组培瓶苗的微扦插。
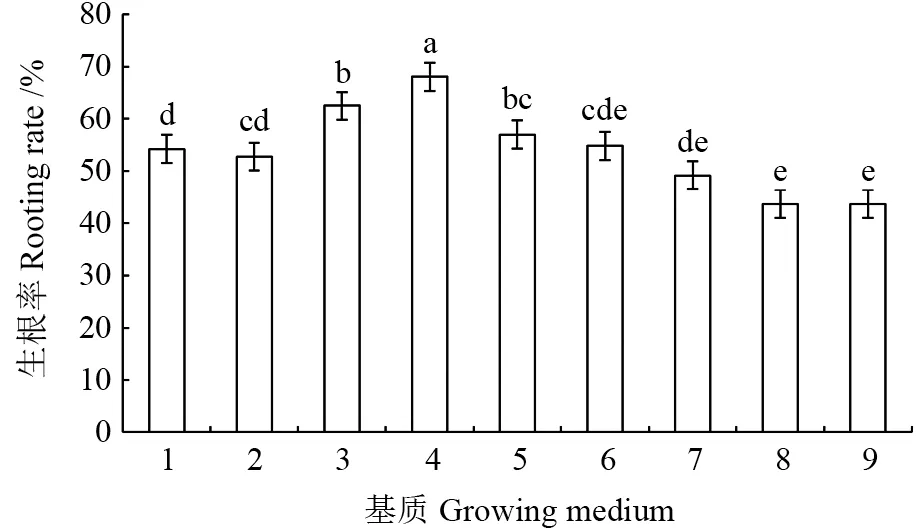
图2 基质处理间檀香预生根组培瓶苗微扦插60 d 后生根率的比较Fig. 2 Comparison of the rooting rates of the pre-rooted plantlets of Santalum album after micro-cutting for 60 days
2.2.2 瓶苗高对扦插生根的影响
表5 为预生根瓶苗高对檀香微扦插生根的影响。当预生根瓶苗高为2.0 ~5.5 cm 时,生根率及吸盘率随苗高的增大呈先上升后下降的趋势,根数、根长及吸盘数则升高。各苗高级处理间除了吸盘率差异不显著之外(P≥0.05),其他根系指标均差异显著。3.6 ~5.5 cm 高度范围内各处理间生根率、根条数、根长、吸盘数等4 项根系指标值差异不显著,显著高于2.0 ~3.0 cm 高度范围内各处理。以4.6 ~5.0 cm 高度级处理的生根率最高(69.74%±0.13%);5.1 ~5.5 cm 高度级处理的根条数、根长、吸盘数最大,分别为1.50±0.17、11.10±0.40 cm 和7.833±1.03;4.1 ~4.5 cm高度级处理的吸盘率最高(86.60%±0.06%)。可见,预生根苗高度显著影响微扦插的生根成活率,3.6 ~5.5 cm 高檀香组培瓶苗适宜用于微扦插,尤以4.6 ~5.0 cm 高的组培瓶苗微扦插效果最好。
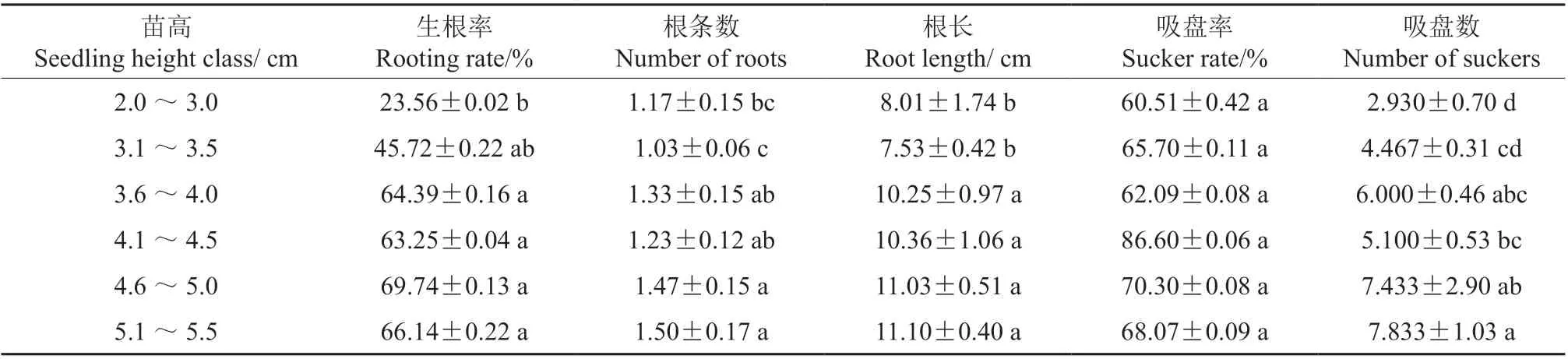
表5 预生根瓶苗高对檀香微扦插生根的影响(90 d)†Table 5 Effects of the height of plantlets on the rooting properties of Santalum album after micro-cutting for 90 days
2.2.3 无性系间微扦插生根特性差异分析
由表6 可知,不同无性系间微扦插生根能力差异显著。6 个无性系中,18 号无性系的生根率、吸盘率、根条数、根长、吸盘数为最高(87.12%、83.09%、1.64、13.78 cm、7.80),显著高于其他5个无性系,属易扦插无性系;21 号和1 号无性系的生根率、吸盘率、吸盘数显著高于22 号、19 号和12 号无性系,为较易扦插无性系;22 号无性系的生根率、吸盘率显著高于19 号及12 号,为较难扦插无性系;12 号和19 号无性系的生根率、吸盘率及吸盘数最低,为难扦插无性系。图3 为18 号无性系瓶外微扦插3 个月后的生长和生根情况。
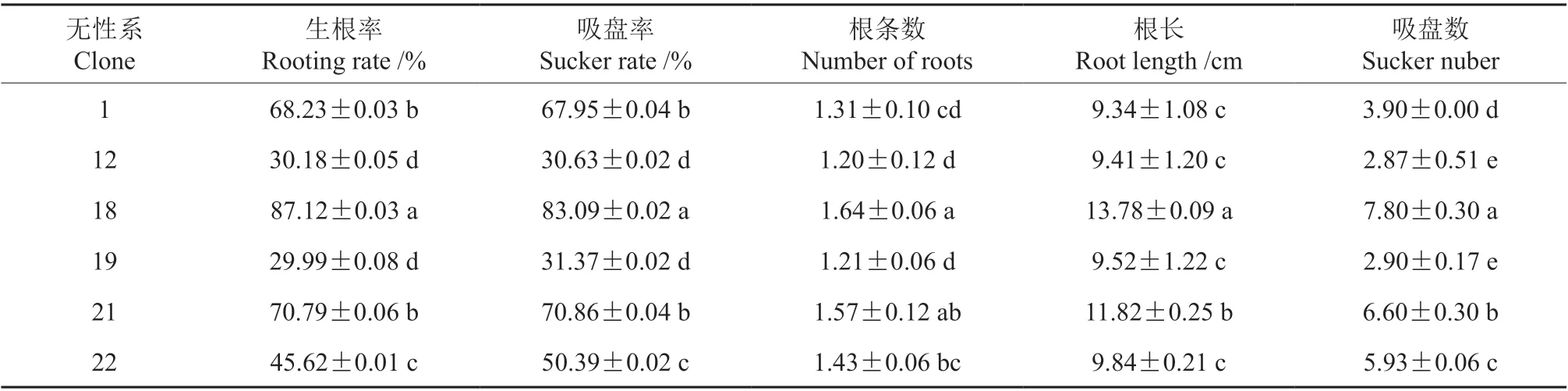
表6 6 个檀香无性系间微扦插3 个月后的生根差异†Table 6 Rooting differences between the six Santalum album clones after micro-cutting for 3 months

图3 檀香18 号无性系的瓶外微扦插3 个月后的生长和生根情况Fig. 3 Growth and rooting performance of Santalum album clone No. 18 after micro-cutting for 3 months
3 讨 论
在预生根培养过程中,蔗糖的质量浓度显著影响檀香预生根瓶苗的苗高、叶片数、叶片长度和宽度及落叶率。其高度及叶片数随质量浓度的升高而增大并逐渐稳定,而叶片长度和宽度及落叶率随质量浓度的升高而减小并趋于稳定。蔗糖质量浓度为25 g·L-1时,苗高均值最大(3.47 cm),各项观测指标值与质量浓度30 ~45 g·L-1处理差异不显著;当质量浓度达到40 g·L-1时,落叶率最低(0.67%)。本研究与徐盼盼等[16]对金钻蔓绿绒Philodendron‘Con-go’的研究结果有相似之处,亦不尽相同:相同之处在于瓶苗高生长随蔗糖质量浓度的变化趋势及苗高最大值的出现时的蔗糖质量浓度(25 g·L-1),其不同之处在于金钻蔓绿绒的叶长随蔗糖质量浓度(0 ~30 g·L-1)的升高而增大并趋于稳定,而叶宽无明显变化规律[16]。严华兵等[15]对山薯Dioscorea fordii组培的研究表明,瓶苗高生长随蔗糖质量浓度的增加(10 ~80 g·L-1)呈先升后降的变化趋势,苗高最大值出现在蔗糖质量浓度30 g·L-1处理。Gürel 等[13]对杏Amygdalus communis的研究发现,在20 ~60 g·L-1蔗糖质量浓度试验范围内,50 ~60 g·L-1蔗糖质量浓度处理下组培瓶苗生长速率最高。而对于椰子Cocos nucifera组培苗而言,在20 ~80 g·L-1蔗糖质量浓度范围内,糖的质量浓度对苗高生长几乎无影响[14]。由此可见,组培瓶苗高生长对蔗糖的敏感度因植物种类而异。从培育健壮预生根瓶苗的角度考虑,本研究中25 ~45 g·L-1蔗糖质量浓度处理瓶苗高生长处于中等以上水平且落叶率低,宜用于预生根培养,以40 g·L-1的蔗糖质量浓度效果最佳。
本研究发现,NH4NO3及KNO3的质量浓度显著影响檀香预生根瓶苗的质量,其中NH4NO3对预生根瓶苗质量的影响更大。以330 ~660 mg·L-1NH4NO3质量浓度落叶率最低,基径最大。基径大有利于生根诱导。660 mg·L-1NH4NO3处理的苗高、叶片数、叶片长、叶宽显著高于330 mg·L-1NH4NO3处理,与最大值的1 320 mg·L-1NH4NO3处理差异不显著。因此认为,660 mg·L-1NH4NO3质量浓度适宜应用于檀香预生根瓶苗培育,其效果在所有参试处理中最佳,该结果与杨娟等[17]对茶树的研究结果不一致,该研究的最佳NH4NO3质量浓度为1 240 mg·L-1,可能与植物种类及培养阶段不同有关。
KNO3的质量浓度对檀香预生根瓶苗生长的影响比NH4NO3小,落叶率及基径在380 ~1 520 mg·L-1KNO3质量浓度范围内基本稳定,当质量浓度达到3 040 mg·L-1时,落叶率显著升高,基径显著下降,1 520 mg·L-1KNO3处理的基径、苗高生长均最大。可见,1 520 mg·L-1KNO3处理的檀香预生根瓶苗生长旺盛,质量最好。本研究还发现,H4NO3和KNO3间存在显著的交互作用,极显著影响檀香基径及叶宽生长,显著影响叶片数的生长,以660 mg·L-1NH4NO3质量浓度与1 520 mg·L-1KNO3质量浓度组合,预生根瓶苗质量最好。综上分析,NH4NO3为檀香敏感氮源,是影响檀香预生根瓶苗质量的主要氮源。周新华等[18]发现多花黄精组培瓶苗的生长随NH4NO3及KNO3使用质量浓度的升高而先升后降,2 个氮源分别以2 475 mg·L-1及2 850 mg·L-1的使用质量浓度为最好,变化规律及适宜质量浓度均与本研究差异很大,可能为物种差异所致。总而言之,不同植物对NH4NO3及KNO3的感应不同,适用的质量浓度差异亦大,可能与植物在长期进化过程中形成的不同氮素吸收偏好[28]或氮素吸收偏好随环境条件变化而改变有关[29],从而形成植物对NH4+及N敏感性及忍耐性差异[28]。
基质配比及瓶苗高度显著影响瓶外微扦插的生根率。基质是瓶外微扦插的基础环境,瓶苗高度为苗木质量指标,二者外因、内因共同作用,决定微扦插的成败。本研究发现,过高或过低的蛭石含量均不利于檀香预生根瓶苗的微扦插生根,当蛭石∶泥炭土∶黄心土为7∶1∶2 或6∶1∶3 时,微扦插生根成活率最高(64.38%~68.08%),是檀香瓶苗微扦插的最佳基质。当蛭石比例为60%~70%时有利于檀香微扦插生根,与蛭石的特性有关,蛭石具有质量轻、持水性好、透气性高、密度均匀、阳离子交换能力强、利于根聚体形成等优点[30]。以该配比为微扦插基质,将苗高2.0 ~5.5 cm 的瓶苗分成6 个等级,开展微扦插试验,发现高3.6 cm及以上茎芽有利于微扦插生根,扦插生根率显著提高,高4.6 ~5.0 cm 茎芽的扦插生根效果最佳。
根据以上研究结果,采用40 g·L-1蔗糖、660 mg·L-1NH4NO3与1 520 mg·L-1KNO3进行预生根培养6 个无性系发现,1、18、21、22 号等4 个无性系瓶苗生长旺盛,12 和19 号无性系分别有约5%和13%的落叶率,但仍能进行预生根瓶苗的生产。以苗高3.6 cm 以上的瓶苗,在蛭石∶泥炭土∶黄心土为7∶1∶2(V/V)的基质上进行微扦插试验发现,檀香无性系间生根能力差异显著,19 号无性系生根成活率最低,仅为29.9%。18 号无性系生根率最高,达87.12%。由此可见,本研究获得的檀香组培瓶苗微扦插技术是可行的,具有较为广泛的实用性。目前已生产6 个优良无性系6 000株以上苗木,营造檀香无性系试验示范林6.67 hm2以上。
本研究仅应用1 个无性系开展预生根培养试验,筛选出适宜的培养基并选用6 个无性系加以验证,尽管其瓶外微扦插的生根效果较好,尤其是18 号无性系的生根率超过85%,满足规模生产之需要,然而其他无性系的生根率未达80%,19号无性系甚至在30%以下。未来将重点针对生根率低及难生根的无性系,从预生根培养基的生根促进剂类型及质量浓度、大量元素配比以及瓶外微扦插前的炼苗等方面开展试验研究,以提高其生根率,实现规模化生产。
4 结 论
1)糖和氮的质量浓度显著影响檀香预生根瓶苗的生长和落叶;当培养基的蔗糖质量浓度在25 g·L-1以上时,能为瓶苗提供充足的碳源和能量,保证瓶苗正常生长;660 mg·L-1NH4NO3与1 520 mg·L-1KNO3组合对于檀香预生根瓶苗的培养效果最佳。
2)基质和瓶苗高度显著影响檀香微扦插生根率;采用蛭石∶泥炭土∶黄心土(6∶1∶3,V/V)混合基质,瓶苗高度在3.6 cm 以上,微扦插效果最好,其生根率接近70%。
3)檀香6 个优良无性系间微扦插生根率差异显著,变化范围为19 号无性系的29.9%至18 号无性系的87.12%。
4)本研究建立了檀香组培苗瓶外微扦插技术,技术成果具有普遍实用性。18 号、21 号和1 号无性系生根较容易,具备大规模产苗能力,可以推广应用。
