油菜花期西方蜜蜂采蜜过程细菌变化研究
2022-07-20赵文正周丹银汪正威
王 淼,赵文正,周丹银,黄 剑,汪正威
(1.云南农业大学食品科学技术学院,云南 昆明 650201;2.云南农业大学动物科学技术学院,云南 昆明 650201;3.中国科学院西双版纳热带植物园热带森林生态重点实验室化学生态研究组,云南 昆明650000)
油菜是罗平县传统特色优势作物,常年播种面积在5.3万hm2,是全国油菜重点生产县之一[1]。罗平县是我国重要的蜜蜂春季繁蜂基地,全国每年有20多个地区600多户饲养户到罗平繁蜂,饲养西方蜜蜂3.2万群、东方蜜蜂1.96万群[2]。
在油菜花盛花期通过对蜂群的调整,空巢脾的加入,蜜蜂采集花蜜的条件相对稳定。在细菌不断被带进或带出蜜囊的过程中,花蜜进入蜜囊,形成一个暂时有氧的环境,花蜜混合物被归巢蜂吐回蜂巢后,由于细菌耗氧的作用,使蜜囊又处于一个暂时缺氧的状态。蜜囊中的部分细菌在有氧和无氧的环境中不断适应,从而定殖下来,并形成这一时期蜜囊中的细菌菌系。这一过程中,花蜜中的细菌,通过蜜蜂采集花蜜后进入蜜囊,如果细菌附着不稳定,将被蜜蜂吐回蜂巢混入蜂蜜中,形成0 d蜂蜜中的细菌菌系。蜂蜜是高糖度溶液,对细菌将进行耐高渗透压筛选,数量多、耐受性强的细菌,容易存活并被分离培养出来,而数量少耐受性弱的细菌,不易存活,最终也难被分离培养出来。
本试验通过传统分离培养技术获得细菌菌株,筛除相同培养特征的菌株并计数。基于16S rDNA基因序列,对油菜花蜜、西方蜜蜂蜜囊以及第0 d蜂蜜中的细菌进行分离,对典型差别的菌株进行鉴定,并与已发布在NCBI的相似菌株序列构建系统发育树,分析其多样性差异和来源,揭示其系统发育地位,为进一步开发和利用这些菌种资源提供基础数据,在实际生产中,为蜂群饲养管理过程细菌的控制和应用提供理论依据。
1 材料与方法
1.1 材料
云南罗平西方蜜蜂蜂场3个采集点LP-1、LP-2、LP-3,各采集3组样本。油菜花花蜜(NLP):为田间采集;西方蜜蜂蜜囊:出勤蜂(AMHSOL)和归巢蜂(AMHSBL)的蜜囊各30只,0d蜂蜜(AMHLP):加入空脾后第1天的贮蜜3mL/每群。培养基:TSB;牛肉膏蛋白胨琼脂培养基;MRS[3,4];试剂盒:细菌基因组DNA提取试剂盒:(离心柱型,TIANGE BIOTECH)。细菌16S rDNA基因序列测序PCR引物(上海生工):27F:5′-AGAGTTTGATCCTGGCTC-3′;1387R:5′-GGGCGGTGTGTACAAGGC-3′;扩增片段大小1400 bp左右。
1.2 方法
常规平板纯培养、平均值计数,利用SPSS21.0统计平均数及标准差、作图。
双向测序(上海生工生物科技有限公司),正、反向序列经过人工拼接、校正、修剪后生成一致序列。利用Bioedit软件的Clustal-W算法进行Alignment计算,计算后的结果利用Dnasp5进行单倍型多样度计算,挑选出相同菌株,同时通过与MEGA5.0软件的Neighbour-Joining法(邻接法)构建系统发育树。
2 结果与分析
2.1 花蜜、蜜囊、0 d蜂蜜优势菌数量
可培养细菌的研究,除了菌种的鉴定外,同时对可培养细菌尤其是优势菌群的数量进行统计,分析细菌在花蜜、蜜囊及0d蜂蜜中的变化规律。Bacillus amyloliquefaciens为解淀粉芽孢菌;Other为其它细菌。
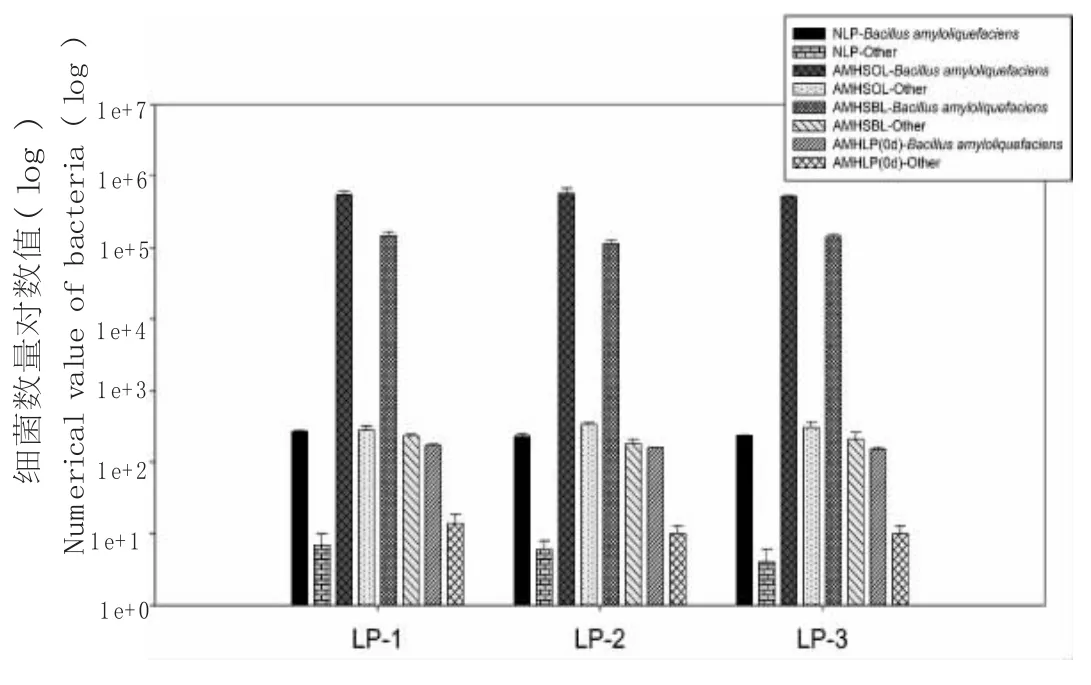
图1 花蜜、蜜囊和0d蜂蜜细菌数量Fig.1 Bacterial isolates num ber log(CFU/g)in nectar,honey stom ach and 0d honey.
对花蜜、出勤蜂、归巢蜂和0 d蜂蜜样品中解淀粉芽孢菌和其它细菌数量作图,纵坐标为细菌数量对数(如图1所示)。花蜜解淀粉芽孢菌数量为(230±18)~(268±8)CFU/g,其它细菌数量为(4±2)~(7±3)CFU/g;出勤蜂蜜囊解淀粉芽孢菌数量为(5.2×105±1.5×104)~(5.7×105±1.0×105)CFU/g;其它细菌数量为(280±40)~(333±23)CFU/g;归巢蜂蜜囊解淀粉芽孢菌数量为1.1×105±1.3×104 CFU/g~1.5×105±2.2×104 CFU/g;其它细菌数量为(180±30)~(230±17)CFU/g;0 d未成熟蜂蜜解淀粉芽孢菌数量为(153±10)~(170±9)CFU/g,其它细菌数量为(10±3)~(14±5)CFU/g;3个采样点细菌数量变化基本一致,各样品占优势的细菌为解淀粉芽孢菌,其它细菌种类与数量较少。尤其花蜜和0 d未成熟蜂蜜中细菌的数量和种类极少。
2.2 花蜜、蜜囊和0 d蜂蜜细菌相似菌株信息
试验所分离鉴定的菌株在GenBank比对后,其相似度不低于99%,相似菌株、登录号、相似区间、相似序列长度见表1。
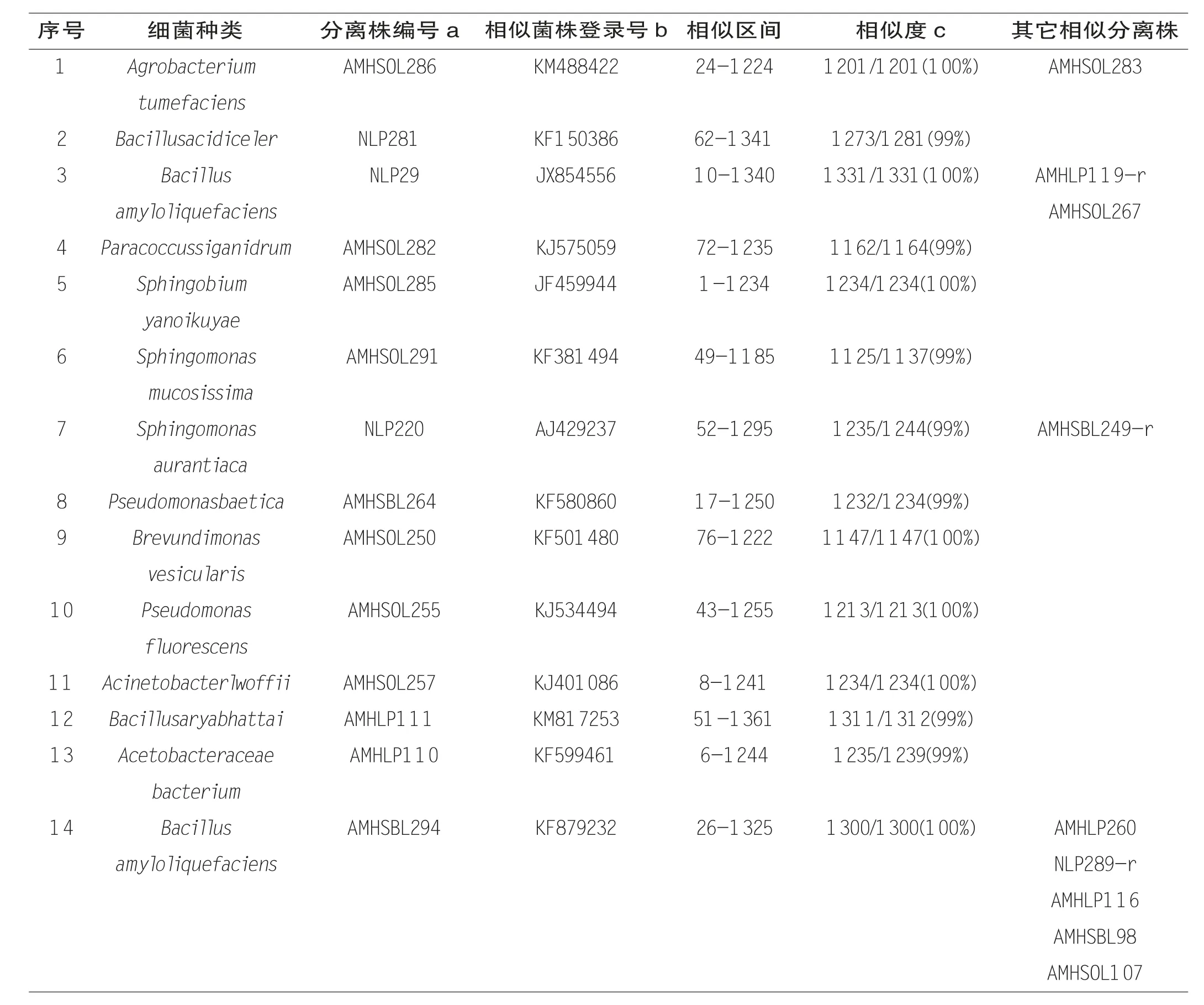
表1 花蜜、蜜囊和0 d蜂蜜细菌类型及相似菌株Table 1 Most closely related type strain from the nectar,honey stom ach and 0d honey
所采集西方蜜蜂样品中,B.amyloliquefaciens在出勤蜂、归巢蜂蜜囊、花蜜和0 d未成熟蜜中都存在;Sphingomonas aurantiaca在西方蜜蜂归巢蜂和花蜜中存在;出勤蜂蜜囊细菌有:Brevundimonas vesicularis、Pseudomonas fluorescens、Acinetobacter lwoffii、Paracoccus siganidrum、Sphingobium yanoikuyae、Agrobacterium tumefaciens和Sphingomonas mucosissima;花蜜中存在Bacillus acidiceler;0d未成熟蜜中有Acetobacteraceae bacterium和Bacillus aryabhattai;归巢蜂蜜囊有Pseudomonas baetica。
2.3 花蜜、蜜囊和0 d蜂蜜细菌系统发育树
基于16S rDNA部分基因序列长度为1013 bp,与Genbank选择14株相似细菌的序列,另选1株外群细菌序列,共计38条。树枝的拓扑结构基于bootstrap值1 000构建,如图2分支点所示,9个簇都有不低于73的自举值,刻度标尺表示20%的进化差异。如图2所示,9个簇包括:
α-变形菌纲的Ⅰ红螺菌目、Ⅱ柄杆菌目、Ⅲ根瘤菌目、Ⅳ红细菌目、Ⅴ鞘脂单胞菌目;γ-变形菌纲有Ⅵ不动杆菌属、Ⅶ莫拉菌科,Ⅷ假单胞菌目;Ⅸ芽孢杆菌属的4个种或亚种。

图2 花蜜、蜜囊和0 d蜂蜜细菌系统发育树
3 结论与讨论
本试验筛选出西方蜜蜂蜜囊细菌、花蜜和0 d蜂蜜细菌菌株23株,解淀粉芽孢菌数量变规律:出勤蜂蜜囊>归巢蜂蜜囊>花蜜>蜂蜜;所采集的西方蜜蜂样品中解淀粉芽孢杆菌在所有样本中都存在。作为好氧、产芽孢的解淀粉芽孢杆菌存在于环境中[5],能够产生淀粉酶、脂肪酶和蛋白酶,降解许多化学成分如油脂、蛋白质和淀粉[6],是功能性食品或药物的添加剂,可作为饲料添加剂刺激蜜蜂的免疫应答[7,8],能表现出很强的抗菌活性[9],其产生的抗菌化合物环状脂肽和伊枯草菌素是一种较好的生物防治制剂[10],能抑制Paenibacillus larvae,在饲养管理方面可进行新型饲料添加剂的开发利用,增强对蜂病的防御能力[11-12]。
前人研究了覆盆子花期西方蜜蜂蜜囊细菌结果分属乳酸杆菌属和双歧杆菌属。本试验是在油菜花期进行,未分离到这两个属的细菌,表明细菌种类与地理差异、不同蜜源植物类型、蜜蜂种类和生命阶段等因素相关[13]。归巢蜂蜜囊的Sphingomonas sp.与花蜜中的菌一致表明西方蜜蜂采集大蜜源的生物学特性。Sphingomonas sp.和Brevundimonas sp.能降低许多残留于环境中的油污、农药等化合物,其存在表明环境有污染物[14-15],这是在长期的转地饲养过程中,受到运输过程污染,从而形成独特的土著细菌。
