泥蚶致病性哈维氏弧菌的分离与鉴定
2022-07-20滕爽爽张炯明张利兵谢尚庶王瑶华肖国强杨千元
滕爽爽,张炯明,张利兵,谢尚庶,王瑶华,肖国强,4,杨千元,4,方 军
(1.浙江省海洋水产养殖研究所,浙江省近岸水域生物资源开发与保护重点实验室,温州市海洋生物遗传育种重点实验室,浙江 温州 325005; 2.乐清市农业农村局,浙江 温州 325699; 3.瑞安市农业农村局,浙江 温州 325200; 4.上海海洋大学 水产与生命学院,上海 316022)
弧菌是海洋环境中常见的细菌种群之一,广泛分布于河口、海湾、近岸海域的海水和海洋动物体内[1-4]。弧菌属种类繁多,主要致病弧菌有哈维氏弧菌(Vibrioharveyi)、鳗弧菌(V.anguillarum)、溶藻弧菌(V.alginolyticus)、霍乱弧菌(V.cholerae)、副溶血弧菌(V.parahaemolyticus)等[5]。哈维氏弧菌是海水养殖业重要的条件致病菌[6-7],已有研究表明,哈维氏弧菌可感染褐牙鲆(Paralichthysolivaceus)[8-9]、尖吻鲈(Latescalcarifer)[10]、刺尾鱼(Acanthurussohal)[11]、红鳍东方鲀(Takifugurubripes)[12-13]、斑节对虾(Penaeusmonodon)[14-15]、凡纳滨对虾(Litopenaeusvannamei)[16]和文蛤(Meretrixmeretrix)[17]等重要水产养殖动物,并致其死亡,给水产养殖业带来严重的经济损失。
泥蚶(Tegillarcagranosa)属瓣鳃纲、列齿目、蚶科、泥蚶属,是我国沿海滩涂的主要养殖贝类之一,也是沿海居民青睐的生食双壳贝类之一。随着泥蚶养殖规模的不断扩大,在每年温度上升的4—5月和繁殖后的7—8月间,易发生泥蚶细菌性疾病,严重影响了泥蚶养殖效益和泥蚶养殖业。研究发现,夏季泥蚶体内的优势菌群主要是弧菌属细菌和气单胞菌属细菌[18];对浙江省11市泥蚶副溶血弧菌污染情况检测发现,50%为阳性[19]。尚未见有关哈维氏弧菌感染泥蚶的报道,仅见泥蚶血红蛋白(Tg-HbⅡ)酶解多肽对哈维氏弧菌具有明显的抗菌活性的研究[20]。2014年8月,浙江滩涂养殖泥蚶暴发大规模死亡,其主要特征为闭壳肌无力,软体部颜色发白,体液呈淡红色或无色,黏液增多。笔者自濒死的泥蚶中分离得到1株优势菌,从该菌株的形态、生理生化特征、分子生物学分类方面进行研究,以期为泥蚶病害研究提供生物学资料,为泥蚶弧菌病的防治提供科学依据。
1 材料与方法
1.1 试验材料
从养殖群体中随机选取500个外形规则、闭壳肌闭合有力的2龄泥蚶[壳长(30.51±1.56) mm],试验开始前一周,于水温(29±1) ℃、盐度21±1、pH 8.10±0.05的砂滤海水中净化暂养,每日更换海水,早晚各投喂硅藻1次。
1.2 病原菌分离
2014年8月浙江滩涂暴发泥蚶大规模死亡。无菌条件下,取濒死泥蚶[2龄,壳长(28.67±1.97) mm,总质量(9.08±1.61) g]的肝胰腺,用无菌的生理盐水冲洗3次以上,置于1.5 mL无菌离心管中,加入适量的无菌生理盐水,用眼科剪捣碎,吸取组织液,稀释后涂布于硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(HB4310,青岛高科园海博生物技术有限公司),28 ℃培养24 h后挑取优势单菌落,划线接种在2216E固体培养基(HB0132,青岛高科园海博生物技术有限公司)上,获得1株优势菌,命名为J14,将该菌株移入2216E液体培养基,28 ℃摇床培养12 h,在菌液中加入灭菌甘油至终体积分数为25%,于-80 ℃冰箱中冻存备用。
1.3 人工感染试验
将菌株J14划线于2216E固体培养基上,28 ℃培养24 h后挑取单菌落接种于装有2216E液体培养基的试管中,28 ℃摇床培养12 h,再将其接种于3 L的2216E液体培养基中扩大培养。菌液密度以血细胞计数法测定[21],每瓶取3~5次,每次重复计数3次,取平均值。以测定的3 L瓶中的菌液J14作为母液,分别以不同的体积添加到试验组,以制备不同密度的菌株J14感染组。
采用浸泡感染的方法,设置菌株J14感染试验组的密度为2.5×106、5.0×106、7.5×106、10.0×106、12.5×106、15.0×106个/mL,对照组为不添加菌液的砂滤海水,每组设3个平行,每个平行40个泥蚶,试验容器为43 cm×28 cm×25 cm的30 L白色塑料水箱。感染期间海水温度保持28 ℃,持续充气,日换水1次,换水后添加菌液,早晚各投喂硅藻1次。感染5 d,每日记录泥蚶死亡数,利用SPSS 19.0 的概率单位法分析菌液密度与泥蚶死亡率之间关系,计算菌株J14感染泥蚶的96 h半致死密度。
感染试验中,取濒死泥蚶的肝胰腺,无菌生理盐水冲洗数次,匀浆后取100 μL涂布于硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基,分离纯化优势菌并命名为J19。菌株J19同样在3 L的2216E液体培养基中扩大培养,以血细胞计数法[21]测定菌液密度,以10.0×106个/mL再次进行人工浸泡感染试验,记录泥蚶的死亡率。
采用SPSS 19.0独立样本t检验,比较泥蚶在J14和J19菌液浸泡感染下的死亡率差异,以P<0.05为差异显著。
1.4 菌株形态及生化特征分析
将菌株J14和J19划线接种至2216E和硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂平板,28 ℃培养24 h,观察菌落的形态,并进行革兰氏染色。再将2菌株接种至2216E液体培养基培养,采用微量生化反应管(杭州滨和微生物试剂有限公司)进行生理生化试验。
1.5 16S rRNA基因序列测定和毒力基因分析
将菌株J14和J19接种于2216E液体培养基,28 ℃培养24 h,离心收集菌体,灭菌生理盐水洗涤2次后,采用细菌基因组DNA快速提取试剂盒(DN11,北京艾德莱生物科技有限公司)提取菌株的基因组DNA作为模板,以细菌16S rRNA基因,14个毒力基因进行PCR扩增,引物信息见表1。
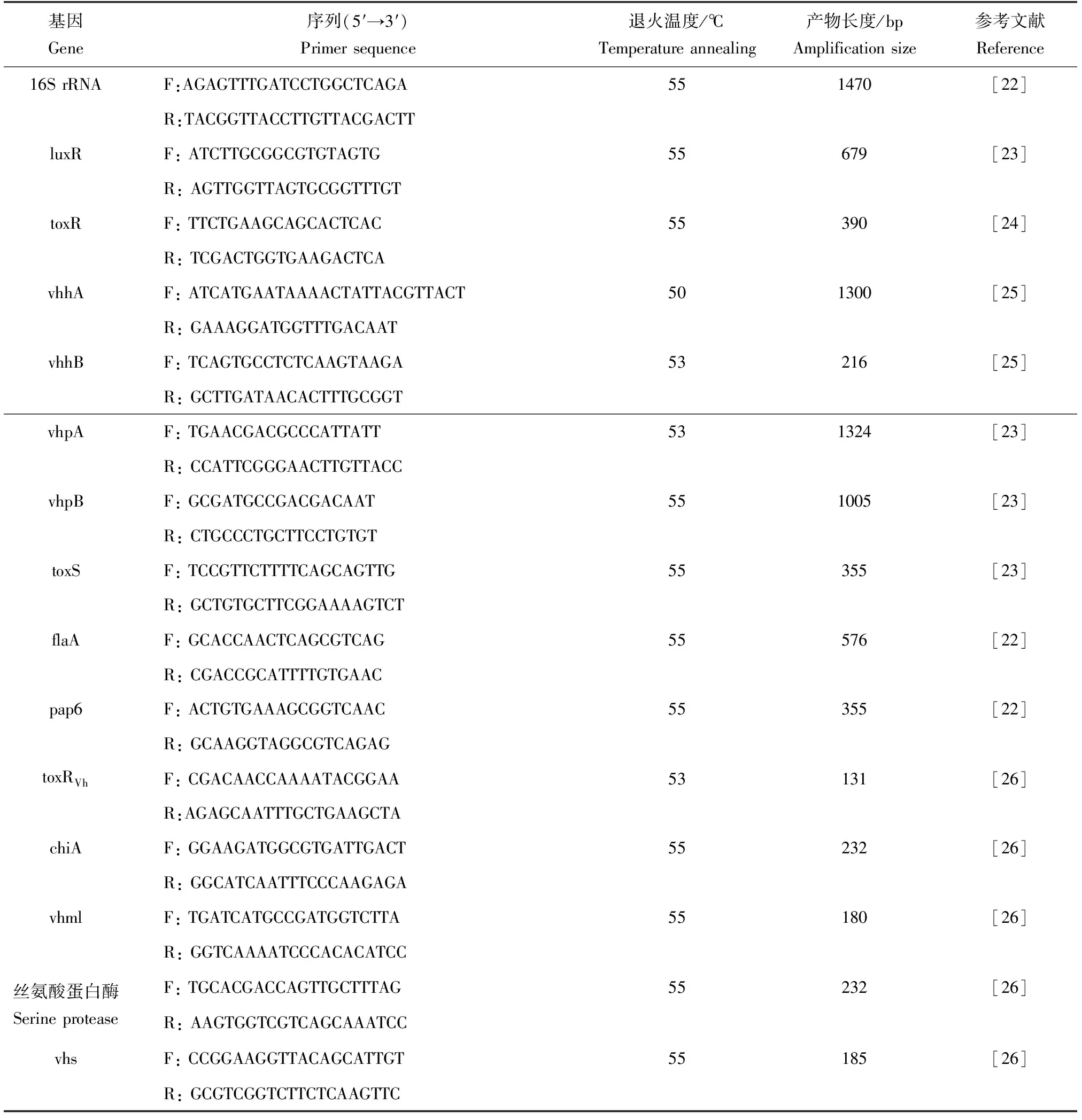
表1 16S rRNA基因和14个毒力基因的引物信息
16S rRNA基因PCR产物送上海祥音生物科技有限公司双向测序,所得序列在美国国家生物技术信息中心进行BLAST比对分析,并从GenBank中下载同属标准菌株的16S rRNA基因序列,选取大肠杆菌(Escherichiacoli)DQ360844.1为外群。序列输入MEGA-X软件对齐序列后,采用邻接法,重复1000次计算自展值,以Kimura 2-parameter模型构建系统发育树。毒力基因PCR扩增产物以1%琼脂糖凝胶电泳,对照产物预期片段长度,读取结果。
1.6 药敏试验
采用纸片扩散法对病原菌进行药物敏感性测试。分别挑取2216E平板上培养的菌株J14和J19于无菌生理盐水,调节菌悬液密度为0.5麦氏浊度[D(625 nm)=0.08~0.13]。取100 μL菌悬液均匀涂布于水解酪蛋白琼脂培养基(HB6232,青岛高科技工业园海博生物技术有限公司)上,10 min后将不同抗生素药敏纸片(杭州微生物试剂有限公司)贴于培养基表面,每种抗生素贴2片药敏试纸片,每个平板贴2片,并置于30 ℃培养箱培养18 h,游标卡尺测量抑菌圈直径。试验结果判读参考文献[27-28]。
2 结 果
2.1 人工感染试验结果
人工感染结果显示,菌株J14对泥蚶具有较强的致病性,可引起泥蚶死亡,其发病症状为闭壳肌无力,体液发白,肉质颜色发白,发臭,贝壳边缘有烟灰色黏液流出(图1),与自然发病泥蚶症状一致。根据泥蚶死亡结果,计算得到菌株J14感染泥蚶的96 h半致死密度为7.74×106个/mL(表2)。将菌株J14和J19以10.0×106个/mL密度感染泥蚶,5日累积死亡率均逾90%,菌株J14引起的死亡率略低于菌株J19(表3),经SPSS 19.0独立样本t检验分析,二者之间差异不显著(P>0.05)。
2.2 菌株形态及生理生化特征
28 ℃培养24 h条件下,菌株J14和J19形态相同:在2216E培养基上为直径(0.89±0.30) mm、圆形、黏稠、边缘整齐、表面光滑略凸起的白色不透明菌落;在硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基上为直径(1.15±0.35) mm、圆形、边缘整齐的黄色不发光菌落;革兰氏染色后观察为革兰氏阴性短杆菌。生化特征鉴定结果表明,2个菌株在鸟氨酸脱羧酶和西蒙氏枸橼酸盐利用与哈维氏弧菌标准株有差异(表4),参考文献[29-30],确定2株菌属于弧菌属。
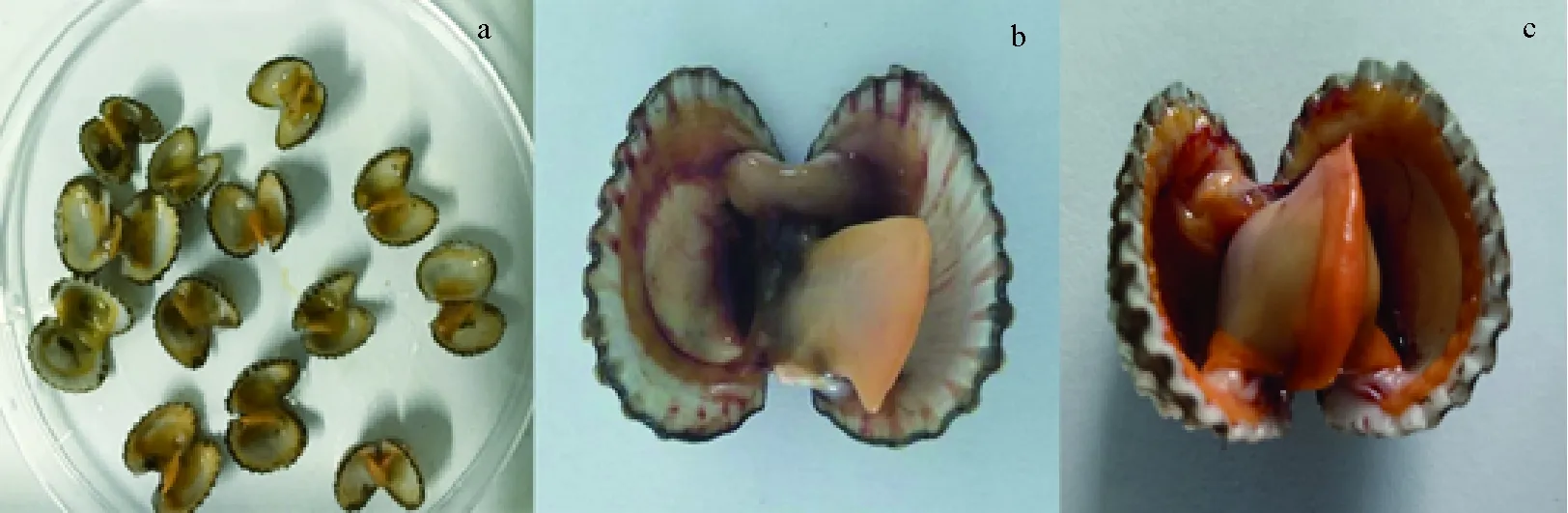
图1 健康泥蚶和患病泥蚶Fig.1 The healthy and the sick ark shell T. granosaa.自然发病泥蚶; b.人工感染发病泥蚶; c.健康泥蚶.a.naturally infected ark shell; b.artificially infected ark shell; c.healthy ark shell.

表2 菌液J14浸泡泥蚶的感染结果

表3 泥蚶感染菌株J14和J19后的死亡率比较

表4 菌株J14和J19的生理生化特征
2.3 16S rRNA基因序列分析
为进一步确定菌株J14和J19的分类地位,将菌株J14和J19的16S rRNA基因序列在美国国家生物技术信息中心中进行BLAST比对,结果发现,前100个比对结果相似性均在99%以上,其中哈维氏弧菌约占75%,其余为坎贝氏弧菌(V.campbellii)、轮虫弧菌(V.rotiferianus)和未定种细菌。由构建的系统发育树(图2)可见,菌株J14和J19均与哈维氏弧菌聚类,结合形态学、生理生化试验结果,确定菌株J14和J19均为哈维氏弧菌。结合人工感染试验可以确定,菌株J14为本试验中泥蚶大规模性死亡的病原菌。

图2 基于16S rRNA基因序列构建的弧菌系统发育树Fig.2 Phylogentic tree of Vibrio based on 16S rRNA gene sequences标尺0.01表示核苷酸替换数.Bar 0.01 indicates the number of nucleotide substitutions.
2.4 毒力基因检测结果
哈维氏弧菌J14和J19携带毒力基因情况见表5。哈维氏弧菌J14和J19中均能扩增出7个毒力基因(luxR、toxR、vhhA、vhhB、toxS、chiA、丝氨酸蛋白酶基因)的目的条带;毒力基因flaA的扩增结果有差异,哈维氏弧菌J14不含有flaA基因,而哈维氏弧菌J19携带flaA基因;哈维氏弧菌J14和J19中均未扩增出其余6个毒力基因(vhpA、vhpB、pap6、toxRVh、vhml、vhs)的目的片段。
2.5 药敏试验结果
哈维氏弧菌J14和J19对32种抗菌药物敏感性试验的结果显示:2个菌株对青霉素、氨苄西林、阿莫西林、杆菌肽不敏感;对多黏菌素B中度敏感;对红霉素的敏感性存在差异,即哈维氏弧菌J14对红霉素中度敏感,哈维氏弧菌J19对红霉素敏感;对其他26种药物敏感(表6)。

表5 哈维氏弧菌J14和J19毒力基因的扩增结果

表6 哈维氏弧菌J14和J19的耐药性分析
3 讨 论
3.1 菌株J14的分离与鉴定
哈维氏弧菌为条件致病菌,有毒株可引起养殖贝类发病、死亡。如感染哈维氏弧菌的文蛤,在发病高峰期病状特征明显,解剖患病文蛤发现,其外套膜萎缩,闭壳肌松弛、开合无力、两壳呈张开状态,软体部消瘦,部分发病文蛤的鳃黏液明显增多[17]。本试验中,菌株J14是从夏季规模性死亡的泥蚶中分离得到的,表明菌株J14可在高温环境下生长。由人工感染试验结果可知,感染后的泥蚶出现明显的病症:外套膜萎缩,闭壳肌松弛,开合无力,软体部消瘦,有些发烂发白,肝胰腺颜色淡红,体液淡红至无色,部分患病泥蚶鳃黏液明显增多,黏液呈烟灰色。感染后死亡率高达90%。人工感染发病泥蚶的症状与自然发病的泥蚶症状表现一致,说明菌株J14具备重复感染的能力。泥蚶贝壳坚硬,如受到外界刺激,则双壳紧闭,较难通过注射方法将菌液注射到泥蚶软体部,因此本试验中采用不同密度的J14菌液浸泡感染泥蚶,分析得到菌株J14感染泥蚶的96 h半致死密度为7.74×106个/mL,表明菌株J14具有较强致病性。
对菌株J14和J19进行形态、常规生理生化鉴定,结果显示,2个菌株均为革兰氏阴性细菌,硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基平板上呈黄色,生理生化鉴定结果与哈维氏弧菌特征极为相近。与标准菌株比较,部分鉴定项存在差异[31],推测2个菌株可能为哈维氏弧菌。对菌株J14和J19进行16S rRNA基因分子生物学鉴定,构建的系统发育树显示,2株菌与哈维氏弧菌聚为一支。综合生理生化与分子生物学鉴定结果,确定这2个菌株均为哈维氏弧菌。
3.2 哈维氏弧菌J14的毒力基因
已有研究表明,弧菌属不同种间存在相同的毒力基因,相同的种内存在不同的毒力基因,毒力基因或相关毒力因子的转移是导致某些无毒株变为有毒株以及出现弧菌新病原的重要原因[32]。本试验中,共检测了14种毒力基因的携带情况,结果显示,哈维氏弧菌J14和J19均携带有群体效应调控基因luxR,毒力调控基因toxR,溶血素基因vhhA、vhhB,毒力相关基因toxS,几丁质酶基因chiA,丝氨酸蛋白酶基因。Xu等[33]对46株不同哈维氏弧菌的17种毒力基因进行PCR分析,发现所有的致病菌均含有luxR、toxRVh、vhh、chiA、丝氨酸蛋白酶基因这5种毒力基因,表明哈维氏弧菌毒力是由多基因共同作用的结果。据Nakamura等[34]报道,毒力基因在适应不同环境和不同宿主方面具有优势,拥有很强的转移能力。另外,哈维氏弧菌致病菌株较非致病菌株可能拥有更强的接收通过基因水平转移而来的外源基因的能力[35]。本试验中的鞭毛结构基因flaA在2个菌株中存在差异,J14不含有flaA基因,而J19含有flaA基因,由此推测,毒力基因水平转移可能是2株菌携带毒力基因差异的原因。
3.3 哈维氏弧菌J14的药敏性
药物的敏感试验结果表明,2个菌株对青霉素、氨苄西林、阿莫西林和杆菌肽不敏感。文蛤源哈维氏弧菌对氨苄西林和阿莫西林不敏感[17];珍珠龙胆石斑鱼(Epinepheluslanceolatus♂×E.fuscoguttatus♀)源哈维氏弧菌X12XC30对呋喃唑酮、阿莫西林和红霉素耐药,X13SZ03对四环素、呋喃唑酮、利福平、复方新诺明和头孢克肟等耐药[36]。有研究显示,不同年份、不同来源、不同养殖环境分离得到的哈维氏弧菌对抗生素的耐药存在差异,环境、宿主影响细菌的耐药性,同时抗生素的过度使用导致细菌产生更广的耐药性[37-40]。本试验中的2株哈维氏弧菌对26种药物敏感,其中氯霉素、呋喃唑酮、头孢哌酮、头孢曲松、头孢噻吩、头孢拉啶、诺氟沙星、氧氟沙星属于水生食品动物禁用药[41],因此在泥蚶弧菌病的防治过程中应合理合规用药,通过改善泥蚶养殖环境水质和底质,以达到生态防治的目的。
4 结 论
从浙江滩涂发病泥蚶中分离得到优势菌株J14,经生理生化试验和16S rRNA基因序列分析,确定为哈维氏弧菌,该菌株具有较强的致病性,携带7种毒力基因,对庆大霉素、卡那霉素、复方新诺明等26种常用抗生素药物敏感。
