我国土壤受试植物筛选与毒性预测
2022-07-19罗晶晶张加文刘征涛王晓南
罗晶晶,吴 凡,张加文,刘征涛,张 聪,王晓南*
我国土壤受试植物筛选与毒性预测
罗晶晶1,吴 凡1,张加文1,刘征涛1,张 聪2,王晓南1*
(1.中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012;2.海油环境科技(北京)有限公司,北京 100027)
生态毒性数据缺乏是我国土壤基准与生态风险评估研究中一直存在的问题,开展本土受试植物的筛选可提供更多的生态毒理试验选材,从而获得不同物种的生态毒性数据.鉴于植物对土壤污染物的敏感性,从被子植物中依据分布范围、代表性和易于获得性等原则,对我国潜在的受试植物进行筛选,结果发现,13科53种被子植物分布广泛且易于获取,可作为本土受试植物;结合生态毒性数据的搜集与分析,其中12种受试植物的生态毒性数据相对丰富,并对部分典型污染物表现高敏感.此外在受试植物生态毒性预测模型研究方面,对12种受试植物两两进行建模预测,共得到132个物种种间关系估算模型(Interspecies Correlation Estimation,ICE),其中88个为显著性模型(检验<0.05);此处,回归分析了已构建ICE模型的评价参数,得出预测效果较好的ICE模型应满足交叉验证成功率³80.00%、MSE£0.62、2³0.76和分类学距离£4的标准.最终筛选出25个符合上述标准的ICE模型,涉及禾本科-禾本科、十字花科-十字花科的相互预测,其中当燕麦、芜青、普通小麦、玉蜀黍和黑麦草等作为替代物种时,预测物种的实际生态毒性值与预测值较为接近.受试植物的筛选与生态毒性预测模型的建立有助于生态毒性数据的产生,并为土壤污染管理和生态风险评估提供科学依据.
土壤生态基准;受试生物筛选;被子植物;物种敏感度分析;ICE模型预测
土壤污染问题的发生通常会推动土壤污染管控的进程,1934年美国黑色风暴事件、1979年荷兰莱克尔克土壤污染事件,都促使这两国较早开展了土壤污染相关研究及政策制定.在土壤生态安全方面,目前各国基本建立了相应的土壤基准值确定方法,如美国的生态筛选值(Ecological Soil Screening Levels, ECO-SSLS)、加拿大的土壤质量指导值(Soil Quality Guideline,SQG)、英国的土壤筛选值(Soil Screening Values,SSVS)、澳大利亚的生态调查值(Ecological Investigation Levels,EIL)、新西兰的生态安全环境指导值(Environmental Guideline Values, EGV)[1],我国于20世纪80年代后陆续开展土壤背景值和土壤环境容量的调查工作[2].目前我国土壤污染问题涉及地区较多、类型复杂、污染物种类广泛[3],总体情况不容乐观,这不仅提高了我国土壤生态风险评估的难度,也致使我国土壤环境基准研究发展相对缓慢.
因此有必要开展我国土壤生态风险评估和环境基准中关键技术的探索,生态毒性数据便是其中基础且重要的一环,但现有的生态毒性数据相对缺乏,并存在污染物涵盖不足、涉及生物物种相对单一、终点指标及试验方法不统一等问题.在生态毒理试验中,普通小麦[4-5]、大麦[6-7]、黄瓜[5]、西红柿[8]、萝卜[9-10]、高粱、玉蜀黍等是现阶段常用的受试植物,其主要是禾本科、十字花科等的农作物,而我国植物物种资源丰富,以上农作物的使用相对片面、代表性不全.使用基础信息与来源较为全面的受试生物有助于获得更为精确的毒性数据[11].国内外最早在水质基准受试生物筛选上进行了大量研究[12-13],目前土壤环境基准研究方面,基于具体污染场地的情况来筛选相应受试植物,如许霞等[14]筛选出蚕豆作为废弃农药厂的敏感植物,金鑫[15]筛选了化工污染场地的受试植物.受试植物的筛选也会考虑到物种代表性及分布范围,本文以高等植物中被子植物的筛选开展研究,为生态毒理试验提供可参考的备选试验材料,并进一步得到更多相关植物物种的生态毒性数据.
此外,土壤生态毒性数据预测模型也能进一步扩充生态毒性数据.美国环保署(USEPA)构建的物种种间关系估算模型(Interspecies Correlation Estimation,ICE),在水生态毒性数据预测中得到了广泛应用,可以预测250多个水生生物种的生态毒性[16],如鱼类和水生无脊椎动物、藻类和野生动物[17-18],且ICE模型得到的预测毒性值与实测值之间表现出较高的一致性[19].在土壤生态毒性研究方面,USEPA研究人员近年开始了土壤生物的ICE模型构建,主要是土壤无脊椎动物毒性数据的预测,得出模型在目分类水平上表现出高的预测精度(例如,蚯蚓-蚯蚓),但在两个跨类群物种(节肢动物-环节动物)中预测精度较低[20].目前尚未建立植物相关模型.
本研究创新点一是提供可行的受试植物筛选方法,并得到土壤生态毒理试验的受试植物名单;二是探索了生态毒性数据预测模型的建立,为植物物种创建物种种间关系估算模型,并提出评价模型预测效果的相关标准.这有助于土壤生态风险评估与环境基准中生态毒性数据缺乏及现存问题的解决.
1 材料与方法
1.1 土壤受试植物的筛选
依据《中国生物物种名录第一卷植物》(上中下册)[21]对我国植物物种多样性的记录,统计高等植物(苔藓、蕨类、被子、裸子植物)的省份分布,鉴于我国气候类型复杂、植物种类丰富,整理分布在20个省份及以上的植物物种,认为其具有可靠的本土植物代表性.高等植物中,苔藓植物与蕨类植物依靠孢子繁殖,对周围生长环境变化表现出高敏感,现有毒性数据少且购买渠道不便,故未推荐作为受试植物;裸子植物均为多年生木本植物,与周围环境因素关系复杂,不宜在短期内观察生长情况,故未推荐作为受试植物.因此,本研究在梳理各高等植物分布及物种量的基础上,选择被子植物作为主要的受试植物选择库.

图1 高等植物在不同分类学水平的数目
数据来自《生物物种名录第一卷植物》[21]
我国被子植物物种资源丰富,《中国生物物种名录第一卷植物》(上中下册)[21]记录在册的被子植物共有263科总计30379种,占高等植物总物种数的85%(图1),其中菊科、禾本科、豆科、兰科、毛茛科、唇形科、莎草科、荨麻科等均含有较多物种数.从中选择在我国20个省份及以上有分布的被子植物,进一步搜集其购买及野外采集信息,将易获得且分布广泛的被子植物作为受试植物.受试植物应具备一定的可操作性,便于获得且易于培养[1],可在实验室环境下提供良好的毒性数据.
1.2 受试植物的生态毒性数据检索
搜集受试植物名单中各物种的生态毒性数据,考察其对污染物的敏感性情况.在ECOTOX数据库(https://cfpub.epa.gov/ecotox/index.cfm)以及公开发表的文献中,检索并记录受试植物现有的生态毒性数据,毒性终点选择EC50、IC50、LC50三类指标.获得毒性数据后按照以下条件进行筛选:①有明确的毒性终点记录;②单位统一,符合土壤生态毒理试验的真实情况.因研究人员采用不同的试验方法,如水培或者土培养,导致毒性数据浓度值单位不一致,本研究以mg/kg作为统一筛选单位;③对于同一污染物,如有较多毒性值,优先采用来源相同的可靠数据,计算几何平均值作为种平均毒性值[22].记录毒性数据相对丰富(即含有三种及三种以上污染物毒性数据)的受试植物,并将各受试植物的污染物毒性值均按从小到大的顺序排列,获得对相应受试植物毒性最大(毒性值最小)的污染物种类.
1.3 敏感性受试植物与高毒性污染物分析
汇总对各受试植物毒性最大的污染物种类,记录重叠次数,排除重叠次数为1的污染物,其余污染物以CAS号、中英文名称等从ECOTOX数据库及公开发表的文献中检索毒性数据,保留被子植物物种的毒性数据.毒性数据筛选原则同1.2,计算各被子植物物种对同一污染物的累积概率,以种平均毒性值的对数为横坐标,以对应的累积概率为纵坐标,绘制物种敏感度分布曲线.毒性数据相对丰富的受试植物若累积概率排在前列,则为敏感性受试植物,该污染物为高毒性污染物.所用软件为Excel 2019及Origin 9.1.
1.4 物种种间关系估算模型构建
物种种间关系估算ICE模型,即将毒性数据相对丰富的受试植物,其一作替代物种,另一作预测物种,两组数据进行回归分析,判断两组数据间是否有较强相关性,在强相关性下得出回归方程,根据检验,得到显著性模型(<0.05),计算模型的均方差误MSE、拟合优度R;并将预测物种的预测值与实测值进行验证,得到交叉验证成功率;同属物种分类学距离为1,同科物种分类学距离为2,以此外推得到分类学距离.衡量以上四个评价指标,得出本研究ICE模型的评价标准及最终的ICE模型.所用软件为Excel 2019、SigmaPlot 12.0及Matlab 8.1.0.604.
ICE模型采用的线性回归方程如下:

式中:为预测物种的毒性数据值;为替代物种的毒性数据值.
我国土壤受试植物筛选和毒性预测ICE模型构建的技术路线见图2.
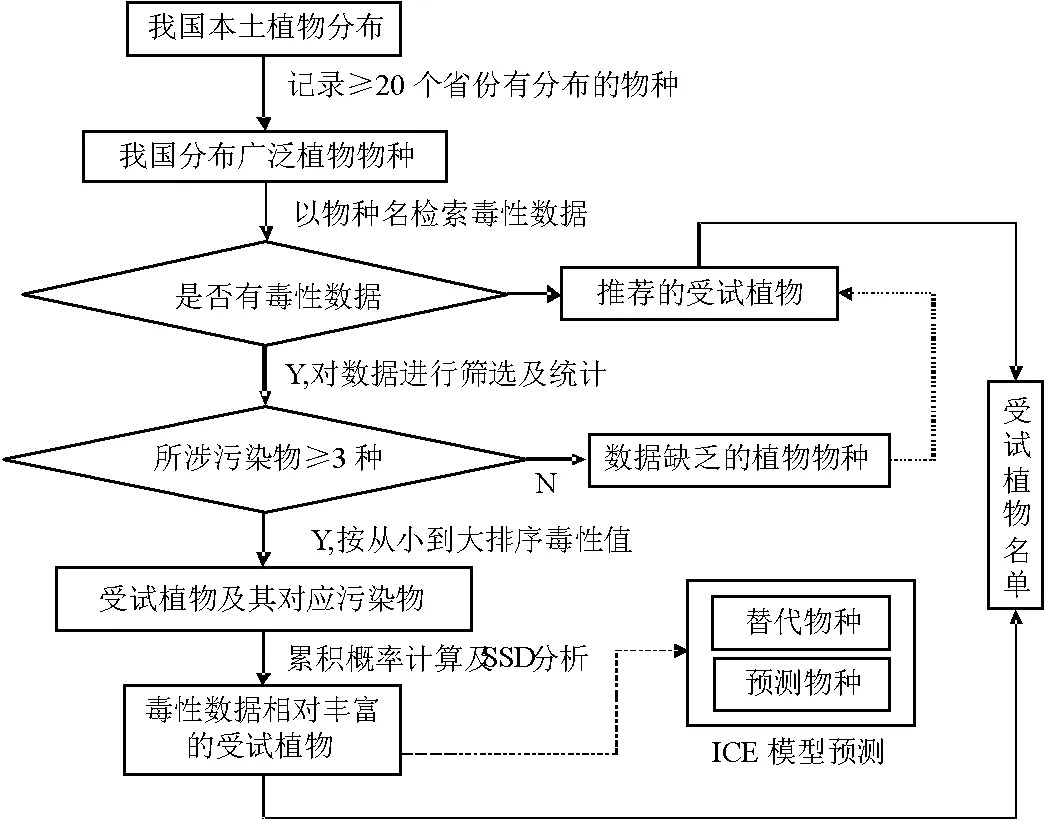
图2 受试植物的筛选和毒性预测ICE模型构建
2 结果与分析
2.1 我国土壤受试植物筛选结果
在高等植物中,分布在我国20个省份及以上的裸子植物主要有杉科的杉木、水杉;柏科的柏木、圆柏;松科的雪松、马尾松,共6种(图3).分布广泛的苔藓植物主要来自青藓科,如青藓属、燕尾藓属、美喙藓属、同蒴藓属、鼠尾藓属、长喙藓属等,此外细鳞苔科也提供了较多的物种数.分布广泛的蕨类植物涉及24科,如铁角蕨科.尽管苔藓植物在我国大部分省份可见踪迹,但部分苔藓植物对污染物过于敏感[23],受到毒害作用可能来自于空气中污染物,影响了其在土壤生态毒性研究中的应用.分布广泛的被子植物共有78种,其中53种易于购买,且部分物种可在野外进行采集,种子获取渠道较为多样,符合受试植物种子易得易栽培的条件;此外,这53种植物分布在我国多数省份,横跨多个气候带,在我国拥有较长的发展史,与人类生活息息相关,故认为其具有本土代表性,可作为我国土壤受试植物(表1).禾本科与十字花科依然占据了较多物种数,多数主要用于农作,唇形科的物种常见用途是药用,其他科物种则功能不一.

图3 高等植物广泛分布物种数(种分类水平)

表1 受试植物名单
注:以上物种均属于被子植物,并可在网购平台购买;“野外”指是否可在野外进行采集, -表示不易在野外采集.
在受试植物名单中,作为常见的药用植物,和尚菜、牛蒡[24]、蒲公英、香薷、活血丹[25]、益母草[26]、一串红[27]、马齿苋[28]等的基因组都已得到部分研究,遗传背景相对清晰,有利于生态毒理试验的开展.作为常见牧草,柳枝稷[29]近年被发现可作为生物燃料,格兰马草因具有较高的遗传多样性[30],在开发优良高产牧草研究中显现出较好应用前景,野牛草、草木樨[31]等同样在其他领域被发现可加以利用.作为常见的经济作物,如普通小麦、燕麦、玉蜀黍等,其本身在人类生活中就扮演着重要角色,一旦受到污染,不仅引发粮食安全、生态污染问题,也会影响到人体健康.筛选得到的受试植物,每个物种基本都具有两种以上的功能,如草木樨既是常见牧草也是中草药之一,马齿苋既是中草药也是牧草、蔬菜[28],多样化的功能使得其与人类生产活动互相影响,因其在人类生活中的重要角色,及现有生物技术手段对其遗传背景的研究,将其应用在生态毒理试验中可行性较高,对于土壤生态风险评估及环境基准的研究也具有实际的生态意义.
其中,燕麦、普通小麦和芜青被国际标准化组织(ISO)优先推荐为受试植物,玉蜀黍与豆科植物在必要条件下也可使用[32-33];欧洲油菜、芜青、黄瓜、绿豆、大麦、黑麦草、高粱、普通小麦、玉蜀黍、稻被经济合作与发展组织(OECD)推荐为土壤生态毒理试验的受试植物[34];黄瓜、燕麦、黑麦草、玉蜀黍、芜青、欧洲油菜被USEPA推荐作为植物早期幼苗生长试验的受试植物[35-36].此外,OECD与USEPA也提出了非农作物的受试植物名单,并认为具有生态或经济价值的植物在特定条件下用作受试植物具有重大意义.
2.2 受试植物生态毒性数据筛查结果
对表1中53种受试植物进行土壤生态毒性数据的搜集,根据条件筛选后,共有12种受试植物具有相对丰富的毒性数据,即毒性数据涉及污染物³3个 (图4).筛选后的现有毒性数据涉及污染物最多的是燕麦,共37个污染物,其次是芜青,普通小麦与玉蜀黍涉及相同数目的污染物,涉及污染物最少的是大麦,仅有4个,12种受试植物平均涉及的污染物个数为12,多数受试植物涉及的污染物未达到平均个数.12种受试植物目前均在中国多个省份有分布[21],并有相关报道已应用于毒理试验并获得可靠的毒性数据,燕麦、芜青、普通小麦、玉蜀黍是各国际组织普遍推荐的受试植物[32-36],在考虑毒性数据共享的情况下,其他物种在符合试验标准的环境下得到的毒性数据同样可录入相关数据库,并用于土壤基准值推导和生态风险评估等环节.
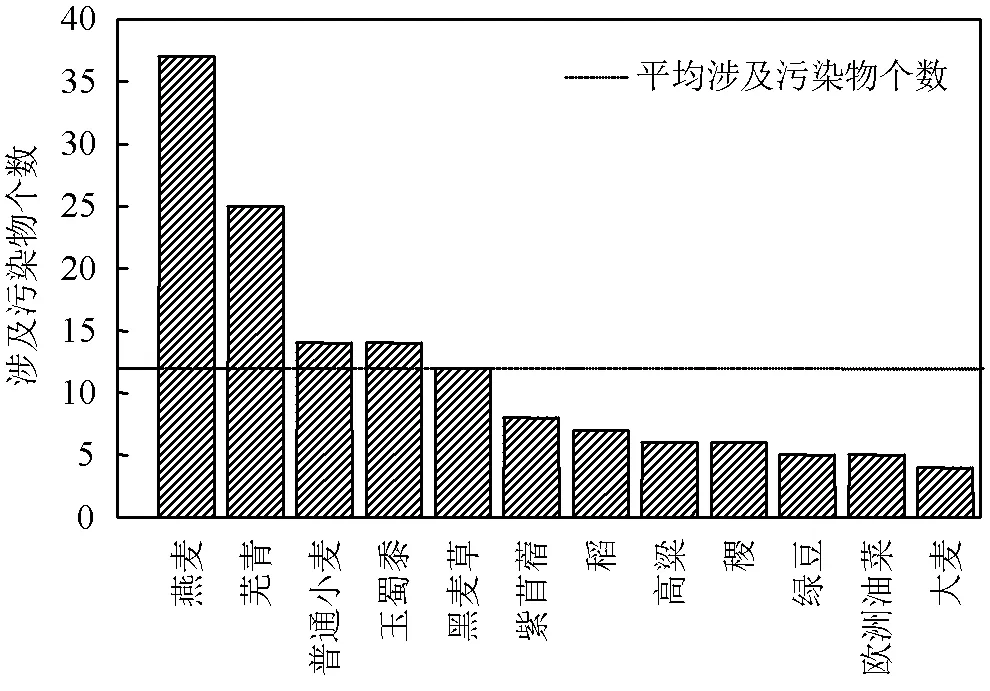
图4 12种受试植物毒性数据涉及的污染物数目
12种受试植物涉及污染物总数118个,对各物种毒性较大的污染物见表2,排除污染物重叠后,共有13个污染物对两种及两种以上受试植物表现出较高毒性.即阿特拉津(CAS:1912249)、西玛津(CAS: 122349)、氨磺乐灵(CAS:19044883)、氟乐灵(CAS: 1582098)、二丙烯草胺(CAS:93710)、唑嘧磺草胺(CAS:98967409)、2,6-二氯苄腈(CAS:1194656)、重铬酸钾(CAS:7778509)、五氯酚(CAS:87865)、硼酸(CAS:10043353)、硫酸铜(CAS:7758987)、2,4,6-三硝基甲苯(CAS:118967)、2,4-二硝基甲苯(CAS: 121142),以上污染物用在农业中主要起除草、杀虫、除菌等作用.此外,对稻毒性较大的5个污染物对其他受试植物未见明显毒害作用 (表2),可能是稻的特异性谷胱甘肽S-转移酶(GST)对常见除草剂类污染物有解毒作用造成的[37-38].
基于生态系统中物质循环的基本原则,土壤污染与地下水污染、饮用水污染等具有一定关联性[39].在以上13个污染物中,阿特拉津与西玛津是常见的三嗪类除草剂,三嗪类除草剂因发明较早效果显著得到了大面积应用,其中阿特拉津已被公认为地表水和地下水的主要污染物之一[40],在土壤中对豆科植物的毒性可在使用18周后仍被检测到[41].氟乐灵是一种广泛使用且在环境中持久存在的二硝基苯胺类除草剂,具有显著的生态毒性[42].二丙烯草胺被归类为土壤中的淋滤剂,其对地下水的污染潜力与甲草胺和异丙甲草胺相当[43].在土壤中,2,6-二氯苄腈本身不但抑制燕麦幼苗发芽,还会杀死或阻碍幼嫩植物的生长[44],其降解产物2,6-二氯苯甲酰胺(BAM),已在19%的丹麦地下水样本中检出[45].2, 4,6-三硝基甲苯,对植物根系的微观结构会造成损害并抑制光合作用,如造成紫苜蓿氧化酶系统紊乱[46],其在土壤中的代谢物质2,4-二硝基甲苯等可对人体及环境造成潜在的危害[47-48].此外,五氯酚对土壤微生物群具有高毒性[49],唑嘧磺草胺会抑制豆科作物的发芽并导致植物死亡[50].这13个污染物,使用年限较久,在土壤中具有一定的积累性,对土壤中植物、微生物等均有不同程度的毒害作用,它们及其降解产物会随着物质循环进入水体影响到水体安全,当人体直接或间接接触到时也会产生相应的健康问题,因此人们对其进行了较多的研究.
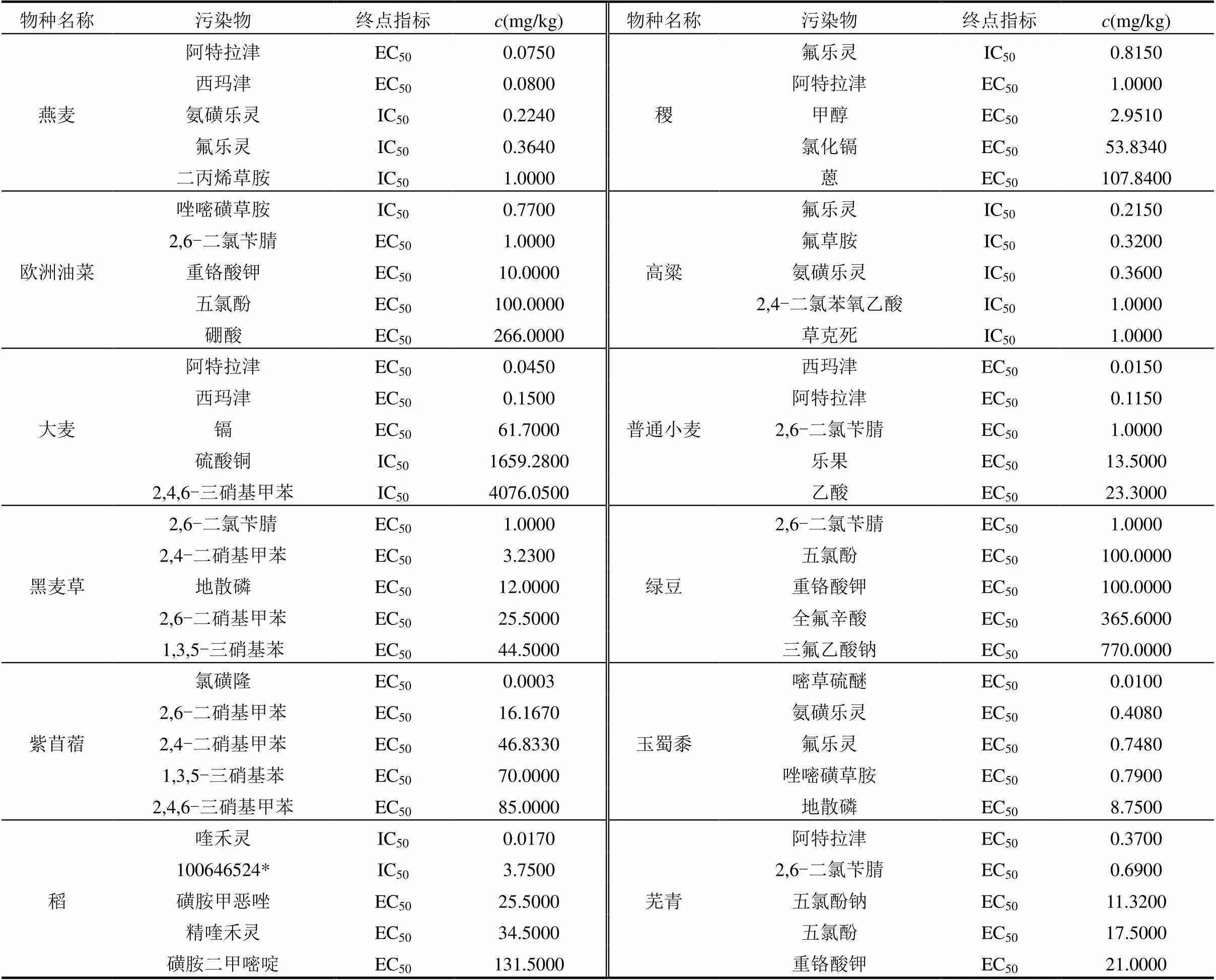
表2 12种受试植物的污染物毒性EC50和IC50值
注:*前数字表示化合物CAS号.
2.3 受试植物对高毒性污染物的敏感性
搜集这13个污染物的毒性数据,根据筛选条件得到了5种及5种以上被子植物对6个污染物的毒性数据(数据分析的基本数据点要求).采用log- logistic物种敏感度分布法[51–53],对2,4-二硝基甲苯、2,4,6-三硝基甲苯、阿特拉津、氟乐灵、硫酸铜和西玛津植物毒性效应进行敏感性分析(图5).结果发现黑麦草对2,4-二硝基甲苯、硫酸铜、2,4,6-三硝基甲苯较为敏感,紫苜蓿对2,4,6-三硝基甲苯较为敏感,大麦对阿特拉津较为敏感,高粱对氟乐灵较为敏感,普通小麦对西玛津表现敏感.
由图5可见,现有研究多集中在农作物上,其他生产生活功能的植物物种研究较少,植物物种代表性不足.此外,涵盖的污染物数据也不够全面,缺少近年新兴污染物的研究,考虑到化合物总体数量的庞大,我国的生态毒性数据尚需要更多补充.本土生态毒性数据多维度的不足,将不利于我国土壤生态风险的评估及环境基准的推导.
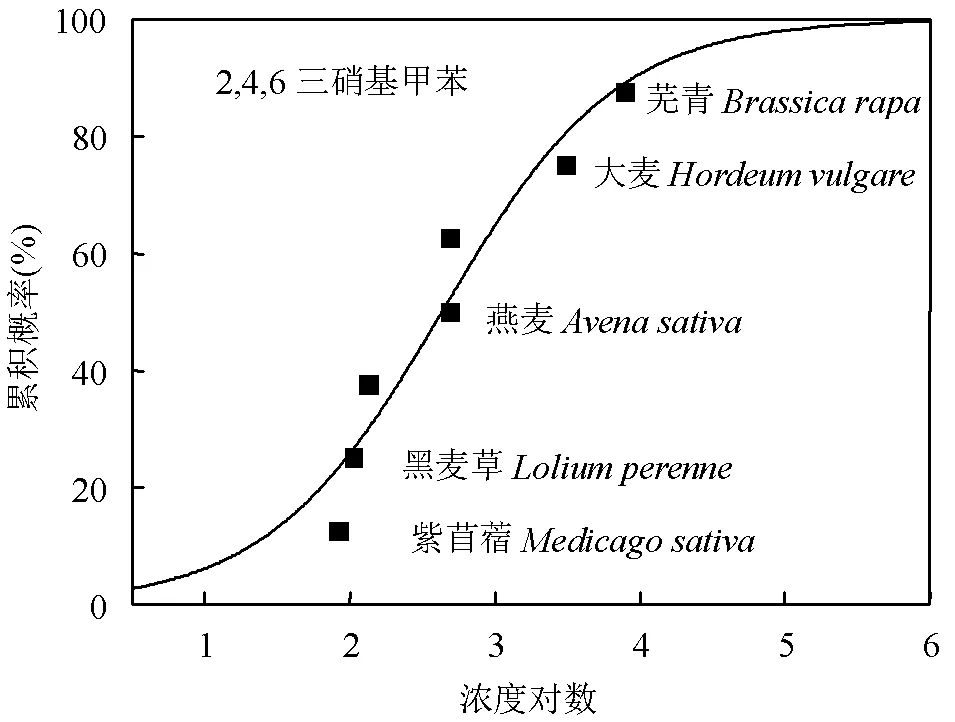
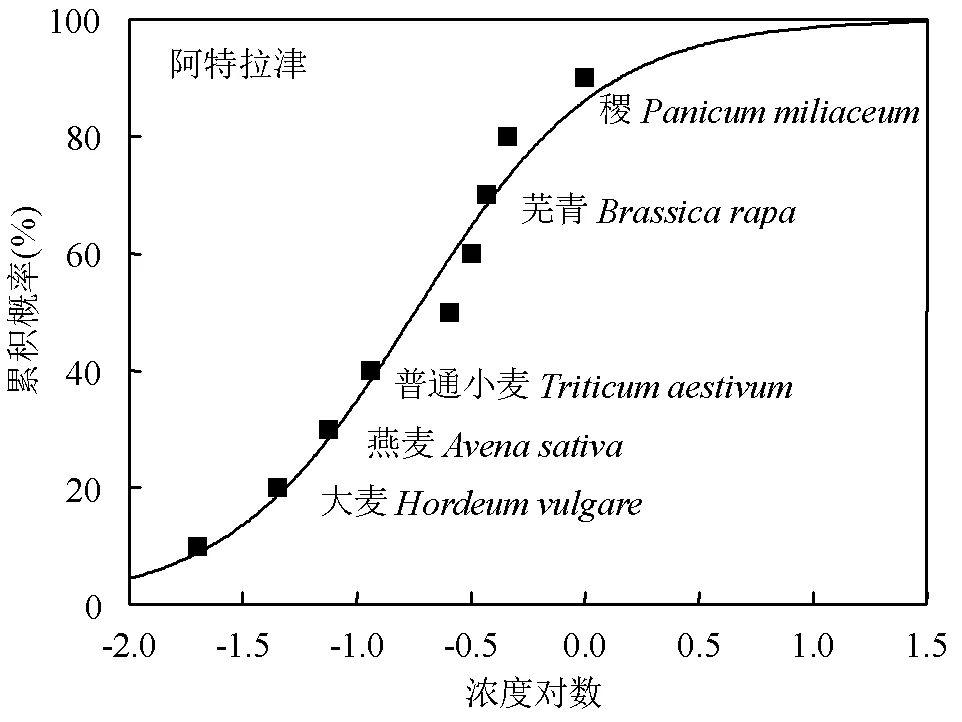
图5 受试植物对典型污染物的物种敏感度分布
Fig.5 Distribution of species sensitivity of test plants to typical pollutants
未标注物种来自于禾本科、豆科、十字花科、葫芦科、茄科、菊科、伞形科等
2.4 物种种间关系预测模型(ICE)
ICE模型最初被USEPA应用在水生生物毒性预测、水质基准和风险评估中,USEPA提出了水生生物ICE模型的筛选评价标准:交叉验证成功率³85%、MSE£0.22、2³0.6、分类学距离£4[54].Wang等[18]初步构建了我国水生生物的ICE模型,经过分析提出可依据交叉验证成功率³80%、MSE£0.54、2³0.78对模型进行筛选.
本研究对生态毒性数据相对丰富的12种受试植物两两进行ICE毒性预测,共得到132个ICE模型,任一模型均含有MSE、2参数.采用检验判断模型所得方程是否显著,当<0.05时认为该线性关系总体显著,共88个模型满足值要求(表3),其中黑麦草做替代物种时,对其余11种受试植物预测得到的方程均达到显著.采用留一交叉验证法(Leave-One-Out Cross Validation)来分析ICE模型的预测准确度,实际生态毒性数值与预测值相比较得到ICE模型关键参数-交叉验证成功率.对交叉验证成功率与MSE和2的相关性进行分析发现: MSE与交叉验证成功率有显著的负相关关系(相关系数=-0.7861),MSE与交叉验证成功率的线性方程:=1.1056-0.4897(2=0.61,<0.0001);2与交叉验证成功率有较弱的正相关关系(相关系数= 0.3676),2与交叉验证成功率的线性方程:= 0.3509+0.5930(2=0.13,=0.0004)(图6).为保证ICE模型的预测效果(交叉验证成功率³80.00%),由线性方程计算得MSE£0.62、2³0.76,此外,分类学距离£4有利于ICE模型预测效果更好[54].
满足以上四个评价标准的ICE模型共25个(表4),其中黑麦草作为替代物种时,有4个模型,分别是对燕麦、稻、普通小麦、玉蜀黍的预测;燕麦、普通小麦、玉蜀黍作为替代物种时,各自有4个模型满足评价标准,这三个物种的两两预测模型均表现较好,同时参与预测的毒性数据值(N)³12,而燕麦与芜青作为毒性数据值较为丰富的两个物种,尽管分类学距离上不占优势,但相互预测的MSE、2均满足评价标准,且交叉验证成功率在95%以上.因此,丰富的毒性数据有利于预测模型的精准化[20],燕麦、芜青、普通小麦、玉蜀黍、黑麦作为替代物种时,所得到ICE模型均预测效果较好.
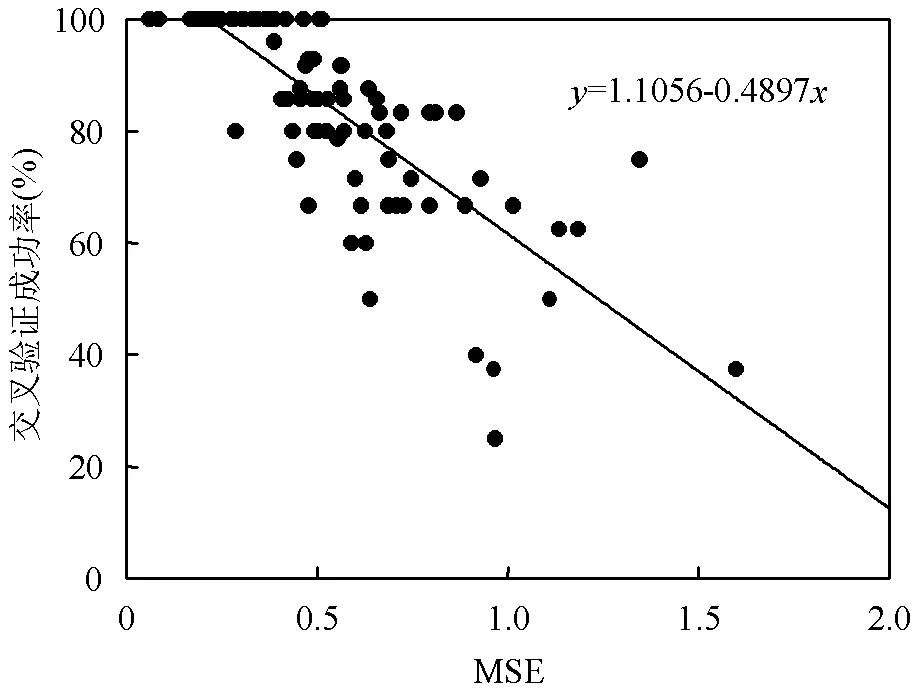

表3 受试植物及其显著性模型(F检验P<0.05)统计
欧洲油菜与芜青是同属的植物物种,相互预测时ICE模型均满足评价标准,尽管欧洲油菜仅有5个毒性数据值,但交叉验证成功率达到了100%;对于一些同科的替代-预测物种,其预测效果不一,这可能是由毒性数据少造成的,如紫苜蓿与绿豆是同科的物种,但受限于较少的毒性数据,其模型预测结果较差,绿豆作为替代物种时MSE>0.62,且交叉验证成功率仅有40%,紫苜蓿作为替代物种时,MSE> 0.62.此外,在88个显著性模型(检验<0.05)中,禾本科做替代物种的模型有42个,其中约六成模型满足本研究评价标准(表4).由此可见,现有的生态毒性数据多集中在禾本科植物,其他科植物数据缺乏,因此,系统开展其他受试植物的土壤生态毒性数据预测是有必要的.
跨类群进行预测时,禾本科作为替代物种对十字花科的预测效果较好,十字花科与豆科作替代物种时对禾本科的预测效果同样较好,这与它们的物种及毒性数据较多是密切相关的.分类学距离的增加会导致预测精度降低[20],因此在越近的分类学距离上模型更易于有较好的预测效果,而跨类群的模型预测效果则有较多不确定性[55-56].
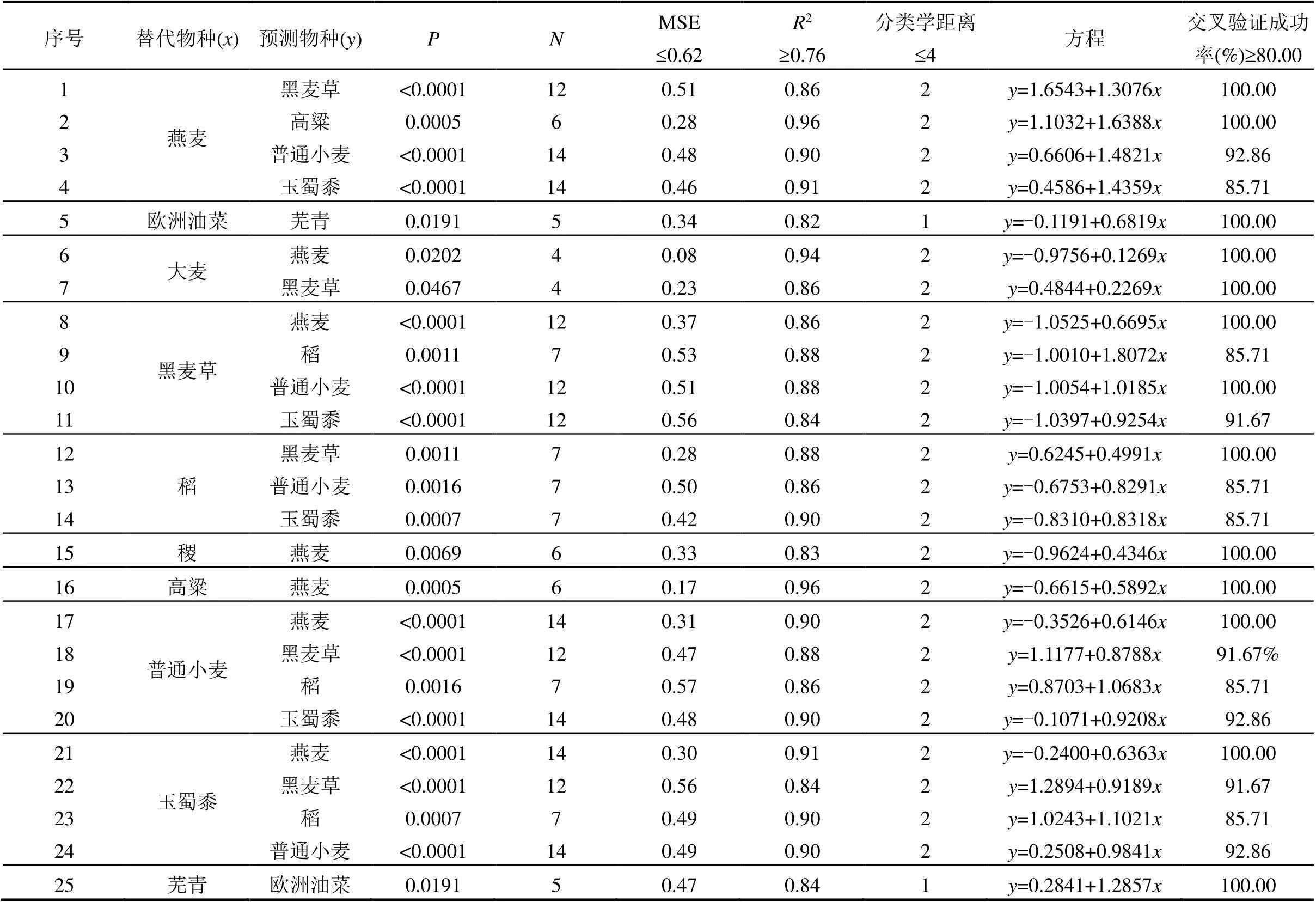
表4 满足评价标准的ICE模型
3 结论
3.1 筛选得到53种分布广泛且易于获取的被子植物物种可推荐为土壤基准和生态风险评估研究中的受试植物,分别来自菊科、禾本科、豆科、蔷薇科、毛茛科、唇形科、莎草科、荨麻科、茜草科、伞形科、十字花科、马齿苋科、葫芦科.
3.2 分析发现12种被子植物的毒性数据较为丰富,分别是禾本科的燕麦Avena sativa、大麦Hordeum vulgare、黑麦草Lolium perenne、稷Panicum miliaceum、高粱Sorghu bicolor、普通小麦Triticum aestivum、玉蜀黍Zea mays、稻Oryza sativa,十字花科的欧洲油菜Brassica napus、芜青Brassica rapa,豆科的紫苜蓿Medicago sativa、绿豆Vigna radiata.
3.3 共构建了88个显著性模型(检验<0.05),统计分析后得出模型评价标准为:交叉验证成功率³80.00%、MSE£0.62、2³0.76、分类学距离£4,符合上述标准的模型有25个,涉及禾本科-禾本科、十字花科-十字花科的相互预测,其中燕麦、芜青、普通小麦、玉蜀黍、黑麦草等做替代物种时预测效果较好,跨类群的模型预测有较多不确定性.
[1] 马 瑾,刘奇缘,陈海燕,等.世界主要发达国家土壤环境基准与标准理论方法研究[M]. 北京:科学出版社, 2021.
Ma J, Liu Q Y, Chen H Y, et al. Study on the theory and methods of soil environmental criteria and standard in major developed countries in the world [M]. Beijing:Science Press, 2021.
[2] 葛 峰,徐坷坷,刘爱萍,等.国外土壤环境基准研究进展及对中国的启示[J]. 土壤学报, 2021,58(2):331-343.
Ge F, Xu K K, Liu A P, et al. Progress of the research on soil environmental criteria in other countries and its enlightenment to China[J]. Acta Pedologica Sinica, 2021,58(2):331-343.
[3] Hu B F, Shao S, Ni H, et al. Assessment of potentially toxic element pollution in soils and related health risks in 271cities across China[J]. Environmental Pollution, 2020,270,116196.
[4] 宋玉芳,周启星,许华夏,等.重金属对土壤中小麦种子发芽与根伸长抑制的生态毒性[J]. 应用生态学报, 2002,13(4):459-462.
Song Y F, Zhou Q X, Xu H X, et al. Eco-toxicology of heavy metals on the inhibition of seed germination and root elongation of wheat in soils[J]. Chinese Journal of Applied Ecology, 2002,13(4):459-462.
[5] 鞠 鑫.锑对不同植物的毒理效应及其土壤生态基准研究[D]. 北京:华北电力大学, 2016.
Ju X. The toxicological effects of antimony on different plants and its soil ecological criteria [D].Beijing:North China Electric Power University, 2016.
[6] 朱广云,蒋 宝,李菊梅,等.土壤Mehlich-3可浸提态镍对大麦根伸长的毒性[J]. 中国环境科学, 2018,38(8):345-352.
Zhu G Y, Jiang B, Li J M, et al. Toxicity thresholds based on Mehlich-3extractable nickel to barley root elongation[J]. China Environmental Science, 2018,38(8):3143-3150.
[7] 付平南,贡晓飞,罗丽韵,等.不同价态铬和土壤理化性质对大麦根系毒性阈值的影响[J]. 环境科学, 2020,41(5):2398-2405.
Fu P N, Gong X F, Luo L Y, et al. Toxicity of chromium to root growth of barley as affected by chromium speciation and soil properties[J]. Environmental Science, 2020,41(5):2398-2405.
[8] 宋玉芳,周启星,许华夏,等.菲、芘、1,2,4-三氯苯对土壤高等植物根伸长抑制的生态毒性效应[J]. 生态学报, 2002,22(11):1945-1950.
Song Y F, Zhou Q X, Xu H X, et al. Eco-toxicological effects of phenanthrene, pyrene and 1,2,4-Trichlorobenzene in soils on the inhibition of root elongation of higher plants[J]. Acta Ecologica Sinica, 2002,22(11):1945-1950.
[9] 龚 平,周启星,宋玉芳,等.重金属对土壤中萝卜种子发芽与根伸长抑制的生态毒性[J]. 生态学杂志, 2001,20(3):4-8.
Gong P, Zhou Q X, Song Y F, et al. Eco-Toxicology of heavy metal on the inhibition of seed germination and root elongation of turnip in soil[J]. Chinese Journal of Ecology, 2001,20(3):4-8.
[10] 杨 倩,王 希,沈禹颖.异龄苜蓿土壤浸提液对3种植物种子萌发的影响[J]. 草地学报, 2009,17(6):784-788.
Yang Q, Wang X, Shen Y L. Effect of soil extract solution from different aged alfalfa standings on seed germination of three species[J]. Acta Agrestia Sinica, 2009,17(6):784-788.
[11] 刘 娜,金小伟,王业耀,等.生态毒理数据筛查与评价准则研究 [J]. 生态毒理学报, 2016,11(3):1-10.
Liu N, Jin X W, Wang Y Y, et al.Review of criteria for screening and evaluating ecotoxicity data [J]. Asian Journal of Ecotoxicology, 2016, 11(3):1-10.
[12] HJ831-2022 淡水生物水质基准推导技术指南[S].
HJ831-2022 Technical guideline for deriving water quality criteria for freshwater organisms [S].
[13] Office of science and technology. Guidelines for deriving numerical national water quality criteria for the protection of aquatic organisms MD their uses [M]. Washington DC: United States Environmental Protection Agency, 1985.
[14] 许 霞,薛银刚,刘 菲,等.废弃农药厂污染场地土壤浸出液的急性毒性和遗传毒性筛查[J]. 生态毒理学报, 2017,12(6):223-232.
Xu X, Xue Y G, Liu F, et al. Screening of acute toxicity and genetic toxicity of soil leachates from abandoned pesticide factory contaminated site[J]. Asian Journal of Ecotoxicology, 2017,12(6):223-232.
[15] 金 鑫.典型化工类污染场地的调查诊断与生物毒性试验的应用研究[D]. 南京:南京农业大学, 2008.
Jin X. Typical chemical industry contaminated sites Investigation and diagnosis and the application of biological toxicity test research [D]. Nanjing: Nanjing Agricultural University, 2008.
[16] Willming M M, Lilavois C R, Barron M G, et al. Acute toxicity prediction to threatened and endangeredspecies using interspecies correlation estimation (ICE) models [J]. Environmental Science and Technology, 2016,50(19):10700−10707.
[17] Fan J, Yan Z, Zheng X, et al. Development of interspecies correlation estimation (ICE) models to predict the reproduction toxicity of EDCs to aquatic species[J]. Chemosphere, 2019,224:833-839.
[18] Wang X N, Fan B, Fan M, et al. Development and use of interspecies correlation estimation models in China for potential application in water quality criteria [J]. Chemosphere, 2019,240:124848.
[19] Bejarano A C, Barron M G. Aqueous and tissue residue-based interspecies correlation estimation models provide conservative hazard estimates for aromatic compounds[J]. Environmental Toxicology and Chemistry, 2016,35(1):56-64.
[20] Barron M G, Lambert F N. Potential for interspecies toxicity estimation in soil invertebrates[J]. Toxics, 2021,9(10):265.
[21] 王利松,贾 渝,张宪春.中国生物物种名录第一卷植物[M]. 北京:科学出版社, 2018.
Wang L S, Jia Y, Zhang X C. Catalogue of life China, Volume 1, Plants [M]. Beijing:Science Press, 2018.
[22] 刘婷婷,郑 欣,闫振广,等.水生态基准大型水生植物受试生物筛选[J]. 农业环境科学学报, 2014,33(11):2204-2212.
Liu T T, Zheng X, Yan Z G, et al. Screening of native aquatic macrophytes for establishing aquatic life criteria[J]. Journal of Agro-Environment Science, 2014,33(11):2204-2212.
[23] Ray S, Bhattacharya S. Manual for bryophytes: Morphotaxonomy, diversity, spore germination, conservation[M]. Manual for Bryophytes, 2021.
[24] Nie L, Cui Y, Chen X, et al. Complete chloroplast genome sequence of the medicinal plant(Burdock)[J]. Genome, 2020,63(1):53-60.
[25] Li Q, Mo J. Complete chloroplast genome of clonal medicinal plant,, in China[J]. Mitochondrial DNA Part B-Resources, 2019,4(1):2019-2020.
[26] Sun J, Wang Y, Garran T A, et al. Heterogeneous genetic diversity estimation of a promising domestication medicinal motherwortbased on chloroplast genome resources[J]. Frontiers in Genetics, 2021,12:1806.
[27] Dong A X, Xin H B, Li Z J, et al. High-quality assembly of the reference genome for scarlet sage,, an economically important ornamental plant[J]. GigaScience, 2018,7(7):giy068.
[28] Liu X, Yang H, Zhao J, et al. The complete chloroplast genome sequence of the folk medicinal and vegetable plant purslane (L.)[J]. Journal of Horticultural Science and Biotechnology, 2018,93(4):356-365.
[29] Sena K L, Goff B, Davis D, et al. Switchgrass growth and forage quality trends provide insight for management[J]. Crops and Soils, 2019,52(2):44-51.
[30] Morales-Nieto C R, Lvarez-Holguín A, Villarreal-Guerrero F, et al. Phenotypic and genetic diversity of blue grama () populations from Northern Mexico[J]. Arid Land Research and Management, 2019,34(5):1-16.
[31] Akhzari D, Mahdavi S, Pessarakli M, et al. Effects of arbuscular mycorrhizal fungi on seedling growth and physiological traits ofL. grown under salinity stress conditions[J]. Communications in Soil Science and Plant Analysis, 2016,47(7):822-831.
[32] Soil quality -Determination of the effects of pollutants on soil flora.Part 1:Method for the measurement of inhibition of root growth ISO11269-1[M]. International Organization for Standardization,2012.
[33] Soil quality -Determination of the effects of pollutants on soil flora.Part 2:Effects of chemicals on the emergence and growth of higher plants ISO11269-2[M]. International Organization for Standardization,2012.
[34] Guideline for the testing of chemicals.Proposal for updating guideline 208 [M]. Organization for Economic Cooperation and Development,2006.
[35] Ecological effects test guidelines.OPPTS 850.4230. Early Seedling growth toxicity test [M]. Environmental Protection Agency,2012.
[36] Ecological Effects Test Guidelines.OPPTS 850.4100.Seedling Emergence and Seedling Growth[M]. Environmental Protection Agency,2012.
[37] Lee J J, Jo H J, Kong K H. A plant-specific tau class glutathione S-transferase fromhaving significant detoxification activity towards chloroacetanilide herbicides[J]. Bulletin-Korean Chemical Society, 2011,32(10):3756-3759.
[38] Hu T. A glutathione S-transferase confers herbicide tolerance in rice[J].Crop Breeding and Applied Biotechnology, 2014,14(2):76-81.
[39] Xue X, Hawkins T R, Ingwersen W W, et al. Demonstrating an approach for including pesticide use in life-cycle assessment: estimating human and ecosystem toxicity of pesticide use in midwest corn farming[J]. The International Journal of Life Cycle Assessment, 2015,20(8):1117-1126.
[40] Mesquini J, Sawaya A, López B, et al. Detoxification of atrazine by endophyticisolated from sugarcane and detection of nontoxic metabolite[J]. Bulletin of Environmental Contamination and Toxicology, 2015,95(6):803-809.
[41] Simarmata M, Harsono P, Hartal H. Sensitivity of legumes and soil microorganisms to residue of herbicide mixture of atrazine and mesotrione[J]. Asian J. Agri. and Biol., 2018,6(1):12-20.
[42] Coleman N V, Rich D J, Tang F, et al. Biodegradation and abiotic degradation of trifluralin: Acommonly used herbicide with a poorly understood environmental fate[J]. Environmental Science and Technology, 2020,54(17):10399-10410.
[43] Balinova A M. Acetochlor-A comparative study on parameters governing the potential for water pollution[J]. Journal of Environmental Science and Health Part B, 1997,32(5):645-658.
[44] Koopman H, Daams J. 2,6-Dichlorobenzonitrile: anew herbicide[J]. Nature, 1960,186(4718):89-90.
[45] Holtze M S, Sørensen J, Hansen H, et al. Transformation of the herbicide 2,6-Dichlorobenzonitrile to the persistent metabolite 2,6-Dichlorobenzamide (BAM) by soil bacteria known to harbour nitrile hydratase or nitrilase[J]. Biodegradation, 2006,17(6):503-510.
[46] Yang X, Zhang Y, Lai J, et al. Analysis of the biodegradation and phytotoxicity mechanism of TNT, RDX, HMX in alfalfa ()[J]. Chemosphere, 2021,281:130842.
[47] Neuwoehner J, Schofer A, Erlenkaemper B, et al. Toxicological characterization of 2,4,6-Trinitrotoluene, its transformation products, and two nitramine explosives[J]. Environmental Toxicology and Chemistry, 2010,26(6):1090-1099.
[48] Doherty S J, Messan K S, Busby R R, et al. Ecotoxicity of 2,4-Dinitrotoluene to cold tolerant plant species in a sub-arctic soil[J]. International Journal of Phytoremediation, 2019,21:958-968.
[49] Marti E, Sierra J, Caliz J, et al. Ecotoxicity of chlorophenolic compounds depending on soil characteristics[J]. Science of the Total Environment, 2011,409(14):2707-2716.
[50] Bondareva L, Fedorova N. Pesticides: Behavior in agricultural soil and plants[J]. Molecules, 2021,26(17):5370.
[51] Xiao P F, Lin X Y, Liu Y H, et al. Application of species sensitivity distribution in aquatic ecological risk assessment of chlopyrifos for paddy ecosystem[J]. Asian Journal of Ecotoxicology, 2017,12(3):398-407.
[52] Wei W, Liang D L, Chen S B. Plant species sensitivity distribution to the phytotoxicity of soil exogenous Zinc[J]. Chinese Journal of Ecology, 2012,31(3):538-543.
[53] Wang X, Yan Z, Liu Z, et al. Comparison of species sensitivity distributions for species from China and the USA[J]. Environmental Science and Pollution Research, 2014,21(1):168-176.
[54] Raimondo S, Mineau P, Barron M G. Estimation of chemical toxicity to wildlife species using interspecies correlation models[J]. Environmental Science and Technology, 2007,41(16):5888-5894.
[55] Connors K A, Beasley A, Barron M G, et al. Creation of a curated aquatic toxicology database: Enviro Tox[J]. Environmental Toxicology and Chemistry, 2019,38(5):1062-1072.
[56] Gestel C A M VAN, Borgman E, Verweij R A, et al. The influence of soil properties on the toxicity of molybdenum to three species of soil invertebrates[J]. Ecotoxicology and Environmental Safety,2011,74(1):1-9.
Screening of soil test plants and developing of their toxicity prediction models in China.
LUO Jing-jing1, WU Fan1, ZHANG Jia-wen1, LIU Zheng-tao1, ZHANG Cong2, WANG Xiao-nan1*
(1.State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China;2.Offshore Environmental Technology & Services Limited, Beijing 100027, China)., 2022,42(7):3295~3305
The lack of ecotoxicity data has always been a problem in the research of soil criteria and ecological risk assessment in China. The screening of native test plants can provide more ecotoxicity test materials, so as to obtain the ecotoxicity data of different species. In view of the sensitivity of plants to soil pollutants, potential test plants in China were screened from angiosperms according to the principles of distribution range, representativeness and accessibility. The results showed that 53 species of angiosperms in 13 families were widely distributed and easy to obtain, and could be used as native test plants. The result showed that ecotoxicity data of 12 plant species were relatively abundant. Therefore, the ecotoxicity prediction models were developed in this study. A total of 132 Interspecies Correlation Estimation (ICE) models were obtained for the 12 plant species, of which 88 were significant models (-test<0.05). Moreover, the selection and evaluation principle of the constructed ICE models were analyzed, and it was concluded that the ICE models with better prediction effects should meet the principle of cross-validation success rate³80.00%, MSE£0.62,2³0.76 and taxonomic distance£4. Finally, 25ICE models were screened meeting the above principle, involving the mutual prediction of Gramineae-Gramineae and Cruciferae-Cruciferae. Among which when,,,andwere used as the surrogate species, the estimated toxicity values of predicted species were close to the actual tested values. The screening of the test plants and the establishment of the ecotoxicity prediction model can help generate ecotoxicity data and provide a scientific basis for soil pollution management and ecological risk assessment.
soil ecological criteria;screening of test organisms;angiosperm species;species sensitivity analysis;ICE model prediction
X53
A
1000-6923(2022)07-3295-11
罗晶晶(1997-),女,宁夏银川人,中国环境科学研究院硕士研究生,主要从事生态毒理学研究.
2021-12-28
国家重点研发计划(2019YFC1804604,2019YFC1803401- 003-03)
* 责任作者, 副研究员, wangxn@craes.org.cn
