密度分离法提取土壤中微塑料的优化
2022-07-19李振国余光辉王广怀姜晓倩
林 婧,李振国,余光辉,张 勇,宋 焱,王广怀,姜晓倩
密度分离法提取土壤中微塑料的优化
林 婧,李振国*,余光辉,张 勇,宋 焱,王广怀,姜晓倩
(湖南科技大学地球科学与空间信息工程学院,湖南 湘潭 411201)
为探究一种简单、经济和可靠的微塑料分离提取手段,设立了11种(F1~F11)具有不同体积比的饱和NaCl和饱和NaI溶液的混合溶液,将混合液作为浮选液来提取土壤中的4种类型(聚乙烯,PE;聚苯乙烯,PS;聚氯乙烯,PVC;聚对苯二甲酸乙二醇酯,PET)微塑料,同时对浮选过程进行了改进.结果表明:当单独使用NaCl溶液浮选时,微塑料的总提取率为55.83%,但随着NaI所占体积比的不断增加,微塑料的总提取率基本呈上升趋势,在NaCl:NaI=1:1时总提取率超过了90%,在只有NaI的条件下总提取率高达96.67%;在F1~F11的任意条件下,PE和PS表现为较高的提取率,均超过了86.67%;PVC和PET在单独使用NaCl溶液浮选时提取率极低,在NaCl:NaI=1:1条件下提取率分别为93.33%和90%,接近单独使用NaI溶液浮选时的提取率; F1~F11任意条件下,低密度微塑料PE和PS的提取率之和均高于高密度微塑料PVC和PET的提取率之和,但在F6~F11条件下提取率差值不大.根据提取结果并结合经济成本等多方面因素考虑,建议使用NaCl:NaI=1:1的混合溶液来分离土壤中的微塑料.
密度分离法;微塑料;土壤;提取;浮选液
“微塑料”一词由Thompson于2004年首次提出[1],它通常是指粒径小于5mm的塑料颗粒[2].微塑料由于其体积小、难被降解等性质,能够在环境中长距离运输并持久存在[3].如今在水体[4]、大气[5]、土壤[6]、食品[7]、饮用水[8-9]甚至人体[10]中都发现了微塑料的踪迹,影响着生物生长与人类的健康安全.此外,微塑料还可作为载体,吸附环境中的持久性有机污染物(多氯联苯 (PCBs)、多环芳烃(PAHs)和二氯二苯基三氯乙烷(DDTs)等)[11-13]及重金属[14-16],产生复合污染效应.因此,有必要对微塑料污染状况进行研究调查,以明确其潜在环境风险.
有关于微塑料的研究最早开始于海洋环境,研究者们对海洋及海岸环境中微塑料的污染特征及环境毒理学效应进行了分析[17-19].而后延续到陆地环境中,国内外学者开始对河流及湖泊等淡水水体和沉积物中微塑料的含量、分布、富集情况及生态风险评价等方面展开研究[20-22].直到近几年才逐渐把研究焦点放到土壤中来.但由于土壤是一个复杂的三相体系,且易受到土壤质地、有机质及团聚体结构的影响,土壤中微塑料的分离与鉴定比水和沉积物中更加困难[23],因此土壤微塑料的研究还相对较少.土壤是人们生存和发展的基础,土壤所种植的粮食作物及蔬菜更是直接与人类的饮食和健康密切相关,因此开展土壤微塑料的研究工作具有重要意义.
开展土壤微塑料的研究工作的关键在于如何将微塑料从土壤中分离提取出来,才能进一步进行检测和分析,而目前国际上在提取微塑料的方法学上还未形成统一的技术规范.研究者们最常使用的是密度分离法,通过利用浮选液和微塑料的密度差来达到分离效果.由于饱和NaCl溶液(1.2g/cm3)廉价易得且对环境无污染[24],成为了现有研究中使用最普遍的浮选液[25-26].但饱和NaCl溶液只能用于提取密度低于1.20g/cm3的聚合物,而在分离聚氯乙烯(PVC,1.22~1.50g/cm3)、聚对苯二甲酸乙二醇酯(PET, 1.29~1.40g/cm3)等高密度聚合物时效果很不理想.针对这一情况,不少研究人员采用KI[27]、ZnCl2[28-29]、NaI[30-31]、聚钨酸钠(3Na2WO4·9WO3·H2O, SPT)[32-33]和甲酸钾(HCO2K)[34-35]等高密度浮选液成功提取了高密度聚合物.但高密度浮选液基本会对环境造成危害,而与其他高密度盐溶液相比,饱和NaI溶液对环境的污染相对较小.Claessens等[36]使用自来水和NaI溶液进行两步萃取,该方法对中塑性颗粒和小微塑性颗粒的提取效果较好,但由于仪器体积大,需要大量溶液,而碘化钠价格十分昂贵,导致分析成本较高.Nuelle等[37]采用两步分选法,样品首先在NaCl溶液中使用基于流态化的空气诱导溢流法进行预提取,然后再用更高密度的NaI溶液对样品做后续浮选,虽减少了NaI使用成本,但该方法操作复杂.
由于上述浮选液及提取过程存在提取率不高、成本昂贵、操作复杂等方面问题,鉴于此,本研究基于密度分离法对浮选液和浮选过程进行了改进和优化,拟探讨一种操作简单、经济、准确度高的土壤微塑料的提取方法.将饱和NaCl溶液和饱和NaI溶液按照不同体积比混合,共设立11种不同组合的浮选液.通过人工模拟微塑料的方法,探究11种不同组合的NaCl和NaI混合液对土壤中的4种类型(聚乙烯, PE; 聚苯乙烯, PS;聚氯乙烯, PVC;聚对苯二甲酸乙二醇酯, PET)微塑料的提取效果.根据提取率结果,并结合经济成本等因素考虑,选出最佳浮选溶液,以期为土壤中微塑料的分离提供方法学参考和基础数据信息.
1 材料与方法
1.1 供试材料
本试验购买了四种常见类型的塑料商品:土工膜(聚乙烯, PE)、快餐泡沫盒(聚苯乙烯, PS)、塑料水管(聚氯乙烯, PVC)和饮料瓶(聚对苯二甲酸乙二醇酯, PET),分别代表密度较低(PE, 0.94~0.97g/cm3; PS, 1.04~1.08g/cm3)和密度较高(PVC, 1.22~1.50g/ cm3; PET, 1.29~1.40g/cm3)的塑料.人工切割、剪碎和研磨这些塑料商品后过1mm标准筛,制得不同形状、大小的微塑料标准品.在连续变倍体视显微镜 (SZN71,舜宇光学科技(集团)有限公司)和扫描电子显微镜(日立,SU3500)下观察微塑料的粒径及形状特征.微塑料原产品、微塑料标准品、微塑料标准品的显微镜及电镜扫描图见图1.每种微塑料标准品具有不同的颜色,以便区分计数并计算提取率.表1列出了塑料颗粒的性质及其原产品.
试验介质土壤均采自湘潭市河东沿江风光带的表层砂土(0~5cm).土壤于105℃烘箱中烘干、冷却至室温后筛选出肉眼可见的动植物残渣、塑料碎片以及石块等,再经研磨后过1mm标准筛.研磨后的土壤依次经蒸馏水、饱和NaCl溶液(密度为1.20g/cm3)和饱和NaI溶液(密度为1.80g/cm3)多次浮选后去除了土壤样品本身所含的微塑料,得到了不含微塑料的清洁土壤,经80℃烘干后放入预先清洗过的棕色玻璃瓶中保存备用.
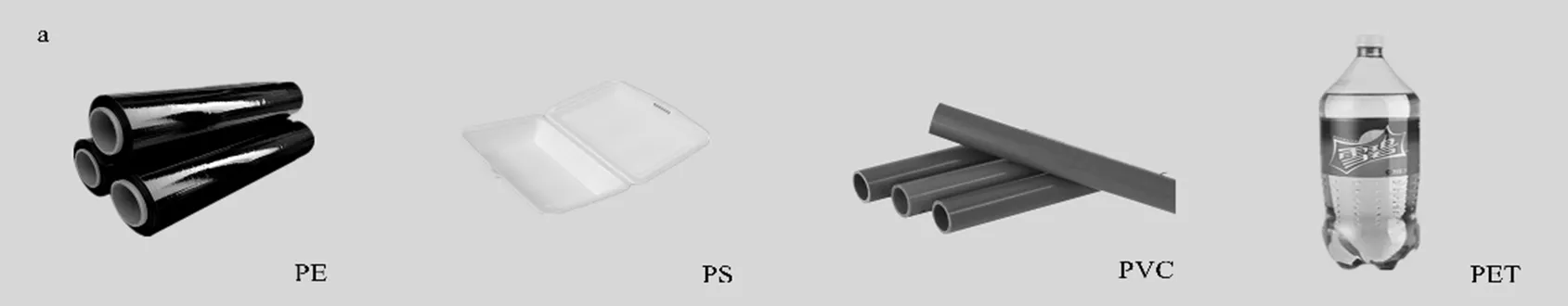

图1 试验所用不同类型的微塑料
(a)微塑料原产品; (b)微塑料标准品; (c)微塑料标准品的显微镜图;(d)微塑料标准品的电镜扫描图
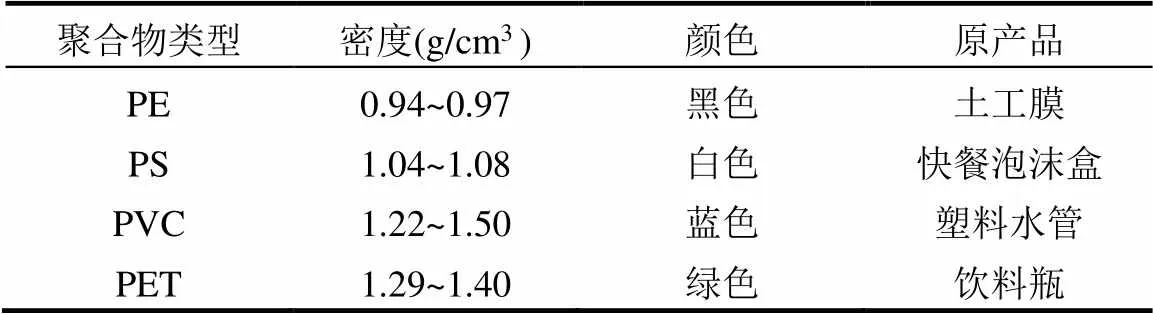
表1 塑料颗粒的性质及其原产品
1.2 试验设计及过程
为探究按照不同体积比混合的NaCl和NaI的浮选液对微塑料提取率的影响,试验选择PE、PS、PVC、PET四种微塑料,设置11组不同组合进行试验:
F1: NaCl;F2: NaCl:NaI=9:1;F3: NaCl:NaI=8:2; F4: NaCl:NaI=7:3;F5: NaCl:NaI=6:4;F6: NaCl:NaI= 5:5;F7: NaCl:NaI=4:6;F8: NaCl:NaI=3:7;F9: NaCl: NaI=2:8;F10: NaCl:NaI=1:9;F11: NaI.
饱和氯化钠溶液和饱和碘化钠溶液由过量的氯化钠(NaCl, AR, 99.5%)和碘化钠(NaI, AR, 99%)颗粒溶解于蒸馏水中制得.F1~F11每组平行3次,共计33次试验.具体步骤如下:
①用分析天平称取10g清洁土壤于100mL锥形瓶中,并向其中添加4种类型(PE、PS、PVC、PET)的微塑料标准品各10个,共计40个.
②用量筒量取50mL 浮选液(F1~F11),加入锥形瓶中.
③将锥形瓶置于磁力搅拌器上以200rpm的转速摇匀30min,然后静置沉降24h,待溶液分层.
④分离上层悬浮液:将上清液倒入配备有微孔滤膜(尼龙,孔径0.45μm)的布氏漏斗中进行抽滤.并用少量蒸馏水冲洗锥形瓶内壁和布氏漏斗内壁,以尽可能避免微塑料粘附在瓶壁上.
上述浮选过程重复3次.
⑤将滤膜转移至玻璃培养皿中,加盖风干.
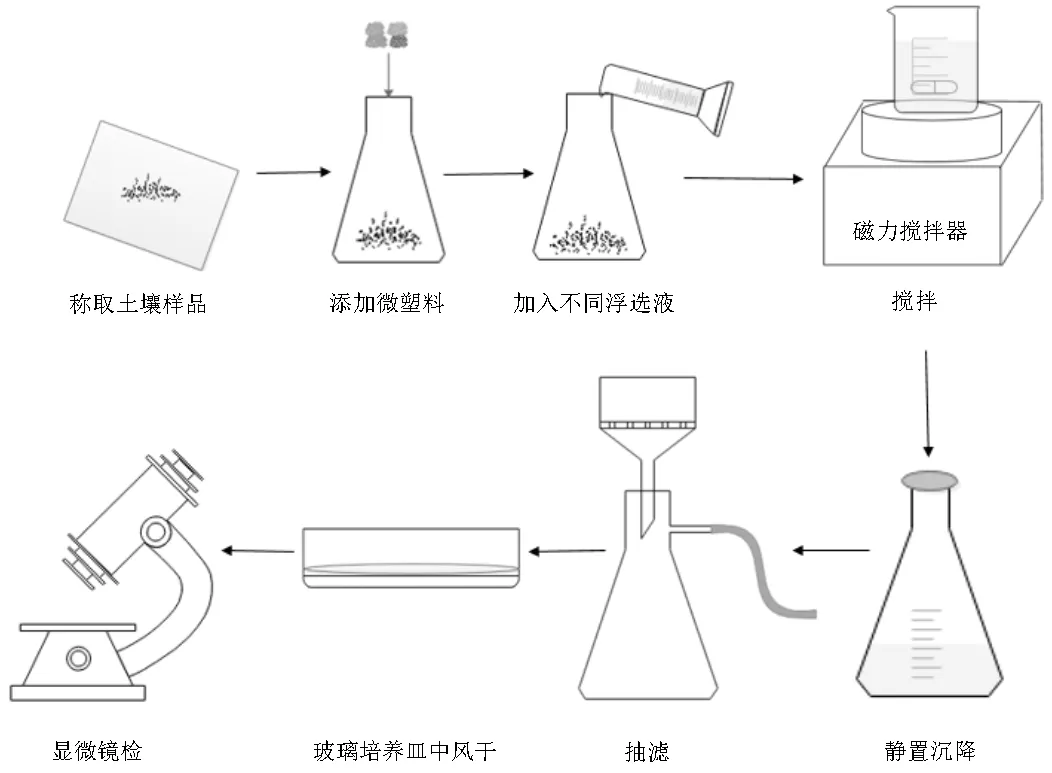
图2 微塑料的提取过程
⑥待滤膜干燥后,在连续变倍体视显微镜 (SZN71,舜宇光学科技(集团)有限公司)和扫描电子显微镜(JSM-6380LV,JEOL)下观察微塑料的表面微观形态,记录微塑料的数量并计算提取率.
以上提取过程如图2所示.
⑦消解:将滤膜上的滤渣转移至30mL 30% H2O2中,在水浴恒温振荡器中70℃连续振荡24h.
⑧消解后将液体真空抽滤至孔径0.45μm尼龙膜上,并用少量蒸馏水冲洗容器内壁,随后将滤膜转移至玻璃培养皿中加盖风干.
⑨在连续变倍体式显微镜和扫描电子显微镜下观察消解后的微塑料,对比消解前后微塑料的数量及表面形态特征.
1.3 数据分析
在本研究中,提取率进行了均值计算和标准偏差核算,结果用“平均值±标准偏差(=3)”表示.相关图表制作在Origin8.0与Excel 2016软件中完成.
1.4 质量控制
为了避免试验过程中空气沉降、衣物合成纤维等带来的数据失真问题,采取了以下防护措施:
①在取样和实验过程中,避免使用一切塑料制品,均采用不锈钢产品或玻璃制品;
②试验人员始终穿着纯棉衣物,而非化纤衣服.
③对所需用到的仪器预先进行清洗,清洗后立即用铝箔覆盖,以避免空气中可能的微塑料进入容器中.
④在每个单独步骤后,所有材料和容器均用铝箔纸覆盖开口.
⑤在打开和分析储存微塑料的玻璃培养皿之前,对连续变倍体视显微镜分析的工作场所进行清洁.
⑥在试验中设置空白对照,除不加入土样外,其余操作均一致,以监控实验室大气中可能存在的微塑料污染,但均未观察到.
2 结果与分析
2.1 不同浮选液下微塑料的总提取率
在不同浮选液下微塑料的总提取率有所差异,微塑料的总提取率与浮选液的变化关系如图3所示.当单独使用NaCl溶液浮选时(即F1条件下),微塑料的总提取率最低,仅为55.83%.随着NaI在混合液中比例的增加,F1àF6条件下微塑料的总提取率大幅上升.当浮选液比例为NaCl:NaI=1:1(即F6条件下)时,微塑料的总提取率超过了90%.F6àF11总提取率缓慢上升并趋于稳定,F10和F11条件下微塑料的总提取率高达96.67%.总体而言,随着NaI所占体积比的不断增加,微塑料的总提取率基本呈上升趋势.
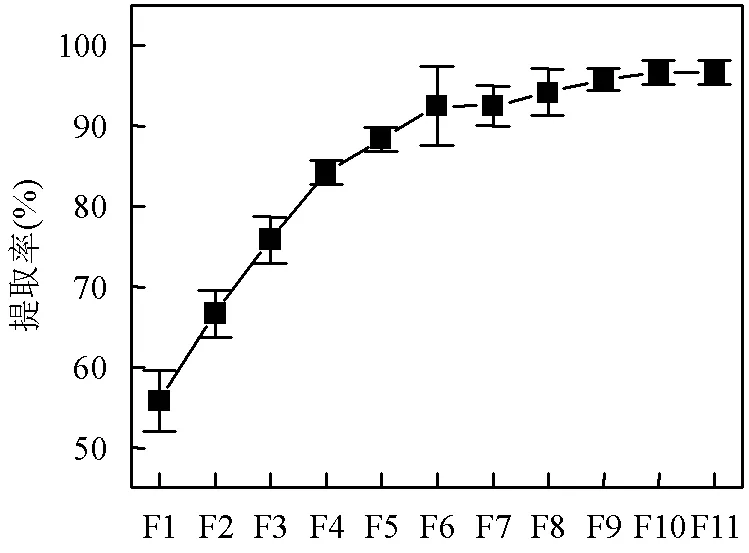
图3 微塑料的总提取率与浮选液的变化关系
2.2 不同类型微塑料的提取率
分析结果显示,不同类型的微塑料的提取率有所差异(图4).针对PE和PS这两种低密度微塑料,在F1~F11的任意条件下,都具有很高的提取率.PE提取率最低的一组为F2条件下的86.67%,其余条件下均超过90%;PS提取率最低的一组为F3条件下的90%,F11条件下PS完全被分离出来,提取率为100%.
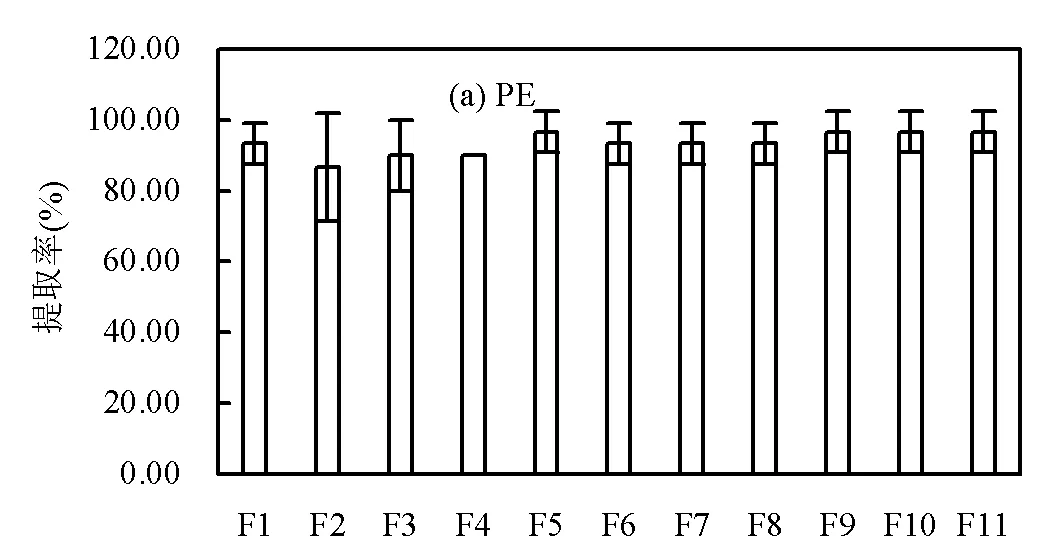
PVC和PET这两种高密度微塑料在单独使用NaCl溶液浮选时(即F1条件下)提取率很低,仅为13.33%和23.33%;在F2~F4条件下提取率虽在不断提高,但也均未超过80%.当NaCl:NaI=1:1(即F6条件下),PVC的和PET的提取率分别达到了93.33%和90%,与单独使用NaI溶液浮选时(即F11条件下)两种微塑料提取率分别为96.67%和93.33%的结果十分相近.
无论是在何种条件下,低密度微塑料PE和PS的提取率之和均高于高密度微塑料PVC和PET的提取率之和,但在F6~F11条件下低密度微塑料跟高密度微塑料的提取率差值不大.
2.3 微塑料的粒径及形状特征
对制备出的微塑料标准品进行了粒径和形状表征(图1(c)~(d)、图6).
2.3.1微塑料的粒径特征微塑料的粒径范围为58.97~986.43μm,平均粒径为453.33μm.将微塑料按尺寸大小的不同划分为<200μm、200~400μm、400~ 600μm、600~800μm以及800~1000μm这5类,微塑料不同尺寸所占百分比如图5所示.
从总体来看,微塑料的粒径范围以400~600μm居多,占比35.60%,其次分别为200~600μm和600~800μm.而粒径范围在<200μm和800~1000μm较少,分别占比7.59%和4.62%.
不同类型的微塑料的粒径也有所差异.PE与PVC这两种类型微塑料的粒径所占百分比最高的均为400~600μm,但所占百分比最低的粒径范围有所不同,PE为粒径<200μm的最低,PVC则是粒径范围在400~600μm的最低.而对于PS和PET这两种微塑料,粒径分布较为集中,均有超过50%的微塑料位于同一粒径范围内,PS有53.88%的微塑料的粒径位于600~800μm,而PET有55.73%微塑料的粒径为200~400μm.
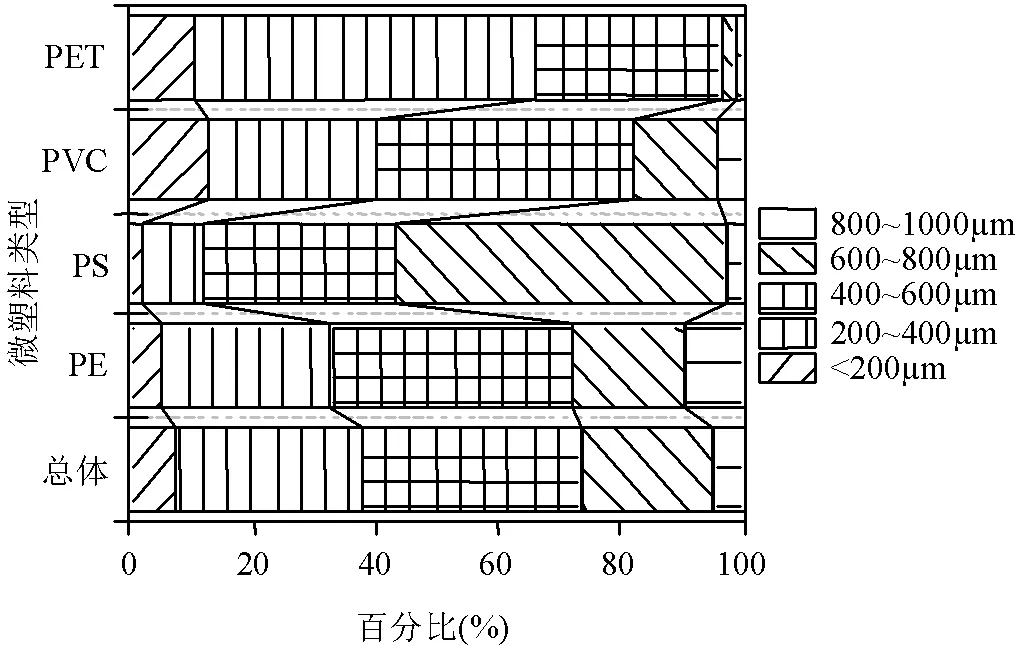
图5 微塑料不同尺寸所占百分比
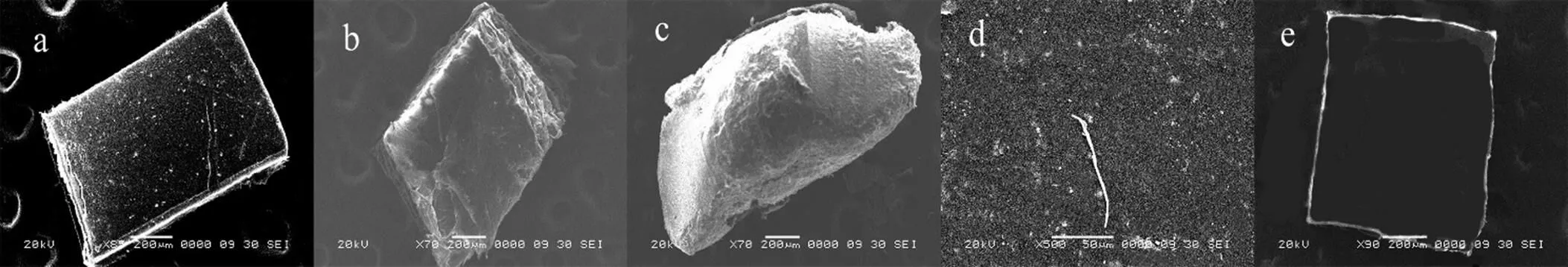
图6 不同形状的微塑料扫描电镜图
(a)碎片类; (b)泡沫类; (c)颗粒类; (d)纤维类; (e)薄膜类
2.3.2 微塑料的形状特征 微塑料的形状主要包括颗粒、碎片、泡沫、薄膜和纤维五种(图6及图7).不同形状的微塑料所占数量的百分比依次递减的顺序为碎片>颗粒>泡沫>纤维>薄膜.碎片状的微塑料主要以PE及PET为主,而泡沫状的微塑料全部为PS.颗粒状及纤维状的微塑料主要由PVC构成.在四种微塑料中,PET表现的形状最多,有颗粒、薄膜和碎片三类.
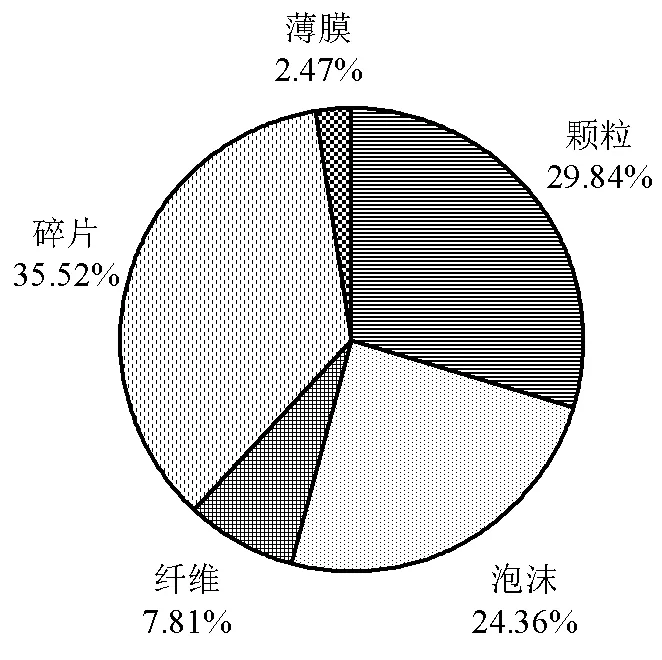
图7 不同形状微塑料的百分比
3 讨论
3.1 浮选过程对微塑料提取率的影响
在分离提取土壤中微塑料的过程中,由于土壤本身含有悬浮颗粒物、细小的植物体等杂质,在分离上清液时易将杂质与微塑料一同分离出去,从而导致滤膜上有较多杂质,可能会堵塞滤膜.
Nuelle等[37]在使用NaI溶液浮选时,首先将微塑料与样品混合于容量瓶中,静置沉淀分出上清液于烧杯中,然后在烧杯中再次静置后再倾倒至过滤装置中进行过滤;Liu等[38]和Lü等[39]在用饱和NaCl溶液浮选时,均是先在烧杯中浮选出上清液,然后将上清液于锥形瓶中再次静置再于过滤器中过滤.这些研究人员在浮选时都采取了梯次静置的措施以达到减少杂质的目的.但在上述过程中溶液转移2次,有可能造成微塑料丢失的情况,从而使微塑料的提取率数值略低.因此,为了减少溶液转移次数从而减少微塑料丢失的可能性,本研究直接将锥形瓶中上清液倒入过滤装置中.而为了避免出现滤膜堵塞的情况,试验过程中采取了勤换滤膜和增加静置沉降时间的措施.
在以往的研究中,研究人员们大多选择静置沉降1h[40]、6h[41]、24h[38-39]或48h[42]不等.本研究对比了使用NaCl:NaI=1:1浮选液(F6条件下)浮选时不同时间段的沉降效果(图8).

图8 NaCl:NaI=1:1浮选液下不同时间段静置沉降效果对比
根据效果对比图,当静置时间为1h,浮选液十分浑浊;静置时间为6h时,体系组分基本分开,但上清液不够澄清;静置时间为24h时,溶液沉淀完全,上清液十分澄清;静置时间为48h时,肉眼下与静置沉降24h时效果区别不大.因此,为尽可能减少进入到滤膜上的杂质、增大提取率,同时缩短实验时间、提高实验效率,本研究选择静置沉淀24h后再分离上清液.
3.2 浮选溶液对微塑料提取率的影响
密度分离法被认为是分离微塑料的有效方法,并且采用的盐溶液密度越高则可以提取的微塑料种类范围就越广.单独使用NaCl溶液浮选时,对PE、PS、PVC、PET四种类型微塑料的提取率分别为93.33%±5.77%、93.33%±5.77%、13.33%±11.55%、23.33%±15.28%.对PVC和PET的提取效果不好的原因是饱和NaCl溶液的密度低于PVC和PET,无法将这两种微塑料全部从土壤分离开来.Liu等[38]使用饱和NaCl溶液对上海市农田土壤中的微塑料进行浮选提取,PP、PE、PA、PC、ABS、PMMA和PS颗粒的回收率均在90%以上,而未成功提取出PVC和PET.PE与PS的提取结果与本实验相似,而PVC和PET的提取率比本实验略低,这可能是由于Liu等在转移微塑料的过程中进行了两次转移,造成了部分微塑料的损失,且Liu等[38]的提取对象跟本实验不同,提取对象间存在特征差异可能会导致提取率结果存在差异.
当混合液体积比为NaCl:NaI=1:1时,PE、PS和PVC的提取率的提取率均为93.33%,而PET也增至90%.相比使用NaCl溶液浮选,PVC及PET两种微塑料的提取率大幅增高,这是由于随着混合液中NaI的体积增加,混合液的密度逐渐增大,因而提取率也在逐渐上升.
当浮选液全部为NaI溶液时,溶液密度达到最大值,此时PE、PS、PVC、PET的提取率分别96.67%±5.77% 、100.00%±0.00%、96.67%±5.77%、93.33%±5.77% .此结果与Nuelle等[37]所得出的PE、PP、PVC、PET、PS、PUR的回收率为91%~99%的结论相一致.
PE、PS、PVC和PET四种类型的微塑料在NaCl、NaCl:NaI=1:1和NaI三种不同浮选液下的提取率结果对比见图9.相较使用NaCl溶液浮选,使用NaCl:NaI=1:1的混合液或NaI溶液浮选对高密度微塑料PVC和PET的提取效果好,三种溶液下PE与PS的提取率值相差不大.
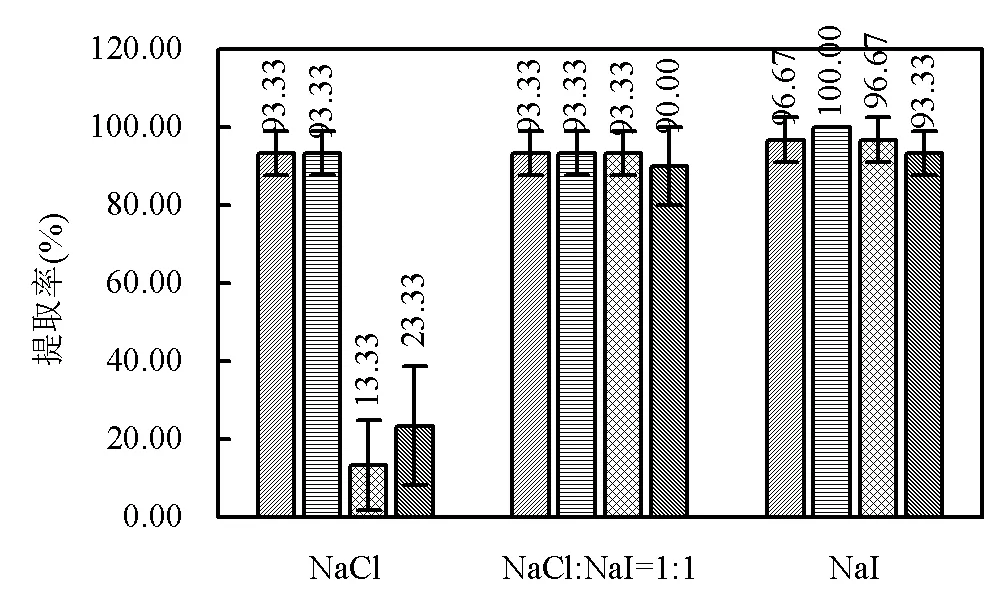
图9 NaCl、NaCl:NaI=1:1、NaI三种不同浮选液下PE、PS、PVC和PET的提取率

3.3 消解对微塑料提取率及表面形态特征的影响
土壤中有机质的密度通常介于1.0~1.4g/cm3,与PET和PA等微塑料的密度相近[43].因此简单的密度分离法并不能很好地实现微塑料的分离[44],还需进行消解处理.
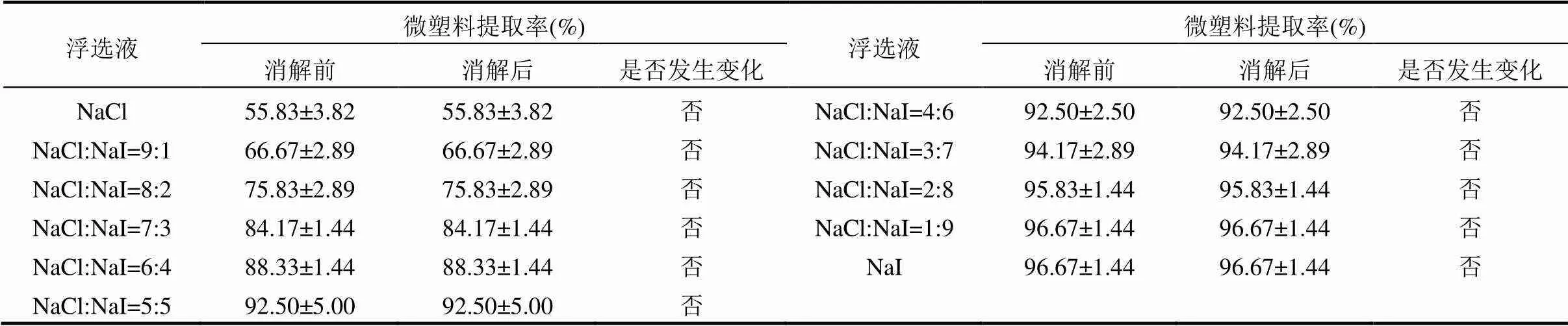
表2 消解前后微塑料的提取率变化

图10 消解前后PE的扫描电镜图
(a)消解前; (b)消解后
目前,H2O2是大多数研究者们常用的有机质消解液[38,45-46],但有关H2O2消解的最佳浓度、消解时间和温度还未统一,各项研究采取的参数都不相同,且对于 H2O2是否会破坏微塑料的结构还存在争议[37,46-47].
试验对比了在70℃下经30% H2O2消解24h前后的微塑料,发现消解过程对微塑料的数量未造成影响,11种(F1~F11)浮选液组合下微塑料的提取率均没有发生变化(表2).而通过扫描电子显微镜观察到经30% H2O2处理后会导致PE表面轻微溶解(图10),消解过程对于其余三种类型微塑料表面形态的影响则未观察到.由于此消解方案对土壤有机质的去除效果良好,且对微塑料表面虽有轻微溶解但不会造成微塑料丢失.因此,使用30% H2O2于70℃下消解24h可作为一个优良的消解方案用于土壤有机质的去除.
3.4 土壤中微塑料分离提取的最佳浮选液
目前,国内外研究中大多使用单一的浮选液,而将高密度盐溶液和低密度盐溶液的混合液用来分离提取的研究还很罕见.本研究探究了NaCl和NaI的混合液对土壤中微塑料的提取效果,根据实验结果,若单独选用NaCl溶液浮选或NaCl溶液体积少于NaCl和NaI混合液一半时,提取效果不太理想.当NaCl:NaI=1:1及NaI溶液体积多于NaCl溶液体积时,浮选液能够将土壤中90%以上不同密度不同种类的微塑料成功提取出来.由于NaI价格昂贵,而比较使用NaCl:NaI=1:1浮选液与NaI浮选液的两种提取结果,提取率数值相差不大,且由图11可明显得出使用NaCl:NaI=1:1浮选的效果十分稳定,因此从经济成本角度出发,建议使用NaCl:NaI=1:1的混合液用于土壤中微塑料的分离提取.
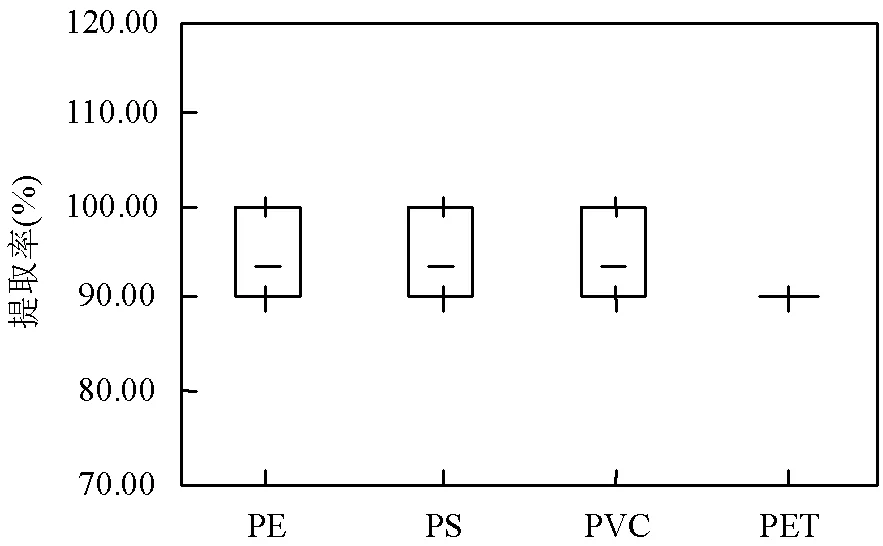
图11 NaCl:NaI=1:1浮选液下微塑料的提取率
此外,NaCl:NaI=1:1的混合液相较于其他常用的高密度盐溶液具有一定的优越性,如:CaCl2溶液会促进土壤有机质结块,干扰后续微塑料的识别[44]; ZnCl2溶液具有很强的毒性和高腐蚀性,可能会造成环境风险[48];NaI虽具有一定的氧化性[49],但在实验过程中是可控的,不会对测量结果造成影响.因此,可将NaCl:NaI=1:1作为浮选液用于分离提取微塑料,且为了节约成本可进行回收与重复利用.
为了验证NaCl:NaI=1:1的混合液作为浮选液的合理性,试验中测定了所配置的NaCl:NaI=1:1的混合液的密度,得出结果为1.56g/cm3,而环境介质中发现的微塑料的密度通常为0.8~1.4g/cm3 [50],符合密度分离法的原理,将NaCl:NaI=1:1的混合液用于提取现实环境中的土壤样品具有理论依据.
使用NaCl:NaI=1:1浮选液对各种微塑料的提取率均高达90%及以上,说明该浮选液用于提取微塑料是有效的,但由于密度分离法本身的局限性,它可能不适合分离粒径小于10μm的塑料颗粒[34],而小塑料微粒(<50μm)含量很高,约占总塑料微粒的35%~90%[19,51],如何有效从土壤中分离小颗粒微塑料是今后需要关注的问题.
4 结论
4.1 本研究对土壤微塑料检测中的浮选过程进行了改进:通过减少溶液的转移次数从而避免了微塑料丢失的可能性,采取了增加静置沉降的时间与频换滤膜以达到减少杂质的目的.
4.2 采用NaCl和NaI混合液浮选时,随着NaCl和NaI混合液中NaI所占比例不断增加,微塑料的提取率不断上升.由于使用NaCl:NaI=1:1溶液浮选时的对各类微塑料的提取率均在90%以上,且接近于使用NaI溶液浮选的提取率,从经济成本角度出发,建议使用NaCl:NaI=1:1的混合液用于土壤中微塑料的分离提取.
4.3 NaCl:NaI=1:1的混合液相较于其他常用的浮选液具有一定优越性:比CaCl2准确、比ZnCl2环保、比NaI经济,将NaCl:NaI=1:1的混合液用于分离提取土壤中的微塑料是合理、准确且高效的.
[1] Thompson R C, Olsen Y, Mitchell R P, et al. Lost at Sea: where is all the plastic? [J]. Science, 2004,304(5672):838-838.
[2] Claessens M, De Meester S, Van Landuyt L, et al. Occurrence and distribution of microplastics in marine sediments along the Belgian coast [J]. Marine pollution bulletin, 2011,62(10):2199-2204.
[3] Andrady A L. Microplastics in the marine environment [J]. Marine Pollution Bulletin, 2011,62(8):1596-1605.
[4] Alimi O S, Farner Budarz J, Hernandez L M, et al. Microplastics and nanoplastics in aquatic environments: aggregation, deposition, and enhanced contaminant transport [J]. Environmental Science & Technology, 2018,52(4):1704-1724.
[5] 田 媛,涂 晨,周 倩,等.环渤海海岸大气微塑料污染时空分布特征与表面形貌 [J]. 环境科学学报, 2020,40(4):1401-1409.
Tian Y, Tu C, Zhou Q, et al. The temporal and spatial distribution and surface morphology of atmospheric microplastics around the Bohai Sea [J]. Acta Scientiae Circumstantiae, 2020,40(4):1401-1409.
[6] Nizzetto L, Langaas S, Futter M. Pollution: Do microplastics spill on to farm soils? [J]. Nature, 2016,537(7621):488-488.
[7] EFSA Panel on Contaminants in the Food Chain (CONTAM). Presence of microplastics and nanoplastics in food, with particular focus on seafood [J]. Efsa Journal, 2016,14(6):e04501.
[8] Kosuth M, Mason S A, Wattenberg E V. Anthropogenic contamination of tap water, beer, and sea salt [J]. PloS one, 2018,13(4):e0194970.
[9] Schymanski D, Goldbeck C, Humpf H U, et al. Analysis of microplastics in water by micro-Raman spectroscopy: release of plastic particles from different packaging into mineral water [J]. Water Research, 2018,129:154-162.
[10] Wright S L, Kelly F J. Plastic and human health: a micro issue? [J]. Environmental science & technology, 2017,51(12):6634-6647.
[11] Antunes J C, Frias J G L, Micaelo A C, et al. Resin pellets from beaches of the Portuguese coast and adsorbed persistent organic pollutants [J]. Estuarine, Coastal and Shelf Science, 2013,130:62-69.
[12] Frias J, Sobral P, Ferreira A M. Organic pollutants in microplastics from two beaches of the Portuguese coast [J]. Marine Pollution Bulletin, 2010,60(11):1988-1992.
[13] Oliveira M, Ribeiro A, Hylland K, et al. Single and combined effects of microplastics and pyrene on juveniles (0+ group) of the common goby(Teleostei, Gobiidae) [J]. Ecological Indicators, 2013,34:641-647.
[14] Ashton K, Holmes L, Turner A. Association of metals with plastic production pellets in the marine environment [J]. Marine Pollution Bulletin, 2010,60(11):2050-2055.
[15] 范秀磊,常卓恒,邹晔锋,等.可降解微塑料对铜和锌离子的吸附解吸特性 [J]. 中国环境科学, 2021,41(5):2141-2150.
Fan X L, Chang Z H, Zou Y F, et al. Adsorption and desorption properties of degradable microplastic for Cu2+and Zn2+[J]. China Environmental Science, 2021,41(5):2141-2150.
[16] Brennecke D, Duarte B, Paiva F, et al. Microplastics as vector for heavy metal contamination from the marine environment [J]. Estuarine, Coastal and Shelf Science, 2016,178:189-195.
[17] La Daana K K, Gårdfeldt K, Lyashevska O, et al. Microplastics in sub-surface waters of the Arctic Central Basin [J]. Marine Pollution Bulletin, 2018,130:8-18.
[18] Zhao S, Zhu L, Wang T, et al. Suspended microplastics in the surface water of the Yangtze Estuary System, China: first observations on occurrence, distribution [J]. Marine Pollution Bulletin, 2014,86(1/2): 562-568.
[19] Eriksen M, Mason S, Wilson S, et al. Microplastic pollution in the surface waters of the Laurentian Great Lakes [J]. Marine Pollution Bulletin, 2013,77(1/2):177-182.
[20] Anderson P J, Warrack S, Langen V, et al. Microplastic contamination in lake Winnipeg, Canada [J]. Environmental Pollution, 2017,225: 223-231.
[21] 王志超,窦雅娇,周 鑫,等.岱海冰封期微塑料与环境因子的关系及风险评价 [J]. 中国环境科学, 2022,42(2):889-896.
Wang Z C, Dou Y J, Zhou X, et al. Relationship between microplastics occurrence and environmental factors and risk assessment during ice-covered period of the Daihai Lake. China Environmental Science, 2022,42(2):889-896.
[22] He B, Goonetilleke A, Ayoko G A, et al. Abundance, distribution patterns, and identification of microplastics in Brisbane River sediments, Australia [J]. Science of the Total Environment, 2020, 700:134467.
[23] Rillig M C. Microplastic in terrestrial ecosystems and the soil? [J]. Environmental Science & Technology, 2012,46(12):6453-6454.
[24] Li J, Liu H, Chen J P. Microplastics in freshwater systems: A review on occurrence, environmental effects, and methods for microplastics detection [J]. Water research, 2018,137:362-374.
[25] Lots F A E, Behrens P, Vijver M G, et al. A large-scale investigation of microplastic contamination: abundance and characteristics of microplastics in European beach sediment [J]. Marine Pollution Bulletin, 2017,123(1/2):219-226.
[26] Zhao J, Ran W, Teng J, et al. Microplastic pollution in sediments from the Bohai Sea and the Yellow Sea, China [J]. Science of the Total Environment, 2018,640:637-645.
[27] Phuong N N, Poirier L, Lagarde F, et al. Microplastic abundance and characteristics in French Atlantic coastal sediments using a new extraction method [J]. Environmental Pollution, 2018,243:228-237.
[28] Liebezeit G, Dubaish F. Microplastics in beaches of the East Frisian islands Spiekeroog and Kachelotplate [J]. Bulletin of environmental contamination and toxicology, 2012,89(1):213-217.
[29] 韩丽花,李巧玲,徐 笠,等.大辽河沉积物中微塑料的污染特征 [J]. 中国环境科学, 2020,40(4):1649-1658.
Han L H, Li Q L, Xu L, et al. The pollution characteristics of microplastics in Daliao River sediments [J]. China Environmental Science, 2020,40(4):1649-1658.
[30] Wang J, Wang M, Ru S, et al. High levels of microplastic pollution in the sediments and benthic organisms of the South Yellow Sea, China [J]. Science of the Total Environment, 2019,651:1661-1669.
[31] Van Cauwenberghe L, Vanreusel A, Mees J, et al. Microplastic pollution in deep-sea sediments [J]. Environmental Pollution, 2013,182:495-499.
[32] Corcoran P L, Biesinger M C, Grifi M. Plastics and beaches: A degrading relationship [J]. Marine pollution bulletin, 2009,58(1): 80-84.
[33] Ballent A, Corcoran P L, Madden O, et al. Sources and sinks of microplastics in Canadian Lake Ontario nearshore, tributary and beach sediments [J]. Marine Pollution Bulletin, 2016,110(1):383-395.
[34] Zhang K, Xiong X, Hu H, et al. Occurrence and characteristics of microplastic pollution in Xiangxi Bay of Three Gorges Reservoir, China [J]. Environmental Science & Technology, 2017,51(7):3794- 3801.
[35] Zhang K, Su J, Xiong X, et al. Microplastic pollution of lakeshore sediments from remote lakes in Tibet plateau, China [J]. Environmental Pollution, 2016,219:450-455.
[36] Claessens M, Van Cauwenberghe L, Vandegehuchte M B, et al. New techniques for the detection of microplastics in sediments and field collected organisms [J]. Marine Pollution Bulletin, 2013,70(1/2):227- 233.
[37] Nuelle M T, Dekiff J H, Remy D, et al. A new analytical approach for monitoring microplastics in marine sediments [J]. Environmental Pollution, 2014,184:161-169.
[38] Liu M, Lu S, Song Y, et al. Microplastic and mesoplastic pollution in farmland soils in suburbs of Shanghai, China [J]. Environmental Pollution, 2018,242:855-862.
[39] Lv W, Zhou W, Lu S, et al. Microplastic pollution in rice-fish co-culture system: A report of three farmland stations in Shanghai, China [J]. Science of the Total Environment, 2019,652:1209-1218.
[40] Fries E, Dekiff J H, Willmeyer J, et al. Identification of polymer types and additives in marine microplastic particles using pyrolysis-GC/MS and scanning electron microscopy [J]. Environmental science: Processes & Impacts, 2013,15(10):1949-1956.
[41] Shim W J, Song Y K, Hong S H, et al. Identification and quantification of microplastics using Nile Red staining [J]. Marine Pollution Bulletin, 2016,113(1/2):469-476.
[42] Li Q, Wu J, Zhao X, et al. Separation and identification of microplastics from soil and sewage sludge [J]. Environmental Pollution, 2019,254:113076.
[43] Bläsing M, Amelung W. Plastics in soil: Analytical methods and possible sources [J]. Science of the Total Environment, 2018,612:422- 435.
[44] Scheurer M, Bigalke M. Microplastics in Swiss floodplain soils [J]. Environmental science & technology, 2018,52(6):3591-3598.
[45] Zhang K, Shi H, Peng J, et al. Microplastic pollution in China's inland water systems: a review of findings, methods, characteristics, effects, and management [J]. Science of the Total Environment, 2018,630: 1641-1653.
[46] Liebezeit G, Dubaish F. Microplastics in beaches of the East Frisian islands Spiekeroog and Kachelotplate [J]. Bulletin of Environmental Contamination and Toxicology, 2012,89(1):213-217.
[47] Avio C G, Gorbi S, Regoli F. Experimental development of a new protocol for extraction and characterization of microplastics in fish tissues: first observations in commercial species from Adriatic Sea [J]. Marine environmental research, 2015,111:18-26.
[48] 顾伟康,杨国峰,刘 艺,等.环境介质中微塑料的处理与检测方法研究进展 [J]. 土木与环境工程学报(中英文), 2020,42(1):135-143.
Gu W K, Yang G F, Liu Y, et al. Treatment and detection methods of microplastics from environmental media: A review [J]. Journal of Civil And Environmental Engineering (Chinese and English), 2020,42(1): 135-143.
[49] Hidalgo-Ruz V, Gutow L, Thompson R C, et al. Microplastics in the marine environment: a review of the methods used for identification and quantification [J]. Environmental Science & Technology, 2012, 46(6):3060-3075.
[50] 李昇昇,李良忠,李 敏,等.环境样品中微塑料及其结合污染物鉴别分析研究进展 [J]. 环境化学, 2020,39(4):960-974.
Li S S, Li L Z, Li M, et al. Study on identification of microplastics and the combined pollutants in environmental samples [J]. Environmental Chemistry, 2020,39(4):960-974.
[51] Imhof H K, Laforsch C, Wiesheu A C, et al. Pigments and plastic in limnetic ecosystems: A qualitative and quantitative study on microparticles of different size classes [J]. Water Research, 2016,98: 64-74.
Optimization of microplastics extraction from soil by density separation.
LIN Jing, LI Zhen-guo*, YU Guang-hui, ZHANG Yong, SONG Yan, WANG Guang-huai, JIANG Xiao-qian
(School of Earth Sciences and Spatial Information Engineering, Hunan University of Science and Technology, Xiangtan 411201, China)., 2022,42(7):3285~3294
To explore a simple, economic and reliable method for separation and extraction of microplastics from soil, eleven mixed solutions comprising saturated NaCl and NaI solutions with progressively changing volume ratios (F1~F11) were prepared. These mixed solutions were used as the flotation liquid to extract four types of microplastics including polyethylene (PE), polystyrene (PS), polyvinyl chloride (PVC), and polyethylene terephthalate (PET) absorbed by soil with an improved protocol for flotation separation. The results showed that the total extraction rate of microplastics was only 55.83% when used purely NaCl saturated solution, while this extraction rate increased with an growing volume ratio of NaI in the mixture. The total extraction rate exceeded 90% when the volume ratio of saturated NaCl solution to NaI solution was 1:1and reached as high as 96.67% when using purely NaI solution. For all the eleven mixed solutions used, the extraction rates of PE and PS exceeded 86.67%, relatively higher than that of the other two types of microplastics. When using saturated NaCl solution alone, the extraction rates of PVC and PET were extremely low compared with that of 93.33% and 90% respectively in case the volume ratio of NaCl to NaI solution was 1:1, which were close to those obtained using NaI solution alone. Sum of the extraction rates of lower-density microplastics PE and PS was constantly higher than that of higher-density microplastics PVC and PET for all the eleven mixed solutions. However, the difference between extraction rates was neglectable among the mixed solutions F6 to F11. Based on the abovementioned results and considering factors such as economic cost, it is recommended that the mixture of saturated NaCl to NaI solution with a volume ratio of of 1:1 could be the optimal to extract microplastics in soil samples.
density separation;microplastics;soil;extraction;flotation liquid
X53
A
1000-6923(2022)07-3285-10
林 婧,(1998-),女,湖南湘潭人,湖南科技大学硕士研究生,主要从事土壤环境污染生态修复研究.
2021-12-08
湖南教育厅科研项目(16A068);湖南省自然科学基金项目(2018JJ3157)
* 责任作者,副教授, lizhenguo@hnust.edu.cn
