不同分割模式放疗对肺癌小鼠的抑瘤作用及对放射性心脏损伤的影响
2022-07-19王振华高国伟谷晓华陈利军张如楠任民柱
王振华 高国伟 谷晓华 陈利军 张如楠 任民柱 薛 鸣
肺癌为临床常见恶性肿瘤之一,多数患者入院确诊时已处于晚期,丧失最佳手术时机[1]。目前,分割放疗仍为晚期肺癌患者的重要治疗方法之一,可提升5年生存率[2]。临床常用分割放疗模式包括常规分割放疗、超分割放疗、大分割放疗,在肿瘤治疗中有一定作用,但不同分割放疗模式抑瘤作用存在差异。而且,一些肺癌患者在放疗期间,受固定方式、重复性摆位误差、呼吸运动、肿瘤自身变化及肿瘤周围器官移动等因素的影响,可能造成照射误差,累及部分正常组织如心脏,引发放射性心脏损伤,增加分割放疗方式选择难度[3]。基于此,本研究开展动物实验,重点分析不同分割模式放疗对肺癌小鼠的抑瘤作用及对放射性心脏损伤的影响,并探讨其机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 收集无特定病原体(specific pathogen free,SPF)级昆明种小鼠50只,雌雄各半,8周龄,体质量18~22 g,购自北京科兴生物制品有限公司,许可证号:SYXK(京)2019-0053。实验前在湿度(50±10)%、温度(22±2)℃环境内适应性喂养1周,12 h光照,自由获得饮水、饲料。
1.1.2 主要试剂和仪器 心肌肌钙蛋白I(cardiac troponin I,cTnI)、谷草转氨酶(aspartate amino-transferase,AST)、肌酸激酶同工酶(creatine kinase isoenzymes,CK-MB)酶联免疫吸附法检测试剂盒(上海晶抗生物工程有限公司),苏木精-伊红(hematoxylin-eosin staining,HE)染色法试剂盒(北京索来宝科技有限公司),TdT介导的dUTP缺口末端标记(TdT mediated-dUTP nick end labeling,TUNEL)染色试剂盒(上海泽叶生物有限公司),兔抗小鼠表皮生长因子受体(epidermal growth factor receptor,EGFR)、细胞周期蛋白D1(CyclinD1)、B淋巴细胞瘤2(B-cell lymphoma-2,Bcl-2)、β-actin一抗及山羊抗兔IgG二抗(美国Abcam公司)。
PRIMUS医用直线加速器治疗床(德国西门子公司),普通光学显微镜(日本奥林巴斯株式会社),Infinite M200酶标仪(瑞士TECAN公司)。
1.2 方法
1.2.1 模型制备及分组 50只小鼠建立肺癌小鼠模型[4]:建模前3 d,预防性给予5万单位注射用青霉素钠、50 mg注射用硫酸链霉素肌肉注射预防肺内感染。建模当天,戊巴比妥钠腹腔注射麻醉,仰卧位固定在鼠板上,经会咽部将特制钝头注射器插入气管,以0.1 mL致癌碘油液缓慢注入肺内。实验完成后剔除建模失败小鼠。建模成功标准:建模后出现食欲不振、呼吸加快、咳嗽增多等症状,组织病理学检查出现肿块,伴癌细胞、肺泡囊及纤毛上皮细胞结构异常改变等变化。50只小鼠建模成功46只,成功率92.00%。小鼠随机分为A组11只、B组11只、C组12只、D组12只。
1.2.2 动物干预 建模成功后24 h开始治疗,戊巴比妥钠腹腔注射麻醉,仰卧位固定于医用直线加速器治疗床,以专用画线笔标记肿瘤区域,采用8 MeV电子线照射,表面覆盖1 cm组织等效材料。激光定位在心脏部,照射野1 cm×1 cm,源皮距100 cm。B组实施常规分割放疗,剂量为1.8~2.0 Gy/次,每日1次;C组实施超分割放疗,剂量为1.4 Gy/次,每日2次,2次间隔12 h;D组实施大分割放疗,剂量为2.5 Gy/次,每日1次。A组给予普通光照射,每日1次。各组均照射7 d。
1.2.3 取材及处理 观察各组小鼠治疗后行为学变化,包括饮水量、饮食量、活动度、精神状态、呼吸状况等。完成行为学评估后,戊巴比妥钠腹腔注射麻醉,摘眼球取血2 mL,以备检测心肌损伤指标。取血后,脱颈椎法处死,完整剥取肿瘤组织,生理盐水冲洗2次,滤纸吸干表面水分,电子称称取瘤质量,计算抑瘤率[(1-治疗后平均瘤质量/A组平均瘤质量)×100%]。肿瘤组织称取瘤质量后,分为2份,1份置于4%多聚甲醛固定,以备检测病理形态学,另1份置于液氮保存,以备检测蛋白表达;同时,沿剑突纵轴线自下而上剪开胸腔,剥离心脏组织,置于4%多聚甲醛保存,以备检测心肌细胞凋亡。
1.2.4 血清cTnI、AST、CK-MB水平检测 取小鼠眼球血样,静置30 min。4℃,12 000 r/min离心,离心半径8 cm,15 min,取上清液。严格按照cTnI、AST、CK-MB酶联免疫吸附法试剂盒说明书操作。
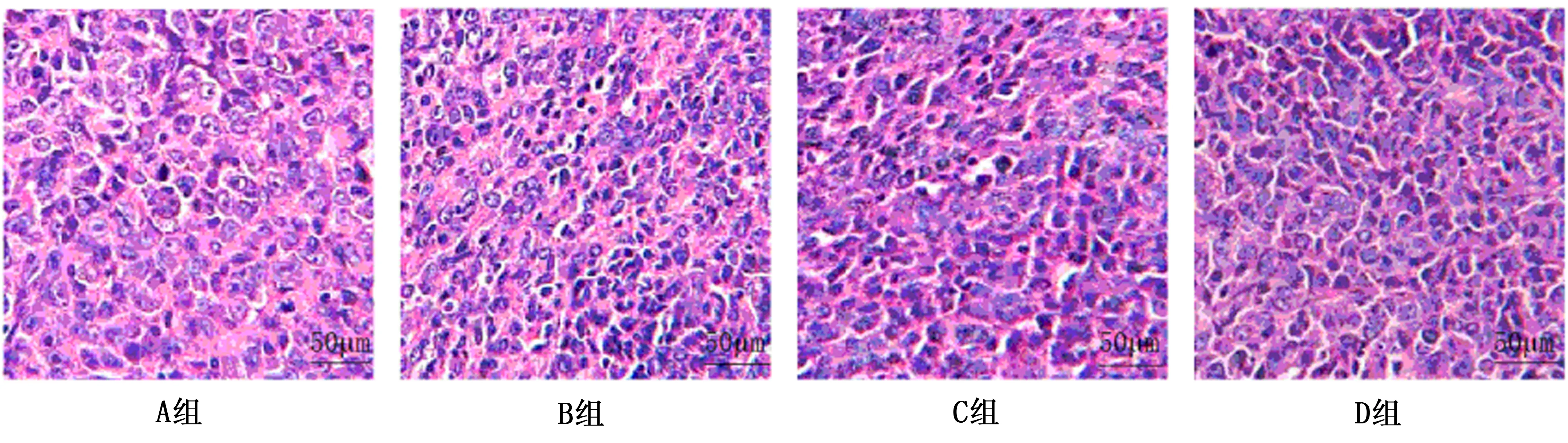
1.2.5 肿瘤组织病理形态学 采用HE染色法检测。取1份4%多聚甲醛固定肿瘤组织,生理盐水冲洗,磷酸缓冲液浸泡10 h。脱水,常规石蜡包埋,切片,厚度4 μm。展片,置于60℃烤箱内烘烤15 min,确保组织黏附在载玻片上。二甲苯脱蜡,梯度酒精脱水。苏木精液染色1 min,1%盐酸乙醇分化,流水冲洗。伊红染色1 min,蒸馏水冲洗。梯度酒精脱蜡,二甲苯透明,中性树胶封片。镜下观察肿瘤组织病理形态学变化。
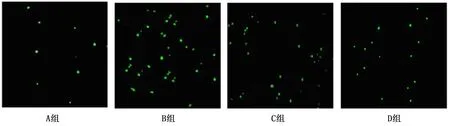
1.2.6 心肌细胞凋亡检测 采用TUNEL染色法检测。取1份4%多聚甲醛固定心脏组织,常规石蜡包埋,切片4 μm。严格按照TUNEL染色试剂盒说明书完成相关操作,显微镜400倍视野下随机选择4个视野,TUNEL染色凋亡细胞呈荧光绿色,计算细胞凋亡率(凋亡细胞数/总细胞数×100%)。
1.2.7 EGFR、CyclinD1、Bcl-2蛋白相对表达量 采用蛋白质印迹法检测。取1份液氮保存肿瘤组织,生理盐水冲洗,冰浴下制备10%匀浆。4℃,14000 r/min离心,离心半径8 cm,10 min,取上清液。BCA法行蛋白定量,以2×上样缓冲液加入,沸水浴变性,共10 min。10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转膜,5%脱脂奶粉封闭,共1 h。加兔抗小鼠EGFR、CyclinD1、Bcl-2、β-actin(1:1000)一抗,4℃摇床,孵育,过夜。TBST洗膜,每次10 min,重复4次。加二抗(1∶2500),室温孵育2 h。加入ECL发光液,胶片曝光,洗片,Image软件分析条带灰度值。以目的蛋白条带灰度值与β-actin条带灰度值比值计算蛋白表达水平。
1.3 统计学分析

2 结果
2.1 行为学变化
A组小鼠饮水量、饮食量减少,活动度减弱,且存在精神萎靡、毛发稀疏、呼吸加快、咳嗽增多、消瘦明显等症状。与A组比较,B组、C组、D组小鼠饮水量、进食量、活动度、精神状态、呼吸状态等行为学异常减轻,其中D组改善更显著。
2.2 瘤质量、抑瘤率
与A组比较,B组、C组、D组瘤质量降低,D组 表1 各组瘤质量、抑瘤率比较 与A组比较,B组、C组、D组血清cTnI、AST、CK-MB水平升高,D组 表2 各组cTnI、AST、CK-MB水平比较 HE染色显示,A组肿瘤细胞密集,呈团状分布,生长旺盛,胞浆稀少,存在坏死细胞,但无明显细胞凋亡。与A组比较,B组、C组、D组肿瘤细胞坏死、凋亡增多,体积缩小,其中D组改善更显著。见图1。 图1 各组肿瘤组织病理形态学(HE×200) 心肌细胞凋率分别为A组(2.12±1.48)%、B组(17.51±1.82)%、C组为(13.15±1.52)%、D组为(7.22±1.42)%,与A组比较,B、C、D组心肌细胞凋亡率升高,D组 图2 各组小鼠心肌细胞凋亡情况(TUNEL×400) 与A组比较,B组、C组、D组EGFR、CyclinD1蛋白相对表达量降低,且EGFR、CyclinD1蛋白相对表达量;D组 图3 各组EGFR、CyclinD1、Bcl-2蛋白表达 表3 各组EGFR、CyclinD1、Bcl-2蛋白相对表达量比较 目前,肺癌治疗以手术、放疗、化疗、生物治疗等综合疗法为主,但多数患者确诊时已处于晚期,仅可经放疗、化疗、生物治疗等保守疗法缓解病情[5]。放疗可杀灭肿瘤病灶,利于提升局部控制率,但目前临床对放疗总剂量、分割方式等选择尚无统一标准。而且,肺癌患者放疗期间,也易受心脏接受照射剂量、照射体积、接触到射线持续时间等因素影响,发生放射性心脏损伤,增加病死几率[6]。目前临床常用分割放疗模式包括常规分割放疗、超分割放疗及大分割放疗,但就其在肺癌中抑瘤作用及对放射性心脏损伤影响、机制分析仍不多。 研究发现[7],与常规分割放疗相比,超分割放疗提升放疗剂量,可增强肿瘤杀灭作用,降低肺纤维化、食管狭窄等晚期反应损伤,但就其剂量选择仍存在争议。大分割放疗是单次放疗分割剂量超过2.5 Gy的方法,在确保总放射剂量相同情况下,其放疗次数较常规分割放疗少,且可缩短肿瘤细胞加速再增殖时间,提升局部控制率,获得较高等效生物剂量[8]。李卓华[9]还发现,大分割放疗在局限性小细胞癌中的应用,可在保证治疗安全性同时,经增加剂量、缩短疗程等方式,提升肿瘤局部控制效果。本研究发现,大分割放疗后小鼠异常行为学及肿瘤组织异常病理学改变明显减轻,瘤质量降低,抑瘤率升高,提示大分割放疗对肺癌生长抑瘤作用更明显。另外,大分割放疗后小鼠血清cTnI、AST、CK-MB水平及心肌细胞凋亡率降低,这提示大分割放疗还可减轻放射性心脏损伤。 近年来,EGFR通路及靶向治疗逐渐成为肺癌研究热点之一。EGFR为原癌基因c-ErbB-1表达产物,在表皮细胞、基质细胞内广泛表达,且高表达于多种恶性肿瘤细胞中[10]。研究发现[11],经抑制EGFR受体活性,可减弱有丝分裂信号,对细胞核内CyclinD1表达产生影响,抑制肿瘤细胞生长。葛琴等[12]还发现,大分割放疗治疗局部晚期非小细胞肺癌可获得较高局部控制率,作用机制可能与抑制EGFR表达有关。另外,EGFR通路激活还可引发Bcl-2低表达,参与细胞增殖、分化、凋亡等过程[13]。Bcl-2是一种抑制凋亡基因,可提升谷胱甘肽表达,调节细胞氧化还原平衡,抑制细胞凋亡[14]。赵风利等[15]还发现,Bcl-2蛋白表达降低参与小鼠同步放化疗所致放射性心脏损伤过程,心脏损伤发生机制可能与抗凋亡蛋白Bcl-2低表达有关。这些研究均提示,肺癌治疗中肿瘤抑制效果及放射性心脏损伤发生可能与EGFR通路有关。本研究结果显示,大分割放疗后小鼠EGFR、CyclinD1蛋白相对表达量降低,Bcl-2蛋白相对表达量升高,这提示大分割放疗可抑制EGFR通路,这可能是其发挥对肺癌小鼠抑瘤作用及减轻放射性心脏损伤的机制之一。 综上所述,相较于常规分割放疗、超分割放疗,大分割放疗可提升对肺癌小鼠抑瘤作用,且可减轻放射性心脏损伤,作用机制可能与抑制EGFR通路有关。本研究不足之处在于不同分割放疗模式对肺癌抑瘤作用及放射性心脏损伤影响途径较多,本研究仅分析了经EGFR通路的作用,未就其他途径进行探讨,今后仍需进一步分析。
2.3 血清cTnI、AST、CK-MB水平

2.4 肿瘤组织病理形态学
2.5 心肌细胞凋亡
2.6 EGFR、CyclinD1、Bcl-2蛋白相对表达量


3 讨论
