幽门螺杆菌感染及IL-17与寻常型银屑病发病关系研究*
2022-07-19肖能鑫
江 凤,谭 欢,黎 斌,向 光,肖能鑫
(重庆三峡医药高等专科学校附属医院皮肤科,重庆 404000)
银屑病是一种慢性、复发性、炎症性皮肤病,其发病与遗传、感染、免疫环境等多个因素有关[1]。寻常型银屑病(PV)为皮肤科的常见病、多发病,该病呈慢性反复发作,严重影响患者生活质量。但其病因复杂且发病机制尚不明确。目前,普遍认为免疫紊乱和炎性反应是导致PV发生、发展的主要原因[2]。研究表明,白细胞介素17(IL-17)是参与银屑病发生、发展的重要炎症因子之一,其是一种强致炎因子,能促进其他细胞分泌IL-6、IL-8,进一步加重银屑病炎性反应[3]。目前,有研究表明幽门螺杆菌(Hp)感染与PV发病有关[4]。而Hp 感染可引发炎性反应,分泌IL-6、IL-8、IL-17等多种炎症因子[5]。为进一步明确Hp感染与PV的关系,探讨可能的发病机制,作者对PV患者Hp及IL-17进行检测研究。
1 资料与方法
1.1一般资料 选取本科2019年12月至2021年3月确诊的PV患者50例为PV组。其中男40例,女10例;年龄18~70岁,平均(43.00±12.79)岁,PV病程3个月至20年。另选取同期本院的健康体检者50例为对照组,其中男38例,女12例;年龄18~70岁,平均(44.00±11.45)岁。两组对象性别、年龄比较,差异均无统计学意义(P>0.05)。基线资料具有可比性。纳入标准:(1)符合PV的诊断;(2)年龄18~70岁;(3)无心肝肾等重要器官疾病;(4)近6个月内未服用铋剂,近1个月内未服用抗生素及免疫抑制药物治疗,近3个月内未使用生物制剂治疗。排除标准:(1)孕妇及哺乳期妇女;(2)精神疾病患者;(3)严重心、肝、肾疾病患者;(4)年龄小于18岁患者。本研究已获医院医学伦理委员会审核批准,研究对象均知情同意。
1.2方法
1.2.1Hp检测 对入选的研究对象进行Hp检测。采取14C尿素呼气试验,用凉开水送服1粒含标准剂量14C尿素胶囊,安静休息25 min后,对准气卡,力度适中地吹气(严禁倒吸),当集气卡指示窗内指示剂由橙红色变成黄色或超过3 min变色不全时停止吹气。集气完毕后将集气卡插入测量室中测定14C的放射性活度(CPM),测试时间250 s。CPM≥50判定为Hp(+);CPM<50判定为Hp(-)。
1.2.2血清IL-17检测 按Hp检测结果将PV组患者及对照组受试者分为HP(+)、HP(-)PV组及HP(+)、HP(-)对照组,同时检测各组血清中IL-17水平。所有受试者于清晨空腹抽取肘静脉血10 mL,以2 000 r/min离心5 min,取血清置-20 ℃条件保存待检,采用ELISA检测血清IL-17水平。试剂盒购自武汉博士德生物公司,严格按照试剂盒说明书进行操作。
1.2.3银屑病面积与严重性指数(PASI)评分[1,6]对HP(+)、HP(-)PV患者进行PASI评分:包括皮损面积评分和皮损严重程度评分。皮损面积评分:分为头颈部、上肢、躯干和下肢4个部位,分别记0~6分。0分=无皮疹,1分<10%,2分=10%~<30%,3分=30%~<50%,4分=50%~<70%,5分=70%~<90%,6分=90%~100%。皮损严重程度评分:按照红斑(E)、浸润(I)、鳞屑(D)、皮损面积(A)4个皮损特点,每个皮损特点用0~4分进行评价[1]:0分=无,1分=轻度,2分=中度,3分=重度,4分=极重度。公式计算各躯体部位分值,再累加得到总分0~72分。PASI评分=(E头+I头+D头)×A头×0.1+(E上肢+I上肢+D上肢)×A上肢×0.2+(E躯干+I躯干+D躯干)×A躯干×0.3+(E下肢+I下肢+D下肢)×A下肢×0.4。
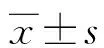
2 结 果
2.1PV组与对照组Hp感染情况比较 PV组患者中32例(64.0%)Hp(+),对照组中22例(44.0%)Hp(+),两组间比较,差异有统计学意义(χ2=4.062,P<0.05)。见表1。
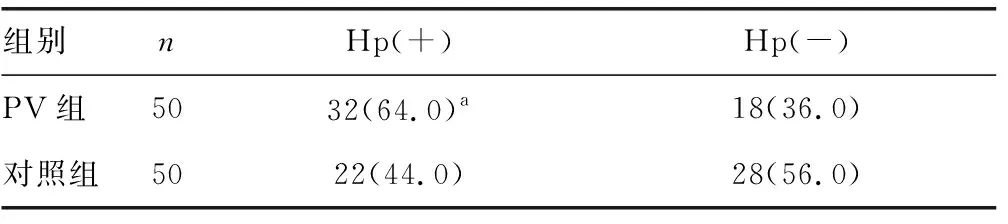
表1 PV组与对照组Hp感染情况比较[n(%)]
2.2Hp(+)、Hp(-)对照组与Hp(+)、Hp(-)PV组血清IL-17水平及PASI评分比较 Hp(+)PV组患者血清IL-17水平高于Hp(+)对照组及Hp(-)PV组,Hp(-)PV组血清IL-17水平高于Hp(-)对照组,差异均有统计学意义(t=3.54、2.21、2.99,P<0.05)。Hp(+)PV组PASI评分与Hp(-)PV组比较,差异无统计学意义(t=1.08,P>0.05)。见表2。
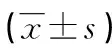
表2 Hp(+)、Hp(-)对照组与Hp(+)、Hp(-)PV组血清IL-17水平及PASI评分比较
3 讨 论
银屑病是一种慢性复发性炎症性皮肤病。T细胞为主浸润及多种炎症因子参与,是其主要发病机制。PV为银屑病中最常见的类型,主要表现为全身或局部红色丘疹、斑块,上覆白色鳞屑,奧氏征(Auspitz sign)阳性。PV可分为三期:进行期、静止期和退行期。银屑病反复发作,常冬重夏轻,可持续数十年甚至终身。大量的研究表明银屑病与Th17密切相关。银屑病患者血液中Th17细胞表达升高[7],在银屑病皮损及血清中IL-8、IL-17等炎症因子的表达水平明显升高[8-9]。IL-17作为一种强致炎因子,能促进中性粒细胞趋化,并诱导血管内皮细胞因子生成及促进IL-6、IL-8等产生,促进银屑病的发生、发展。目前,全球治疗PV的生物制剂中,IL-17单抗可选择性结合人IL-17A,并中和该细胞因子的生物活性,从而显著改善和消退银屑病皮损[10-11],证实了IL-17在银屑病发生、发展中的重要作用。
Hp是人群中常见的胃肠道感染菌。大量研究证实,Hp与慢性胃炎、消化性溃疡、胃癌等疾病密切相关。Hp定植胃肠道黏膜,可释放多种炎症因子,并诱发一系列免疫反应,参与消化系统以外器官、系统的疾病的发生、发展。目前与Hp有关的皮肤病包括慢性荨麻疹等[12]。吴佳纹等[13]研究表明,银屑病患者Hp阳性感染率为73.17%,进行期、静止期HP阳性感染率高于退行期。提示Hp感染可能为银屑病发病的原因之一,并推测Hp可能通过诱导IL-8,从而促进银屑病的发生、发展。严萍等[14]通过Hp感染小鼠模型的研究发现,Hp感染后21、28 d小鼠脾脏Th17细胞较正常组明显升高,模型小鼠胃黏膜IL-17水平明显升高,Th17细胞及IL-17可能参与了Hp感染的免疫反应。有研究表明,Hp阳性的慢性胃炎患者及Hp阳性慢性荨麻疹患者血清IL-17水平明显升高[12-13],随着胃炎炎症程度逐渐加重而逐渐升高,通过有效抗Hp治疗后,IL-17水平明显下降[15]。本研究通过对PV患者及健康体检者进行Hp检测,发现PV患者Hp感染率(64.0%)明显高于健康体检者(44.0%),与吴佳纹等[13]研究结果相同,提示Hp感染可能参与PV发病。同时本研究检测了Hp(+)、Hp(-)对照组及Hp(+)、Hp(-)PV组血清IL-17水平。结果表明,Hp(+)、Hp(-)PV组血清IL-17水平均分别明显高于Hp(+)、Hp(-)对照组;Hp(+)PV组血清IL-17水平明显高于Hp(-)PV组。结果提示健康人群Hp感染后其血清IL-17水平明显升高,而IL-17是PV重要的发病因子,PV患者感染Hp后,可能通过诱导IL-17进一步升高而参与、促进PV的发生、发展。本研究因疫情影响,时间仓促,样本量较小,PV患者感染Hp后的IL-17水平检测仍需扩大样本,进一步评估完善,并通过抗Hp治疗等研究,进一步评估和确定Hp感染可能通过诱导IL-17水平的升高而促进PV的发生、发展的机制。
