黏惰化及酸敏感修饰对纳米粒子黏膜穿透的影响
2022-07-18姬发刘玲余林玲孙彦
姬发, 刘玲, 余林玲,2, 孙彦,2
黏惰化及酸敏感修饰对纳米粒子黏膜穿透的影响
姬发1, 刘玲1, 余林玲1,2, 孙彦1,2
(1. 天津大学化工学院生物化工系, 2. 教育部合成生物工程重点实验室, 天津 300350)
使用纳米粒子进行疾病的诊断和治疗是当前研究的一个热点. 由于受到黏液层的阻碍, 纳米粒子对于黏膜上皮细胞的进入效果不佳, 从而限制了其对黏膜相关疾病的诊断和治疗. 本文设计合成了一种具有黏惰性的酸敏感纳米粒子(MSNs-pCBMA-DMMA), 可有效穿透黏液层进入黏膜上皮细胞. 首先采用溶胶-凝胶法合成了表面氨基化的介孔二氧化硅纳米粒子(MSNs-NH2), 然后通过原子转移自由基聚合法(ATRP)使两性离子羧基甜菜碱甲基丙烯酸酯(CBMA)在MSNs-NH2表面上聚合形成聚羧基甜菜碱甲基丙烯酸酯(pCBMA), 获得惰性化的粒子(MSNs-pCBMA), 最后将酸响应性分子2,3-二甲基马来酸酐(DMMA)修饰于MSNs-pCBMA表面, 制备了MSNs-pCBMA-DMMA. 场发射透射电子显微镜(TEM)、 傅里叶红外光谱(FTIR)、 氢核磁共振波谱(1H NMR)和纳米粒度电位测定仪等分析结果表明, 合成了MSNs-pCBMA-DMMA, 且粒子表面电位随pH值降低显著增加, 在pH=7.4~5.7范围内具有酸敏感能力. Transwell®小室实验表明, pCBMA的接枝提高了粒子在模拟黏液中的渗透速率, 而DMMA的修饰则进一步增强了粒子的扩散能力, 4 h内MSNs-pCBMA-DMMA的模拟黏液渗透率达到16.3%, 为MSNs-pCBMA的1.9倍, MSNs-NH2的3倍, 而以MSNs-NH2的表观渗透系数(app)为标准计算得到的MSNs-pCBMA-DMMA的相对表观渗透系数达到了2.96. 细胞毒性试验验证MSNs-pCBMA-DMMA粒子的生物安全性良好. 细胞摄取试验表明, 相比于其它粒子MSNs-pCBMA-DMMA能够更快的被黏膜上皮细胞摄取. 本文所构建的纳米粒子能够快速渗透黏液且易于被黏膜上皮细胞摄取, 为其应用于黏膜相关疾病的活体诊断和治疗提供了基础.
纳米粒子; 两性离子聚合物; 扩散; 细胞摄取; 黏膜渗透
介孔二氧化硅纳米粒子因其尺寸小、 易功能化修饰和良好的生物相容性而成为肿瘤诊断和治疗的一种新方式[1~3]. 黏膜细胞参与构成人体内的多种组织和器官, 因此其涉及到包括口腔癌、 胃癌和宫颈癌等十分庞大的疾病种类和数量[4,5]. 黏膜细胞上方覆盖着由黏蛋白、 水、 无机盐、 多肽、 细菌以及上皮细胞碎片[6]等物质组成的黏弹性黏液层[7], 可以黏附并清除病原微生物, 形成了人体重要的生理屏障——黏液屏障. 然而, 黏液层也会通过静电或疏水作用黏附外来粒子使其滞留其中, 从而限制了纳米粒子参与的与黏膜上皮细胞相关疾病的诊断和治疗[8,9]. 因此, 突破黏液层对纳米粒子的黏附作用并保障黏膜上皮细胞对纳米粒子的高效摄取是提升用于疾病诊断和治疗的纳米粒子的应用能力的主要难点.
黏液穿透粒子(MPP)是降低黏液黏附效应的一种可行手段, MPP具有亲水性和电中性表面, 能够穿透黏液屏障并在黏膜上皮细胞表面积累[10,11]. 一般通过在纳米粒子上修饰亲水性和电中性的材料可以制得MPP. 其中, 聚乙二醇(PEG)及其共聚物[12~17]是最常见的修饰材料, 可有效制备MPP; 但PEG等修饰材料易自氧化, 且热稳定性差[18,19], 限制了粒子的实际应用效果. 近年来, 含有高亲水性阴阳离子基团的两性离子聚合物(ZI)成为备受关注的一类抗蛋白吸附材料[20,21]. 其中, 聚羧基甜菜碱甲基丙烯酸酯(pCBMA)内部基团稳定性强, 易于进行多种修饰[22], 而且具有电中性强亲水表面能够降低黏液黏附效应, 可作为一种优良的黏惰性修饰材料.
纳米粒子的电中性强亲水表面在加快黏液层穿透的同时也会减弱其与黏膜上皮细胞之间的相互作用, 从而影响纳米粒子的细胞摄取效果[23]. 带正电的纳米粒子可与带负电的细胞膜发生静电吸引作用, 与不带电以及带负电的粒子相比, 更容易接近细胞加速细胞摄取[24]. 鉴于人体中大部分黏液层环境呈弱酸性, 为纳米粒子通过酸敏感分子修饰实现pH响应过程提供了可能. 2,3-二甲基马来酸酐 (2,3-Dimethylmaleic anhydride, DMMA)是一种良好的酸敏感分子, 与结构类似的酸敏感分子丁二酸酐、 顺式环己烯-1,2-二甲酸酐和顺式乌头酸酐相比, 在相同酸性pH下DMMA的响应速率最高[25]. 因此, 将DMMA通过酰胺键与纳米粒子表面的原位氨基相连, 在黏液的弱酸性环境中DMMA通过pH响应断裂引起纳米粒子表面原位氨基暴露, 从而使纳米粒子表面呈现正电荷, 更容易接近细胞加速细胞摄取[26,27].
本文针对纳米粒子进入黏膜上皮细胞进行疾病治疗和诊断的两个关键过程——黏液层的快速穿透和黏膜上皮细胞的有效进入提出了一种新策略(Scheme 1). 先将黏液惰性材料pCBMA接枝到表面氨基化的介孔二氧化硅纳米粒子(MSNs-NH2)上形成惰性化纳米粒子(MSNs-pCBMA), 再将酸敏感分子 DMMA与MSNs-pCBMA表面未反应的原位氨基相连, 制备了具有黏液惰性的酸敏感纳米粒子 MSNs-pCBMA-DMMA. 以DMMA直接修饰的介孔二氧化硅纳米粒子(MSNs-DMMA)为对照, 通过体外黏液穿透实验和细胞实验考察了MSNs-pCBMA-DMMA的黏液渗透能力和细胞摄取效果. 本文研究结果有助于纳米粒子在黏膜系统疾病的诊断和治疗中的应用.

Scheme 1Schematic of pH⁃responsive mucus⁃inert nanoparticles MSNs⁃pCBMA⁃DMMA
1 实验部分
1.1 试剂与仪器
盐酸(分析纯)、 乙二胺四乙酸二钠(EDTA-2Na, 分析纯)和大豆卵磷脂(纯度98%), 天津市光复精细化工研究所; 硫酸(H2SO4, 分析纯)、 过氧化氢(H2O2)和三乙胺(TEA)均为分析纯, 天津市江天化工技术有限公司;,二甲基甲酰胺(DMF), 优级纯, 天津市元立化工有限公司; 溴化铜(CuBr2), 分析纯, 天津市风船化学试剂科技有限公司; 溴化亚铜(CuBr), 分析纯, 上海润捷化学试剂有限公司; 2,2-联吡啶(Bpy), 分析纯, 北京鼎国生物科技有限公司; 异硫氰酸荧光素(FITC), 纯度90%, 沈阳联星生物技术有限公司; 正硅酸四乙酯(TEOS, 纯度99.9%), 阿法埃莎化学有限公司(Alfa Aesar); 3-氨丙基三乙氧基硅烷(APTES, 纯度98%)、-溴异丁酰溴(BIBB, 分析纯)、-丙内酯(纯度98%)、 十六烷基三甲基溴化铵(CTAB, 纯度99%)、 甲基丙烯酸 2-(二甲氨基)乙酯(DMAEMA, 纯度98%)、 噻唑蓝(MTT, 纯度99%)和牛血清白蛋白(BSA, 纯度96%), 美国西格玛奥德里奇公司(Sigma-Aldrich); 猪胃黏蛋白, 98%, 上海源叶生物科技有限公司.
聚碳酯膜(PC)Transwell®嵌套(6.5 mm, 3 μm), 美国Corning Incorporated公司; JEM-2100F型场发射透射电子显微镜(TEM), 日本JEOL公司; Spectrum 100型傅里叶红外光谱(FTIR), 美国Perkin Elmer公司; 2000U型纳米粒度电位测定仪, 英国Malvern公司; INFINITE M NANO+型酶标仪, 瑞士Tecan公司; TE2000-U型倒置荧光显微镜, 日本NIKON公司; Varian Unity Inova 500 MHz核磁共振光谱仪, 美国Varian公司.
1.2 实验过程
1.2.1MSNs-NH2的制备利用溶胶-凝胶法制备表面氨基化介孔二氧化硅纳米粒子MSNs-NH2[28]. 将750 mg CTAB溶于去离子水中, 加入210 mg NaOH, 在80 ℃下, 依次加入3.75 mL TEOS与0.75 mL APTES, 反应2 h; 产物经洗涤后转移至三口烧瓶中, 依次加入120 mL乙醇与15 mL浓盐酸, 回流2 h去除模板剂CTAB, 洗涤后得到MSNs-NH2粒子, 置于真空冷冻干燥机中干燥24 h.
1.2.2 两性离子聚合物pCBMA的接枝 利用叔胺基团和羧酸内酯的开环反应合成CBMA单体[29]. 将1.68 mL DMAEMA加入到25 mL无水丙酮中, 冰浴下通入氮气, 得到A溶液; 将0.76 mL-丙内酯加入到5 mL无水丙酮中, 得到B溶液. 在持续通入氮气的条件下, 将B溶液逐滴加入到A溶液中; 然后将反应容器密封并移至15 ℃空气摇床反应5 h; 产物用无水丙酮与无水乙醚洗涤, 使用真空泵将产物干燥2 h并封存于4 ℃冰箱中备用. 通过原子转移自由基聚合法(ATRP)将pCBMA接枝到MSNs-NH2表面[30]. 将300 mg MSNs-NH2, 50 mL DMF与2.4 mL TEA混合, 将5 mL DMF和200 μL BIBB加入到恒压滴定漏斗中, 在冰水浴条件下逐滴加入到MSNs-NH2的混合悬浊液中, 以240 r/min转速反应2 h; 然后转移至30 ℃恒温水浴中持续反应18 h; 反应结束后分别用DMF、 无水乙醇和去离子水洗涤产物, 所得溴化粒子记为MSNs-Br, 并分散于体积分数为20%的乙醇水溶液中, 于4 ℃保存备用. 将200 mg MSNs-Br加入20 mL DMF与水的混合溶液(体积比为1∶1)中, 再依次加入227 mg CBMA单体、 1.34 mg CuBr2和9.37 mg Bpy; 向反应体系中通入氮气除去体系中的氧气, 然后将4.31 mg CuBr加入到反应体系中, 持续反应3 h; 停止通氮气, 并将反应体系暴露于空气中, 待溴化亚铜被空气中的氧气氧化完成, 终止反应; 用0.1 mol/L EDTA-2Na溶液、 无水乙醇和去离子水洗涤产物. 经真空冷冻干燥后得到pCBMA接枝的介孔二氧化硅纳米粒子MSNs-pCBMA.
1.2.3 酸敏感分子DMMA的修饰 参照文献[31]方法, 将DMMA修饰到纳米粒子的氨基上. 将 MSNs-NH2和MSNs-pCBMA各100 mg分散于去离子水中, 用1 mol/L NaOH溶液调节反应体系pH值使其稳定在8.5; 然后各加入100 mg DMMA, 混合均匀后于常温下反应6 h, 收集固体产物, 用pH=8.5的去离子水清洗3遍, 经真空冷冻干燥得到MSNs-DMMA和MSNs-pCBMA-DMMA.
1.2.4 黏液渗透实验 将1800 mg部分纯化的猪肠胃黏蛋白、 96 mg卵磷脂和960 mg BSA溶解于30 mL HEPES(20 mmol/L, pH=7.4)缓冲液中, 用1 mol/L NaOH溶液调节溶液pH值至6.5, 在4 ℃摇床中孵育48 h, 作为模拟黏液[32]. 对纳米粒子进行荧光标记[33], 将FITC标记的APTES分别与MSNs-NH2, MSNs-pCBMA, MSNs-DMMA和MSNs-pCBMA-DMMA混合, 在避光条件下合成荧光粒子, 在特定波长(490 nm)光源的激发下可以呈现出荧光信号. 采用Transwell®嵌套板对4种纳米粒子在模拟黏液中的渗透性能进行表征[34]. 将20 μL黏液充分铺展在Transwell®嵌套板的A室中并加入FITC标记的纳米粒子(100 μg/mL) 200 μL, B室中加入HEPES(20 mmol/L, pH=6.5)缓冲液600 μL, 放入37 ℃保温箱中避光孵育. 定时(0.5, 1, 1.5, 2, 3, 4 h)从B室取样100 μL, 并补加相同体积的缓冲液, 使用酶标仪测定取出样品的荧光强度, 利用下式计算粒子透过率(, %):

式中:0为空白对照的荧光强度;1为待测样品荧光强度;c为标准样品荧光强度.粒子相应的表观渗透系数(app, cm/s)用下式计算, 并以MSNs-NH2的app为标准计算相对表观渗透系数:
式中: d/d(mg/s)为粒子透过黏液的速率;0(μg/mL)为粒子的初始浓度,(cm2)为Transwell®嵌套板中半透膜的面积.
1.2.5 细胞安全性实验 以人肺腺癌细胞(Calu-3细胞系)作为模型细胞, 培养基选择MEM(含NEAA), 其中包含体积分数为10%的胎牛血清(FBS)和体积分数为1%的青霉素-链霉素. 将细胞在37 ℃, CO2浓度为5%的环境中孵育. 采用噻唑蓝(MTT)比色法对粒子的细胞毒性进行表征[35]. 将细胞培养至对数生长期, 用杜氏磷酸盐缓冲液(DPBS)制成单细胞悬液加入到96孔板中, 每孔加入80 μL细胞悬液(5×103个/孔), 培养24 h. 向孔板中加入20 μL不同浓度(10, 50和100 μg/mL)的4种纳米粒子, 而对照组则加入20 μL的DPBS缓冲液, 继续培养24 h. 利用无菌DPBS配制5.5 mg/mL的MTT溶液. 培养板每孔加入10 μL MTT溶液, 培养一定时间. 将培养物离心后除去上清液, 加入100 μL二甲基亚砜(DMSO), 在37 ℃摇床中振摇以充分溶解蓝紫色甲瓒晶体. 利用酶标仪测定溶液在570 nm处的吸光度, 以对照组存活率为100%, 计算细胞活性的平均值.
1.2.6 细胞摄取实验 利用荧光显微镜对荧光标记的细胞与一种纳米粒子进行观察. 将2 mL Calu-3单细胞悬液(1×105个/孔)加入到6孔细胞培养板中培养48 h. 将1 mL荧光标记的纳米粒子 溶液(50 μg/mL)加入到孔中培养4 h; 将孔板中液体吸出, 用DPBS缓冲液冲洗后, 向每个孔中加入 1 mL Hoechst 33258染色液(5 μg/mL), 孵育30 min后用DPBS缓冲液冲洗, 利用荧光显微镜进行检查[36].
2 结果与讨论
2.1 纳米粒子的制备与表征
首先利用TEM观察了合成的4种纳米粒子MSNs-NH2, MSNs-pCBMA, MSNs-DMMA和MSNs- pCBMA-DMMA的形貌和尺寸, 结果如图1所示. TEM图像显示, 4种纳米粒子均呈现球型或椭球型, 粒径均约为100 nm. 由图1(A)~1(D)可以看出, 与MSNs-NH2相比, MSNs-pCBMA-DMMA粒径没有明显变化, 这是由于TEM表征过程中粒子处于干燥状态, 接枝的pCBMA聚合物链不能充分伸展而造成的. 由图1(E)可以看出, 二氧化硅纳米粒子具有明显的介孔结构, 与文献[37]报道一致, 表明这4种纳米粒子均具备较高的药物负载能力[38]. 为了更好地表征聚合物接枝层, 对粒子进行了染色[图1(F)和图1(G)]. 可以看出, 与MSNs-NH2相比, MSNs-pCBMA上存在聚合物层, 证明pCBMA连接成功. 此外, 利用DLS测量MSNs-NH2, MSNs-pCBMA,MSNs-DMMA和MSNs-pCBMA-DMMA在溶液中的水合粒径, 分别为(205.8±22), (313.2±7), (200.1±15)和(307.0±12)nm. MSNs-NH2与MSNs-DMMA几乎一致, 而接枝修饰pCBMA聚合物链后的粒子MSNs-pCBMA和MSNs-pCBMA-DMMA几乎一致, 且均高于MSNs-NH2与MSNs -DMMA, 表明DMMA修饰几乎不影响粒子的水合粒径, 而pCBMA聚合物链修饰则明显增加了粒径. 由于DLS测量的是溶液中的粒子的水合粒径, 不同于干燥状态的粒子, 因而与TEM测得的粒径结果存在差异.

Fig.1 TEM images ofMSNs⁃NH2(A, E, F), MSNs⁃pCBMA(B, G), MSNs⁃DMMA(C) and MSNs⁃pCBMA⁃DMMA(D)
(E) Amplified MSNs-NH2; (F) MSNs-NH2by negative staining; (G) MSNs-pCBMA by negative staining.
实验中通过叔胺基团和羧酸内酯的开环反应制得黏惰性材料pCBMA的单体CBMA, 并测定了 CBMA的1H NMR光谱,:1.78(s, 3H, dCH3), 2.57(t, 2H, CH2COO), 3.04(s, 6H, NCH3), 3.53(t, 2H, NCH2), 3.64(t, 2H, CH2N), 4.49(t, 2H, OCH2), 5.61(s, 1H, dCH), 6.00(s, 1H, dCH), 证明CBMA制备成功.
将CBMA单体修饰在MSNs-NH2上得到MSNs-pCBMA, 然后以MSNs-NH2和MSNs-pCBMA为基础进一步修饰酸敏感分子DMMA, 分别制备MSNs-DMMA和MSNs-pCBMA-DMMA. 利用FTIR对MSNs-NH2, MSNs-pCBMA, MSNs-DMMA及MSNs-pCBMA-DMMA进行了结构分析. 由图2可见, 4种纳米粒子都出现了数个明显的特征峰, 其中1095 cm-1处为Si—O—Si的不对称伸缩振动吸收峰, 950 cm-1处为Si—OH的弯曲振动吸收峰, 799和467 cm-1处为Si—O的对称伸缩振动峰和弯曲振动峰. MSNs-pCBMA和MSNs-pCBMA-DMMA在1730 cm-1处出现聚合物的C=O伸缩振动峰, 同时在1480和1380 cm-1处出现两性离子聚合物的C—N和C—H伸缩振动峰[39]. MSNs-DMMA和MSNs-pCBMA-DMMA在1700 cm-1处出现了特征峰, 该峰为DMMA的C=C特征峰. 1730, 1480和1380 cm-1处出现的特征峰表明MSNs-pCBMA和MSNs-pCBMA-DMMA上已接枝pCBMA, 而1700 cm-1处 DMMA的C=C特征峰证明MSNs-DMMA和MSNs-pCBMA-DMMA上修饰DMMA成功.
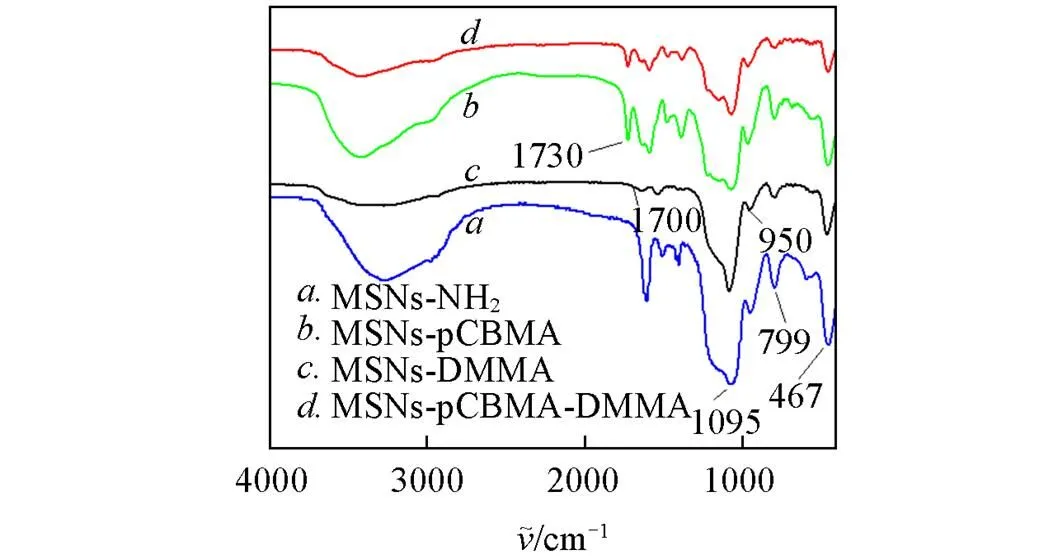
Fig.2 FTIR spectra of four nanoparticles
2.2 纳米粒子的表面电荷分析
选取3个不同的pH值(7.4, 6.5和5.7)作为变量研究了酸敏感分子DMMA修饰的MSNs-DMMA和MSNs-pCBMA-DMMA的表面电势随pH值的变化情况[27], 结果如图3所示.
由图3可见, 在pH=7.4时, DMMA稳定, MSNs-DMMA上的DMMA用羧酸基团取代了粒子表面部分氨基, 使得粒子总体呈现出明显区别于MSNs-NH2的负电位(-11.6 mV+17.6 mV), 而MSNs-pCBMA由于接枝了电中性的pCBMA, 其电势值(+10.16 mV)与MSNs-NH2相比明显下降. 在MSNs-pCBMA-DMMA中pCBMA取代了粒子表面的部分氨基, DMMA的修饰量小, 其电势值为+6.8 mV, 高于MSNs-DMMA粒子同时低于未修饰DMMA的MSNs-pCBMA粒子, 再次证明了DMMA修饰成功. 尽管在中性条件(pH=7.4)下, 2种酸敏感粒子MSNs-DMMA和MSNs-pCBMA-DMMA的电荷性质不同(-11.6 mV+6.8 mV), 但后者的净电荷量更小, 更偏电中性, 将有利于粒子在黏液中的渗透.
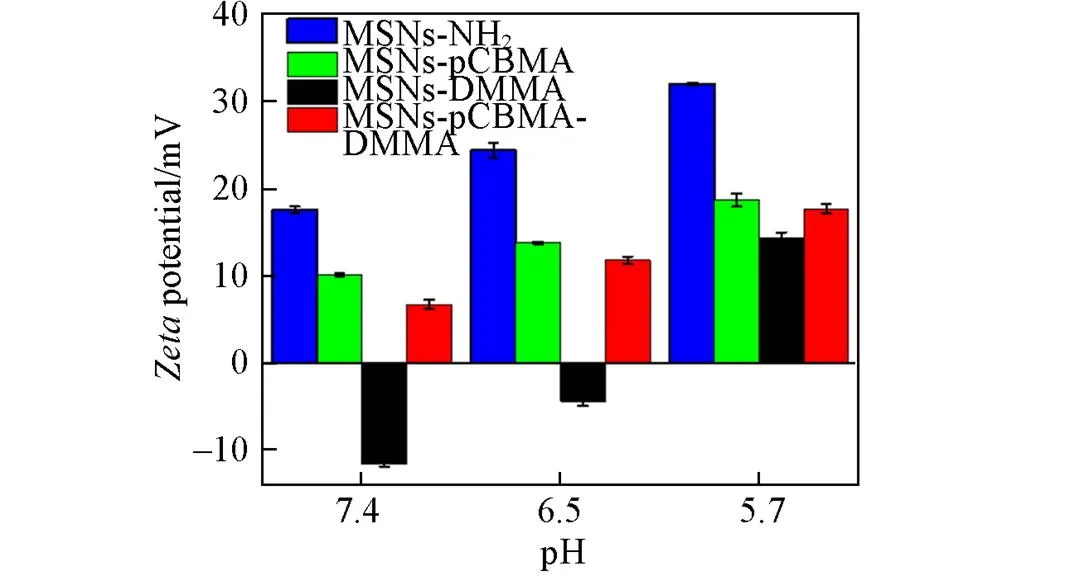
Fig.3 Zeta⁃potentials of four nanoparticles at 37 ℃at pH of 7.4, 6.8 and 5.7 in 0.02 mol/L HEPES buffer
在pH=6.5时, 粒子表面的DMMA部分脱离使得表面氨基暴露, MSNs-DMMA和MSNs-pCBMA- DMMA的电势都明显升高(电势升高量分别为+7.36和+5.05 mV), 且略高于相应对照组MSNs-NH2和MSNs-pCBMA的电势升高量(+6.83和+4.67 mV), 说明在此阶段DMMA的脱离量较少; 但在pH=5.7时, DMMA脱离量增加, MSNs-DMMA的电势升高值明显高于MSNs-NH2(电势升高量分别为+18.69和 +7.6 mV), 而MSNs-pCBMA-DMMA的上升幅度也略高于MSNs-pCBMA的上升幅度(电势升高量分别为+5.93和+3.90 mV), 但由于其DMMA的修饰量小于MSNs-DMMA, 所以电势上升低于MSNs- DMMA. 由此可以看出, 在pH值由7.4变化为5.7的过程中, MSNs-DMMA和MSNs-pCBMA-DMMA的电势相比于对照组均表现出更强的随pH降低而上升的趋势, 证明了DMMA修饰的2种纳米粒子MSNs-DMMA和MSNs-pCBMA-DMMA具有在pH=7.4~5.7范围内的响应能力.
当pH值从7.4变为6.5时, MSNs-pCBMA-DMMA由带有极少的电荷(+6.8 mV)转变为带有较多的正电荷(+11.8 mV), 证明了pH响应的高效性, 并符合本文预期设计(粒子几乎不带电以利于透过黏液层, 在透过黏液层后电荷转变为正电, 有利于与黏膜上皮细胞作用被摄取). 当pH值从7.4变为6.5时, MSNs-DMMA由带有较多的负电(-11.6 mV)转变为几乎不带电荷(-4.4 mV), 对其与黏液上皮细胞作用并没有优势, 只有当pH进一步下降到5.7时, 才转变为具有较高的正电荷(+14.3 mV), 可与黏膜上皮细胞作用, 因此其pH应用范围低于MSNs-pCBMA-DMMA. 本文获得的MSNs-DMMA在pH值从7.4变为6.5时, 电势升高量高达7.36 mV, 而文献[40]报道的DMMA修饰的介孔二氧化硅纳米粒子在此范围内电势变化低于5 mV, 表明合成的MSNs-DMMA具有极强的pH响应能力.
2.3 黏液渗透实验
以含猪肠胃黏蛋白(Ⅱ型)、 卵磷脂和牛血清白蛋白(BSA)的溶液(pH=6.5)为模拟黏液, 利用 Transwell®小室建立体外模拟黏液层模型, 研究了粒子在黏液中的渗透能力, 由图4和图5所示. 可见, 在4 h时, MSNs-NH2, MSNs-pCBMA, MSNs-DMMA和MSNs-pCBMA-DMMA的渗透率分别为5.5%, 8.4%, 5.8%和16.3%. 以MSNs-NH2的app为标准计算相对表观渗透系数, MSNs-pCBMA, MSNs- DMMA和MSNs-pCBMA-DMMA的相对表观渗透系数依次为1.52, 1.06和2.96.
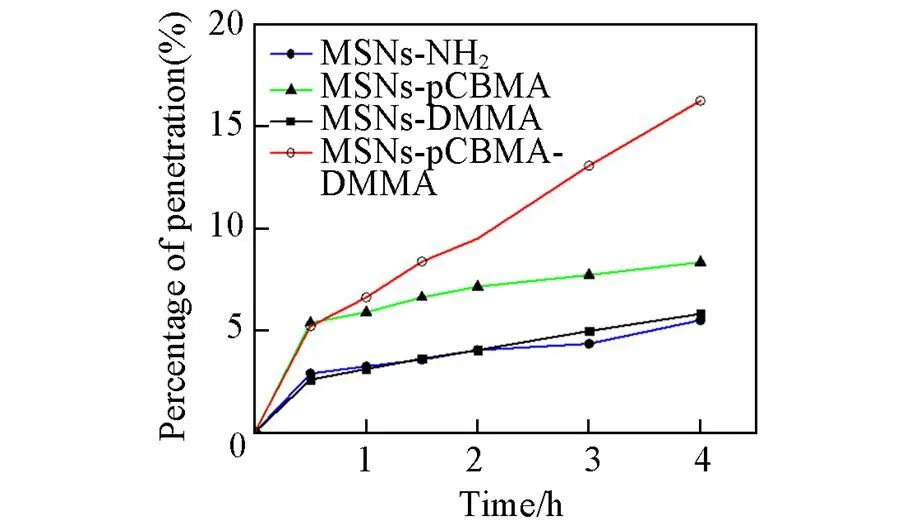
Fig.4 Mucus penetration of four nanoparticles obtained by a mucus⁃containing Transwell® model

Fig.5 Relative apparent permeability coefficients of four nanoparticles across the mucus
a. MSNs-NH2; b. MSNs-pCBMA; c. MSNs-DMMA; d. MSNs-pCBMA-DMMA. *<0.05, **<0.01MSNs-NH2.
根据图4和图5结果可知, MSNs-DMMA粒子的渗透效果与MSNs-NH2无明显区别, 且均低于pCBMA接枝后的MSNs-pCBMA和MSNs-pCBMA-DMMA. 这是由于尽管DMMA取代了MSNs-NH2表面的部分氨基, 使得MSNs-DMMA粒子几乎不带电(pH=6.5, -4.4 mV, 图3), 但介孔二氧化硅表面还有大量疏水性基团可以与黏液中多种蛋白发生黏附作用, 从而被黏液滞留, 不利于渗透.
相比之下, 聚合物pCBMA可以吸附水分子在粒子表面形成较强的水化层抵抗黏液中黏蛋白的黏附, 同时还取代了MSNs-NH2粒子表面部分氨基降低了MSNs-pCBMA粒子电势(pH=6.5, +14.86 mV+24.43 mV, 图3), 因此MSNs-pCBMA的渗透率比未黏惰性修饰的MSNs-NH2高. 值得注意的是, MSNs-pCBMA-DMMA的相对表观渗透系数最大, 且在4 h内模拟黏液渗透率达到16.3%, 为MSNs- pCBMA的1.9倍, MSNs-NH2的3倍. 除了pCBMA接枝黏惰化的贡献外, DMMA修饰也发挥了重要作用. pCBMA的接枝降低了粒子表面原位氨基数量, 因而较少量的DMMA修饰即可对MSNs-pCBMA-DMMA的电势产生影响(pH=6.5, +14.86 mV+11.80 mV, 图3), 在粒子刚加入模拟黏液中时, 粒子表面电势接近中性(pH=7.4, +6.8 mV, 图3), 降低了黏蛋白的黏附作用, 利于黏液穿透. 实验结果表明, 黏惰性材料pCBMA的接枝和酸敏感分子DMMA的修饰能够有效提升介孔二氧化硅纳米粒子的黏液穿透能力, 并且两者缺一不可. 此外, MSNs-pCBMA-DMMA粒子在黏液中的表观渗透系数为2.06×10-5cm/s, 是文献[41]报道的乳清蛋白纳米颗粒在黏液中的表观渗透系数的2.5倍. 这证明所合成的MSNs-pCBMA-DMMA粒子具有强大的黏液穿透能力.
2.4 细胞毒性实验
以产黏液的人肺腺癌细胞Calu-3为模型细胞, 利用MTT法评估了纳米粒子的细胞毒性. 将不同浓度(10, 50和100 μg/mL)的MSNs-NH2, MSNs-pCBMA, MSNs-DMMA和MSNs-pCBMA-DMMA分别与 Calu-3细胞共培养24 h, 统计共培养前后细胞数量变化以考察纳米粒子对Calu-3细胞的毒性. 由图6可见, 10, 50和100 μg/mL的MSNs-NH2与Calu-3细胞共培养后, 细胞存活率分别为92.5%, 84.0%和77.4%, MSNs-pCBMA相应的细胞存活率为93.2%, 90.0%和88.9%. 用10, 50和100 μg/mL的MSNs-DMMA粒子处理细胞后, 细胞的存活率分别为85.7%, 78.1%和69.3%; 而MSNs-pCBMA-DMMA相应的细胞存活率为94.0%, 87.3%和78.3%. 根据Calu-3细胞的细胞存活率数据, DMMA修饰的纳米粒子对Calu-3细胞的毒性高于未修饰的粒子, 表明DMMA对Calu-3细胞有一定的毒性. 而在相同浓度下, pCBMA修饰的MSNs-pCBMA, MSNs-pCBMA-DMMA相比于MSNs-NH2, MSNs-DMMA毒性更小, 说明pCBMA具有良好的生物相容性, 能够降低纳米粒子对细胞的毒性. 根据 ISO10993-5标准, 当细胞存活率高于75%时, 其毒性分级处于一级. 在实验研究的粒子浓度范围内, MSNs-pCBMA-DMMA的细胞存活率高于75%, 因而认为MSNs-pCBMA-DMMA具有良好的生物相容性.

Fig.6 Cytotoxicitiy of four nanoparticles of 0, 10, 50 and 100 μg/mL against Calu⁃3 cells cultured for 24 h
2.5 细胞摄取实验
以Calu-3细胞为模型细胞, 评估了Calu-3细胞对4种纳米粒子的摄取能力. 将荧光标记的纳米粒子溶液(50 μg/mL)与Calu-3细胞共培养4 h, 于荧光显微镜下观察纳米粒子和细胞的位置. 如图7所示, 在MSNs-NH2, MSNs-pCBMA和MSNs-DMMA实验组中细胞周围观察不到明显的绿色荧光, 而在MSNs-pCBMA-DMMA组中则有部分细胞中出现了绿色荧光, 表明MSNs-pCBMA-DMMA成功地进入细胞, 而其它3种粒子未进入细胞. Calu-3细胞会分泌黏液, 黏液pH值一般为6~7[42,43]. 在摄取体系中, MSNs-NH2和MSNs-DMMA的4 h模拟黏液渗透率相近(分别为5.5%和5.8%, 图4), 黏液渗透能力差, 很难穿透Calu-3细胞的黏液到达细胞表面[图7(A)和图7(B)]. 而MSNs-pCBMA的模拟黏液渗透能力虽然较MSNs-NH2和MSNs-DMMA更强(4 h模拟黏液渗透率为8.4%, 图4), 但在4 h内并未有效穿透Calu-3细胞的黏液, 因此也难以进入细胞内部[图7(C)]. MSNs-pCBMA-DMMA在4 h内的模拟黏液渗透率最高(16.8%, 图4), 而且经过黏液弱酸性环境的孵育, 其表面电势转变为+11.8 mV(图3), 表面存在的大量正电荷能与细胞膜上的负电荷相互吸引, 进而快速地进入细胞[图7(D)], 证明MSNs-pCBMA-DMMA是一种优良的跨黏膜递送药物的纳米粒子.
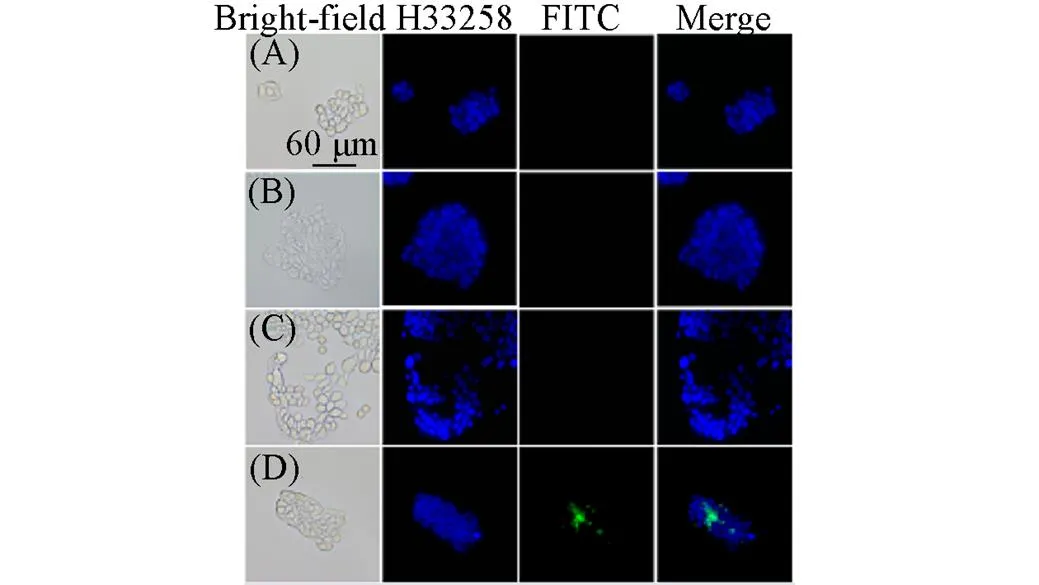
Fig.7 Cell imaging of Calu⁃3 co⁃cultured respectively with MSNs⁃NH2(A), MSNs⁃pCBMA(B), MSNs⁃DMMA(C) and MSNs⁃pCBMA⁃DMMA(D) for 4 h
3 结 论
采用溶胶-凝胶法合成了介孔二氧化硅纳米粒子MSNs-NH2, 以MSNs-NH2作为出发粒子接枝黏液惰性两性离子聚合物pCBMA并修饰酸敏感分子DMMA制备了MSNs-pCBMA-DMMA. pCBMA吸附水分子形成水化层能够增强纳米粒子在黏液中的抗黏附性, 而DMMA的修饰则赋予纳米粒子pH响应能力使其更快地被细胞摄取. TEM和FTIR等结果表明, MSNs-pCBMA-DMMA成功合成. 电势测定结果表明, 在弱酸性环境中MSNs-pCBMA-DMMA可以断裂DMMA基团导致表面电位上升, 具有高效pH响应能力. 黏液渗透实验显示, pCBMA具有加速粒子渗透的能力, 而DMMA的修饰进一步放大了这种加速效应, 在模拟黏液中以MSNs-NH2的app为标准计算得到的MSNs-pCBMA-DMMA的相对表观渗透系数达到了2.96, 同时其4 h内模拟黏液渗透率为16.3%, 是MSNs-NH2的3倍. MTT细胞毒性实验表明, MSNs-pCBMA-DMMA具有良好的生物安全性. 根据体外细胞摄取实验结果可知, 在4 h内MSNs-pCBMA-DMMA粒子能够有效地被细胞摄取. 本文针对纳米粒子的黏液层渗透问题和细胞摄取问题, 提出了一种将黏液穿透粒子和酸敏感分子相结合的策略, 并得到了具有黏液惰性和酸敏感能力的纳米粒子MSNs-pCBMA-DMMA, 为纳米粒子应用于黏膜相关疾病的活体诊断和治疗提供了基础.
[1] Li N., Liu Y., Guo P., Huang R., Liu Z. D.,, 2017,(3), 161—166(李楠, 刘岩, 郭盼, 黄瑞, 刘志东. 天津中医药大学学报, 2017,(3), 161—166)
[2] Chu B. B., Wang H. Y., He Y.,, 2021,(4), 880—888
[3] Yuan H., Liang H. Y., Hou P. D., Li J.,, 2021,(4), 840—845
[4] Li S. X., Yu S. F.,, 2005,(05), 525—527(李曙霞, 于世凤. 现代口腔医学杂志, 2005,(05), 525—527)
[5] Li W., Zhao W. D., Zhang W. Q., Zhang W., Guo Z.,, 2012,(7), 69—71(李伟, 赵卫东, 张威庆, 张炜, 郭壮. 山东医药, 2012,(7), 69—71)
[6] Creeth J. M.,, 1978,(1), 17—24
[7] Hovenberg H. W., Davies J. R., Carlstedt I.,, 1996,(1), 319—324
[8] Cone R. A.,, 2009,(2), 75—85
[9] Gao C. Y., Wang Y., Ye Z. H., Lin Z. H., Ma X., He Q.,, 2020,(6), 2000512
[10] Popov A.,, 2020,(6), 366—375
[11] Liu M., Zhang J., Shan W., Huang Y.,, 2015,(4), 275—282
[12] Wang Y. Y., Lai S. K., Suk J. S., Pace A., Cone R., Hanes J.,, 2008,(50), 9726—9729
[13] Tang B. C., Dawson M., Lai S. K., Wang Y. Y., Suk J. S., Yang M., Zeitlin P., Boyle M. P., Fu J., Hanes J.,, 2009,(46), 19268—19273
[14] Xu Q. G., Ensign L. M., Boylan N. J., Schon A., Gong X. Q., Yang J. C., Lamb N. W., Cai S. T., Yu T., Freire E., Hanes J.,, 2015,(9), 9217—9227
[15] Liu Y. X., Kong T. J., Yang Z. X., Zhang Y. W., Lei J. D., Zhao P.,, 2021,(2), 1223—1234
[16] Lai C., Hu H., Xu D. F.,, 2021,(12), 3013—3021
[17] Yang M., Lai S. K., Wang Y. Y., Zhong W. X., Happe C., Zhang M., Fu J., Hanes J.,, 2011,(11), 2597—2600
[18] Ostuni E., Chapman R. G., Holmlin R. E., Takayama S., Whitesides G. M.,, 2001,(18), 5605—5620
[19] Li L. Y., Chen S. F., Jiang S. Y.,, 2007,(11), 1415—1427
[20] Chen S. F., Jiang S. Y.,, 2008,(2), 335—338
[21] Yang W., Zhang L., Wang S. L., White A. D., Jiang S. Y.,, 2009,(29), 5617—5621
[22] Vaisocherova H., Yang W., Zhang Z., Cao Z. Q., Cheng G., Piliarik M., Homola J., Jiang S. Y.,, 2008,(20), 7894—7901
[23] Liu M., Wu L., Zhu X., Shan W., Li L., Cui Y., Huang Y.,, 2016,(35), 5831—5841
[24] Wang C., Cheng L., Liu Y. M., Wang X. J., Ma X. X., Deng Z. Y., Li Y. G., Liu Z.,, 2013,(24), 3077—3086
[25] Chen J., Ding J., Zhang Y., Xiao C. S., Zhuang X. L., Chen X. S.,, 2015,(3), 397—405
[26] Du J. Z., Sun T. M., Song W. J., Wu J., Wang J.,, 2010,(21), 3621—3626
[27] Chen S. Q., Song G., He C., Hou M., He W. D., Li H. J., Haleem A, Li Q. L., He R. F.,, 2020,(12), 2212—2221
[28] Zhou G. X., Li L. S., Xing J., Cai J., Chen J. Q., Liu P. D., Gu N., Ji M.,, 2017,(2), 490—499
[29] Zhang Z., Chao T., Chen S. F., Jiang S. Y.,, 2006,(24), 10072—10077
[30] Zhang L. Q.,, Tianjin University, Tianjin, 2018(张立倩. 聚羧基甜菜碱接枝载体的制备及其固定化酶的研究, 天津: 天津大学, 2018)
[31] Liu Y. J., Dai R., Wei Q. Y., Li W. Z., Zhu G., Chi H., Guo Z. M., Wang L., Cui C. H., Xu J. Q., Ma K.,, 2019,(47), 44582—44592
[32] Mcgill S. L., Smyth H. D. C.,, 2010,(6), 2280—2288
[33] Li X. T.,, Huazhong Agricultural University, Wuhen, 2014(李晓彤. 复合荧光二氧化硅纳米粒子的可控制备及其荧光性能探究, 武汉: 华中农业大学, 2014)
[34] Guo Q., Zheng Y. X., Wu L., Zhou R., Liu C. D., Huang Y.,, 2019,(03), 547—554 (郭权, 郑雅娴, 吴蕾, 周锐, 刘晨冬, 黄园. 药学学报, 2019,(03), 547—554)
[35] Fang L.,, Tianjin University, Tianjin, 2017(房蕾. 基于pH响应的纳米载体的制备及其黏液渗透性能的研究, 天津: 天津大学, 2017)
[36] Wang X.,, Jilin University, Changchun, 2017(王雪. 介孔有机硅杂化纳米材料的设计合成与性质研究, 长春; 吉林大学, 2017)
[37] Gao Y., Zhong S. L., Xu L. F., He S. H., Dou Y. M., Zhao S. N., Chen P., Cui X., J.,, 2019,, 130—137
[38] Slowing I. I., Vivero⁃Escoto J. L., Wu C. W., Lin V. S. Y.,, 2008,(11), 1278—1288
[39] Zhu Y. H., Sundaram H. S., Liu S. J., Zhang L., Xu X. W., Yu Q. M., Xu J. Q., Jiang S. Y.,, 2014,(5), 1845—1851
[40] Guo C.,, Huazhong University of Science and Technology, Wuhan, 2019(郭晨. 介孔二氧化硅纳米复合载药系统的构建及其抗肿瘤效应, 武汉: 华中科技大学, 2019)
[41] Cai J. J.,, Beijing University of Chemical Technology, Beijing, 2018(柴静静. 乳清蛋白纳米载体与肠粘液层渗透性的构效关系的研究, 北京: 北京化工大学, 2018)
[42] Jayaraman S., Joo N. S., Reitz B., Wine J. J., Verkman A. S.,, 2001,(14), 8119—8123
[43] Hehar S. S., Mason J. D. T., Stephen A. B., Washington N., Jones S., Jackson S. J., Bush D.,., 1999,(1), 24—25
Effects of Muco-inert and Acid-sensitive Modification on Mucosal Penetration of Nanoparticles
JIFa1, LIULing1, YULinling1,2*, SUNYan1,2
(1.,,,300350,,2.,,,,)
Gastric cancer, cervical carcinoma, lung cancer are occurred in mucosa, and the nanoparticles provided a competitive way for the diagnosis and therapy of these diseases. However, the mucus layer which contains mucus and other viscous substances could adsorb and remove the foreign substance, resulting the hindered penetration of nanoparticles. In this paper, a pH-responsive mucus-inert nanoparticle was designed for penetrating mucus and entering mucosal epithelial cells. In brief, mesoporous silica nanoparticles with surface amination(MSNs-NH2) was prepared by sol-gel method. Then, the zwitterionic polymer was modified to the surface of MSNs-NH2by atom transfer radical polymerization to form mucus-inert particles(MSNs-pCBMA). Acid-sensitive molecule DMMA was modified onto MSNs-pCBMA through amino groups on the particle surface to obtain pH-responsive mucus-inert nanoparticles(MSNs-pCBMA-DMMA). The results of transmission electron microscopy(TEM), proton nuclear magnetic resonance(1H NMR),Fourier transform infrared spectrophotometer(FTIR) andpotential measurements showed that four nanoparticles were synthesized successfully, and MSNs-pCBMA-DMMA exhibited sensitive pH response at pH= 7.4—5.7. A mucus-containing Transwell®model was used to study the permeability of nanoparticles in mucus. The penetration results showed that within 4 h, the mucus permeability of MSNs-pCBMA-DMMA reached 16.3%, 1.9 times that of MSNs-pCBMA and 3 times that of MSNs-NH2, and its relative apparent permeability coefficient reached 2.96 calculated with the apparent penetration coefficient(app) of MSNs-NH2as the reference. In addition, the grafting pCBMA improved the penetration rate of nanoparticles in mucus and the modification of DMMA further improved the penetration rate. Cytotoxic test showed that the viability of cells cultured with 100 μg/mL MSNs- pCBMA-DMMA was 78.3% in 24 h, indicating its good biosafety. The cellular uptake experiment showed that MSNs-pCBMA-DMMA could be endocytosed effectively at 4 h, and exhibited better endocytosis performance compared with other particles. The work proved that the combination of mucus inertia and acid sensitivity can effectively promote the mucosal permeability of nanoparticles, and MSNs-pCBMA-DMMA has excellent mucus permeability. The experimental results would benefit the design of nanoparticles for the diagnosis and therapy of mucosal diseases.
Nanoparticles; Zwitterionic polymer; Diffusion; Cell uptake; Mucus penetration
O631; TQ460.1
A
10.7503/cjcu20210837
2021-12-17
2022-02-15.
余林玲, 女, 博士, 副教授, 主要从事生物分离、 生物催化和纳米马达的研究. E-mail: yulinling@tju.edu.cn
国家自然科学基金(批准号: 21878223, 21621004)和天津市自然科学基金(批准号: 19JCQNJC05200)资助.
Supported by the National Natural Science Foundation of China(Nos.21878223, 21621004) and the Natural Science Foundation of Tianjin from Tianjin Municipal Science and Technology Commission, China(No.19JCQNJC05200).
(Ed.: L, H, W, K)
