基于多孔石墨化碳柱-四极杆-飞行时间质谱解析甜菜果胶精细结构
2022-07-18朱凯利婕武潇逸胡薇薇吴冬梅虞诚潇葛志伟叶兴乾陈士国
朱凯, 利婕, 武潇逸, 胡薇薇, 吴冬梅, 虞诚潇, 葛志伟, 叶兴乾,2,3, 陈士国,2,3
基于多孔石墨化碳柱-四极杆-飞行时间质谱解析甜菜果胶精细结构
朱凯1, 利婕1, 武潇逸1, 胡薇薇1, 吴冬梅1, 虞诚潇1, 葛志伟4, 叶兴乾1,2,3, 陈士国1,2,3
(1. 浙江大学生物系统工程与食品科学学院, 智能食品加工技术与装备国家地方联合工程实验室, 浙江省农产品加工技术研究重点实验室, 南方果蔬保鲜技术集成科研基地, 浙江省健康食品制造与品质控制国际合作基地, 杭州 310058; 2. 浙江大学馥莉食品研究院, 杭州 310058; 3. 浙江大学宁波研究院, 宁波 315100; 4. 浙江大学农生环测试中心, 杭州 310058)
采用高温酸法提取甜菜果胶(SBP), 经强阴离子交换柱层析分离, 获得甜菜果胶水洗脱组分(SBPW)和盐洗脱组分(SBP3). 单糖组成分析和分子量表征结果表明, SBPW主要由半乳糖(Gal)、 阿拉伯糖(Ara)和半乳糖醛酸(GalA)组成, 分子量为1100; SBP3则以GalA为主, 分子量为41450. 通过顺序酶法降解, 应用多孔石墨化碳柱-四极杆-飞行时间质谱(PGC-Triple-Tof MS)联用技术分析鉴定了SBPW和SBP3寡糖的精细结构. 结果表明, SPBW的主链为[→4)--GalA-(1→2)--Rha-(1→]重复单元构成的Ⅰ型聚鼠李半乳糖醛酸(RG-Ⅰ果胶), 鼠李糖-4位被中性糖侧链[-(1→5)阿拉伯聚糖和-(1→4)半乳聚糖]所取代. SBP3由-1,4链接的聚半乳糖醛酸(HG)和RG-Ⅰ构成, HG和RG-Ⅰ通过-1,4糖苷键直接相连, 并发现了-GalA(1→2)-Rha(1→4)-Rha(1→4)-GalA(1→2)-Rha的新特征结构.
甜菜; 果胶; 寡糖; 结构解析; 多孔石墨化碳柱-多级质谱
果胶(Pectin)是一类富含半乳糖醛酸(GalA)的杂多糖, 广泛存在于植物细胞的胞间层和初生壁中. 现有研究根据果胶分子主链和支链结构的不同, 大致将其分为4类结构域: 同型半乳糖醛酸聚糖(Homogalacturonan, HG)、 鼠李半乳糖醛酸聚糖I(Rhamngalacturonan Ⅰ, RG-Ⅰ)、 鼠李半乳糖醛酸聚糖Ⅱ(Rhamngalacturonan Ⅱ, RG-Ⅱ)和木糖半乳糖醛酸聚糖(Xylogalacturonan, XG)[1,2]. 由于来源、 提取条件、 植物发育阶段、 植物种类、 细胞壁位置和环境因素不同, 果胶在其组成上也呈现多样化, 至今关于果胶结构域的相对位置以及果胶中这些结构域之间如何连接仍有疑问[3]. 果胶不仅可用作增稠剂、 胶凝剂和乳化剂等, 也有益生、 抗肿瘤和降低血糖等生理活性功能[4~6]. 果胶的结构与其功能密切相关[7], 本课题组前期研究发现, 不同结构的果胶在凝胶构成、 肠道菌群调节和抗结肠炎功能等方面差异显著[8~11]. 因此, 解析果胶精细结构是利用丰富果胶资源的前提.
甜菜果胶(Sugar beet pectin, SBP)是一种相对较新的果胶, 具有比柑橘和苹果果胶更好的乳化特性[12,13]. 研究显示, SBP主要以富含中性糖侧链的RG-Ⅰ结构为主, 但精细结构仍不明晰, 其结构研究仍滞后于功能研究[14]. Funami等[15]发现SBP的分子结构对其乳化作用具有非常重要影响, 因此深入探究SBP结构有助于其后续开发和应用.
果胶结构复杂, 且黏度较大, 单纯使用高碘酸-Smith降解、 甲基化和核磁共振波谱等方法对其进行解析存在困难[16]. 近年来, 液相色谱-质谱联用技术(LC-MS)在解析多糖精细解析方面显示出巨大的潜力[17—19]. 本文以SBP为研究对象, 通过离子交换层析分离纯化, 采用红外光谱和高效液相色谱表征了各组分其结构. 最后, 通过顺序酶法降解, 基于多孔石墨化碳柱串联多级质谱(PGC-MS/MS)对SBP寡糖的结构进行了解析, 进而探究SBP的精细结构, 建立了一种分步降解联合液相色谱质谱联用(LC-MS/MS)分析果胶的方法, 为SBP资源的开发利用提供了依据.
1 实验部分
1.1 试剂与仪器
甜菜(10月购于杭州当地市场)冻干后粉碎, 用体积分数为75%的乙醇浸泡脱色素和游离糖, 重复12次; 木糖(Xyl)、 甘露糖(Man)、 鼠李糖(Rha)、 葡萄糖(Glc)、 半乳糖(Gal)、 葡萄糖醛酸(GlcA)、 半乳糖醛酸(GalA)、 阿拉伯糖(Ara)、 岩藻糖(Fuc)、 三氟乙酸(TFA)和硼氢化钠, 色谱纯, 美国Sigma公司; 乙腈和醋酸铵, 色谱纯, 德国Merck公司; 其它试剂均为分析纯, 上海国药集团化学试剂公司;实验用水为纯净水.
Alpha 1-4 LDplus型冻干机, 德国Marin Christ公司; ICS-5000+Dionex型离子色谱仪, 美国赛默飞公司; UV-2600型紫外-可见(UV-Vis)分光光度计, 日本岛津公司; A VA TAR370型傅里叶变换红外光谱仪(FTIR), 美国尼高力仪器公司; Waters 2659型高效液相色谱仪(LC), 美国Waters公司; ROD-20A型示差检测器, 日本岛津公司; DAW NHELE 505Ⅱ型18角激光光散射仪, 美国Wyatt公司; Acqtity UPLC classic型超高效液相系统, 美国Waters公司; Triple-TOF 5600+型飞行时间质谱系统, 美国AB SCIEX公司: 负离子扫描模式; 扫描范围:100~1500; 雾化气: 55 psi; 雾化气: 55 psi; 气帘气(CUR): 35 psi; 离子源温度(TEM): 550 ℃; 离子源电压(IS): ‒4500 V; 一级扫描: 去簇电压(DP): 100 V;聚焦电压(CE): 10 V; 二级扫描: 使用TOF MS-Product Ion-IDA模式采集质谱数据, CID能量为(40±20) eV, 进样前, 用CDS泵做质量轴校正使质量轴误差小于2×10‒6. 采用Peakview进行数据处理.
1.2 实验过程
1.2.1SBP的提取将5 g甜菜粉末加入200 mL 1 mol/L盐酸中, 用3 mol/L NaOH调节提取体系pH值至1.7, 于0 ℃搅拌(1000 r/min)提取2 h, 冷却至室温后调节pH值至5.0~6.0, 以8000 r/min的转速离心15 min后取上清液, 加入2倍体积的乙醇后于4 ℃静置2 h, 以8000 r/min的转速离心10 min, 用乙醇清洗SBP沉淀后溶解于水中, 用截留分子量为1×107的透析袋透析2~3 d, 冻干.
1.2.2甜菜果胶的分离纯化使用HiTrap CaptoTMQ 5mL强阴离子交换柱进行分离纯化. 样品浓度为10 mg/mL, 以12000 r/min的转速离心20 min, 上样2.5 mL, 梯度洗脱用NaCl溶液最高浓度为1 mol/L , 控制流速为2.5 mL/min, 梯度洗脱: 0~10 min, 0 mol/L NaCl; 10~50 min, 0~0.8 mol/L NaCl; 50~60 min, 1 mol/L NaCl; 60~70 min, 0 mol/L NaCl; 每1 min收集一次洗脱液, 并测定总糖和糖醛酸含量, 绘制洗脱曲线. 分别收集合并洗脱曲线上同一个峰的样品, 用截留分子量为10000的透析袋透析2 d后冻干, 用于后续理化分析.
1.2.3总糖和糖醛酸的测定分别采用苯酚-硫酸法[20]和间羟基联苯法[21,22]测定SBP中总糖和糖醛酸含量.
1.2.4分子量测定采用凝胶渗透色谱串联18角度激光光散射-示差检测(SEC-MALLS-RI)测定SBP的分子量. 色谱柱为Shodex OH SB-G以及Shodex SB-806 HQ和SB-804 HQ串联, HPSEC检测条件: Waters 2695型高效液相色谱仪, 流动相为0.15 mol/L NaCl(含体积分数0.02% Procolin), 流速 0.5 mL/min, 柱温40 ℃. 用纯净水溶解SBP样品, 浓度为3 mg/mL, 用0.22 μm水膜过滤后上样, 上样量50 μL.
1.2.5单糖组成分析向1 mL 2 mg/mL SBP样品溶液中加入1 mL 4 mol/L TFA溶液, 熔封后于110 ℃酸解6 h, 用N2气吹干, 并用水定容至5 mL, 经0.22 μm水膜过滤后待测. 标准品处理: 取Fuc, Rha, Ara, Xyl, Glc, Gal, Man, GlcA和GalA等摩尔混合制成1 mmol/L的标准单糖混合液, 梯度稀释, 用0.22 μm水膜过滤后待测.
采用Thermo ICS-5000+(HPAEC-PAD)分析单糖组成: CarboPac PAl0色谱柱(4.6 mm×250 mm, Dionex, Thermo Fisher, USA), 柱温30 ℃, 上样体积25 μL, 流动相A为24 mmol/L NaOH溶液, 流动相B为100 mmol/L NaOAc和24 mmol/L NaOH溶液. 流速l.0 mL/min, 梯度洗脱: 0~15 min, 100%A;15~35 min, 0%~100%B.
1.2.6酯化度分析参照文献[23]方法并略有改动进行酯化度分析. 将5 mg SBP样品加入0.5 mL含10 mmol/L CuSO4和10 mmol/L异丙醇的水溶液中, 混合均匀, 加入0.5 mL 1 mol/L NaOH溶液再次混合均匀, 进行皂化; 混合物在4 ℃反应30 min. 以10000 r/min的转速离心10 min, 取上清液并调节pH值至3.0, 用0.22 μm水膜过滤后待测.
配制甲醇、 乙酸和异丙醇质量比为3:1:1的色谱级混合液, 作为混合标准样品进样, 用于测量甲醇和乙酸的响应因子. SinoChromODS-BP C18色谱柱(5 μm, 4.6 mm×250 mm, 依利特), 流动相为 4 mmol/L H2SO4溶液, 流速0.8 mL/min, 洗脱时间20 min, 进样量20 μL, 柱温30 ℃, 示差折光检测, 检测温度30 ℃.
1.2.7顺序酶解法制备SBP寡糖将5 mg SBP3样品溶解于2 mL 0.1 mol/L乙酸钠缓冲液(pH=4.0)中, 再分别加入2 U的阿拉伯糖内切酶(endo-1,5--L-arabinase)和半乳糖内切酶(endo-1,4--galactanase), 摇荡均匀;于40 ℃反应24 h后, 加入相同量的阿拉伯糖内切酶和半乳糖内切酶再反应24 h; 反应结束后于100 ℃灭酶10 min, 采用SuperdexTMpeptide 10/300 GL检测.
中性糖酶解完成后, 向样品溶液中加入2 U/mg的果胶酶(pectinase)进行主链酶解, 分别于40 ℃反应2 h和6 h后取样, 于100 ℃灭酶10 min, 采用SuperdexTMpeptide 10/300 GL检测.
1.2.8果胶寡糖还原脱盐将SBPW和SBP3顺序酶解后, 向寡糖中加入300 μL 10 mg/mL NaBH4溶液(溶于20 mmol/L 醋酸铵), 于暗处还原12 h; 利用GCC SPE(250 mg, 3 mL, Supelclean ENVI carb, Sigma-Aldrich, USA), 使用前分别用10 mL乙腈和水活化. 上样后用10 mL水脱盐, 用5 mL体积分数40%乙腈(含体积分数0.1% TFA)洗脱并收集洗脱液, 真空干燥后待测.
1.2.9PGC-ESI-MS/MS解析甜菜果胶寡糖参照文献[24]方法并作一定修改, 利用UPLC-PGC-MS/MS分析降解后的寡糖组分. 采用Hypercarb多孔石墨化碳柱(3 μm, 2.1 mm×150 mm, Thermo Scientific), 溶剂A为水(含体积分数0.1%甲酸), 溶剂B为乙腈(含体积分数0.1%甲酸), 柱温40 ℃, 流速300 μL/min, 洗脱梯度: 0~2 min, 3%B;2~33.2 min, 3%~11%B;33.2~40 min, 11%~100%B;40~42 min, 100%B;42~50 min, 100%~3%B;50~60 min, 3%B.
2 结果与讨论
2.1 甜菜果胶提取和分离纯化
采用高温酸法提取甜菜果胶(Sugar beet pectin, SBP), 收率[(甜菜果胶)/5 g甜菜粉×100]为(8.16±0.13)%, 与文献[25,26]报道的收率(6.0%~10.3%)一致. 实验测得SBP总糖含量为82.14%(质量分数), 甜菜果胶的半乳糖醛酸含量为71.16%. 采用强阴离子色谱对甜菜果胶进行分离纯化, 洗脱情况如图1所示. 根据其出峰顺序分别命名为SBPW, SBP1, SBP2, SBP3, SBP4, SBP5和SBP6, 回收率(质量分数)分别为7.5%, 8.0%, 10.3%, 9.1%, 8.2%和10.0%, SBP6组分量不足支持后续分析.
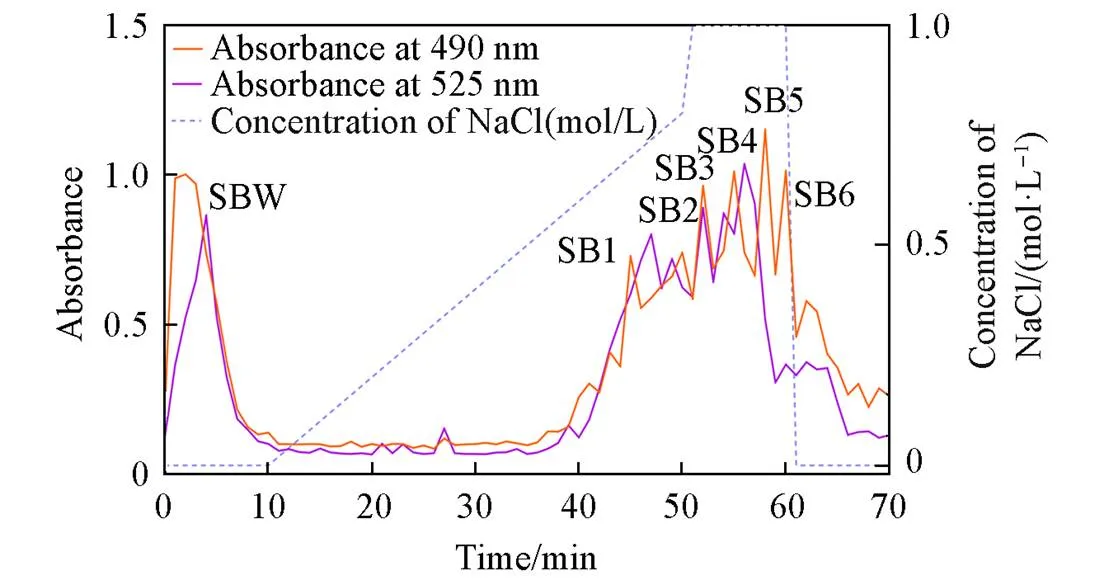
Fig.1 Purification of sugar beet pectin by gradient elution(a) and absorbance of SBP detected by phenol⁃sulfuric acid method(b) and hydroxybiphenyl method(c)
2.2 甜菜果胶的基本结构信息表征
对SBP进行了基本信息表征, 结果列于表1, 可见其分子量为3444000, 是一类低酯果胶(DM质量分数43.14%, DAc质量分数21.23%)[26,27]. 离子色谱结果[图2(A)及表1]显示, SBP主要由GalA(57.02%, 摩尔分数), Rha(16.09%, 摩尔分数)和Ara(13.67%, 摩尔分数)组成, Rha/GalA大于0.05[28], 同型半乳糖醛酸聚糖的摩尔分数[(HG)]为40.93%, 鼠李半乳糖醛酸聚糖Ⅰ[(RG-Ⅰ)]为47.86%, 说明甜菜果胶是侧链含量丰富的RG-Ⅰ型果胶. 利用红外光谱分析了SBP的官能团组成, [图2(B)]中1745 cm-1处为羧基(COOH)的伸缩振动峰, 1635 cm-1处为羟基(C=O)的非对称伸缩振动峰, 1441 cm-1处为C=O的对称伸缩振动峰, 均为糖醛酸中质子化羧基的特征峰. 此外, 832 cm-1和919 cm-1附近均有较强吸收峰, 说明SBP中既含有-糖苷键, 也含有一定量的-糖苷键, 这与单糖表征结果相符. 进一步分析了纯化后的样品, 从表1可知, SBPW主要以中性糖为主, 随着洗脱液中盐浓度的增加, 洗脱的SBP组分中GalA含量也呈现增加趋势. SBP1, SBP2和SBP3均为富含中性糖侧链的RG-Ⅰ型果胶, 而SBP4和SBP5则是HG型果胶(GalA的摩尔分数>60%). 纯化后各组分的分子量为1100~100200,w/n在1.535~2.875之间, 表明纯化后的甜菜果胶不具有多分散性. 研究表明, 果胶中的甲酯基团会阻碍强阴离子填料对果胶的吸附作用, 因此在梯度洗脱过程中甲酯化度越高的甜菜果胶越早被洗脱出来[29]. SBP各组分的酯化度数据见表1, 可见随着洗脱浓度的增大, SBP洗脱组分酯化度降低.
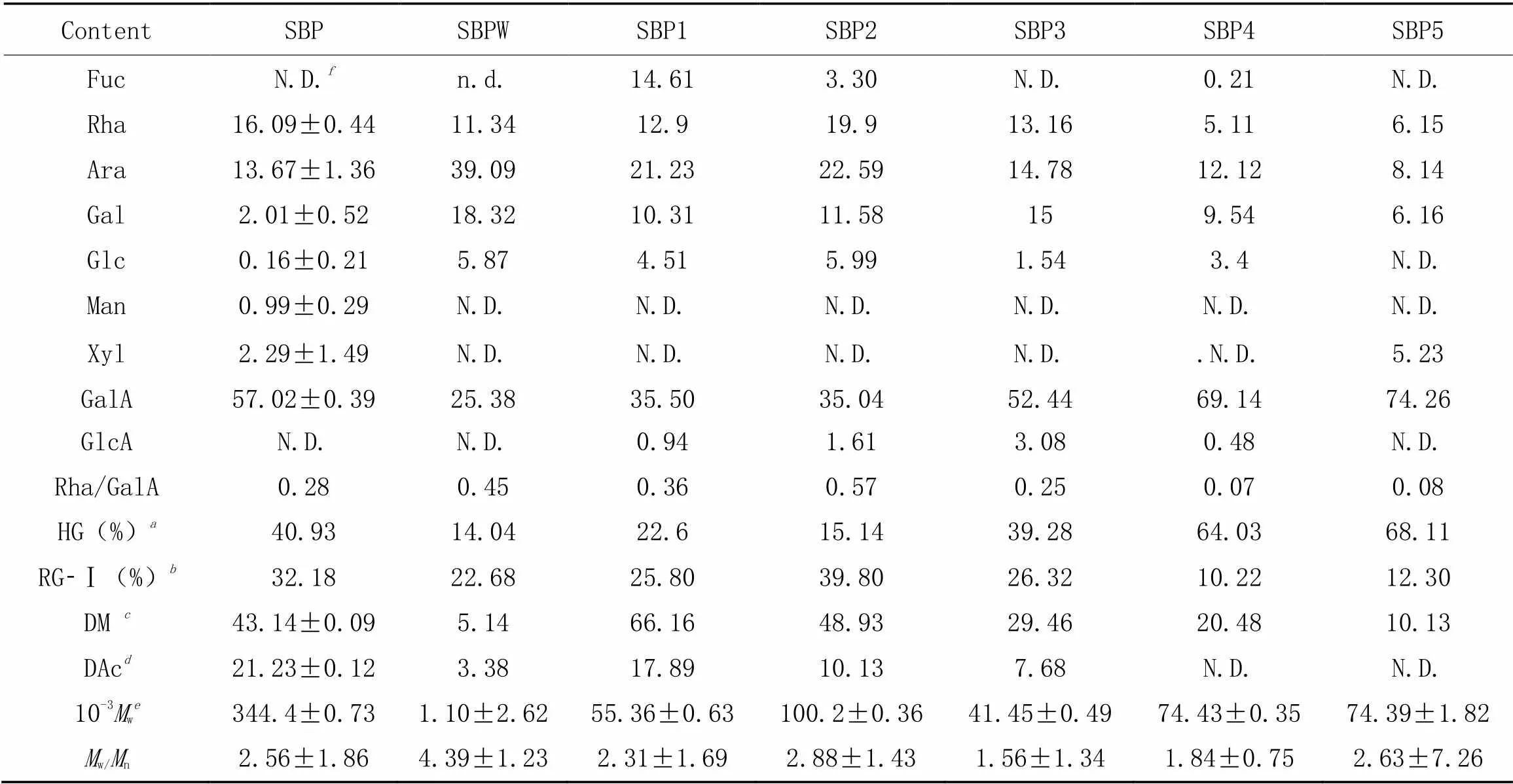
Table 1 Monosaccharide composition(%, molar fraction) and molecular weight of pectin
.(HG)=(GalA)-(Rha): the molar fraction of HG domains on pectin;.(RG-Ⅰ)=2(Rha): the proportions of RG-Ⅰ domains on pectin;. DM: degree of methylation;. DAc: degree of acetylation;w: weight-average of molar mass;. not detected.
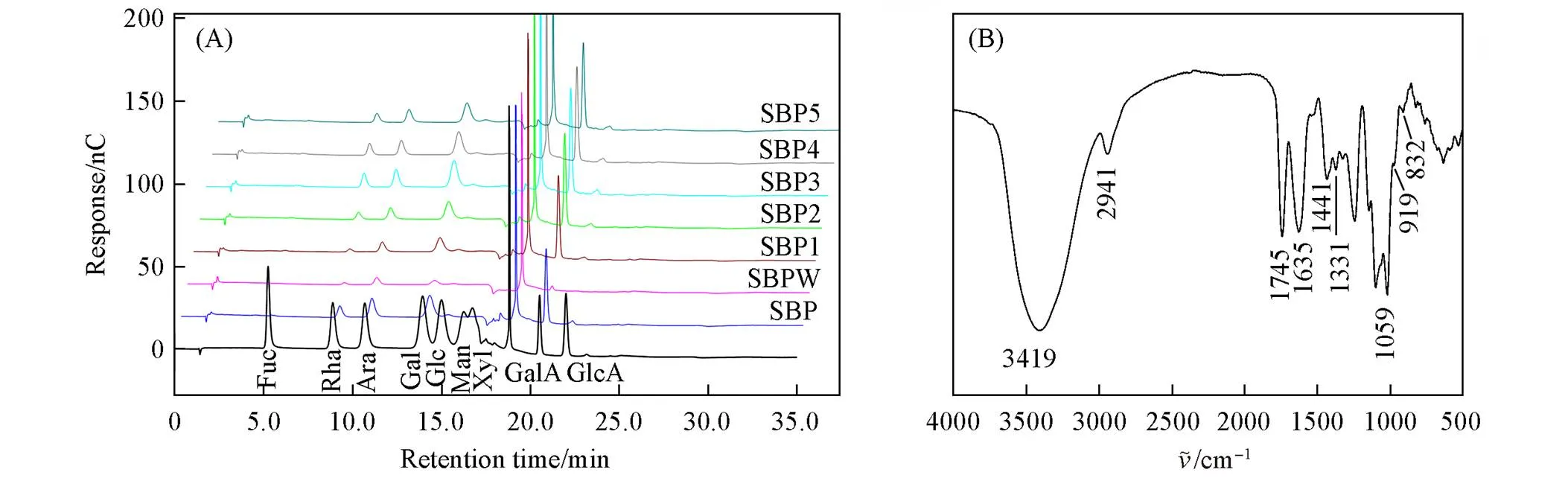
Fig.2 Overlaid HPAEC⁃PAD chromatograms of different pectin fractions after purification(A) and FTIR(B) of sugar beet pectin
2.3 顺序酶降解方法的优化

Fig.3 Overlaid HPGPC profiles of oligosaccharide distribution of side chain enzymolysis(A) and main chain enzymolysis(B) by superdex peptide
(A). 0.4 U/mg,. 0.8 U/mg; (B). 4 h,. 6 h.
研究表明, 半乳糖和阿拉伯糖内切酶对果胶中性糖侧链的酶解效率很低[30], 通过控制酶解时间和酶浓度优化了SBP3的侧链酶解条件. 由图3(A)可见, 采用0.4 U/mg的酶与底物比酶解48 h后, 出现了不同聚合度的寡糖低丰度信号峰, 说明SBP3中部分中性糖侧链被降解. 随着酶量增加至0.8 U/mg, 不同聚合度的中性糖寡糖丰度显著增加. 因此, 确定SBP中性糖侧链酶解条件如下: 40 ℃反应48 h, 每24 h分别加入0.4 U/mg的阿拉伯糖和半乳糖内切酶.
果胶侧链酶解后进行主链酶解, 按照2 U/mg酶与底物比加入果胶酶, 随着酶解时间的延长 [图3(B)], SBP3的主链被酶解得更彻底, 更多半乳糖醛酸寡糖被释放出来, 选取主链酶解时间为6 h的条件进行分析.
2.4 PGC-MS/MS解析甜菜果胶寡糖
多孔石墨化碳柱(PGC)表面是由碳原子排布成类似芳环的六角形结构, 分子表面越平, 极性越大与其相互作用的机会也越大; 此外, 由于为全碳基材料, PGC在极端pH和温度下仍稳定, 在分离寡糖类极性分子方面具有良好的优势.
由图4可见, SBPW[图4(A)]和SBP3[图4(B)]顺序酶解后产生一系列寡糖, 在50 min内被 PGC-triple-Tof-MS成功分离并检测. 根据质谱信息中的分子量数据、 单糖组成和断裂碎片峰信息推测各组分可能的寡糖序列如表2和表3所示.与半乳糖寡糖相比, 阿拉伯寡糖能在PGC中保留得更久; 此外, 带有电荷的半乳糖醛寡糖在PGC中被强烈保留, 洗脱时间显著增加, 与Westphal等[31]的研究结果相吻合.
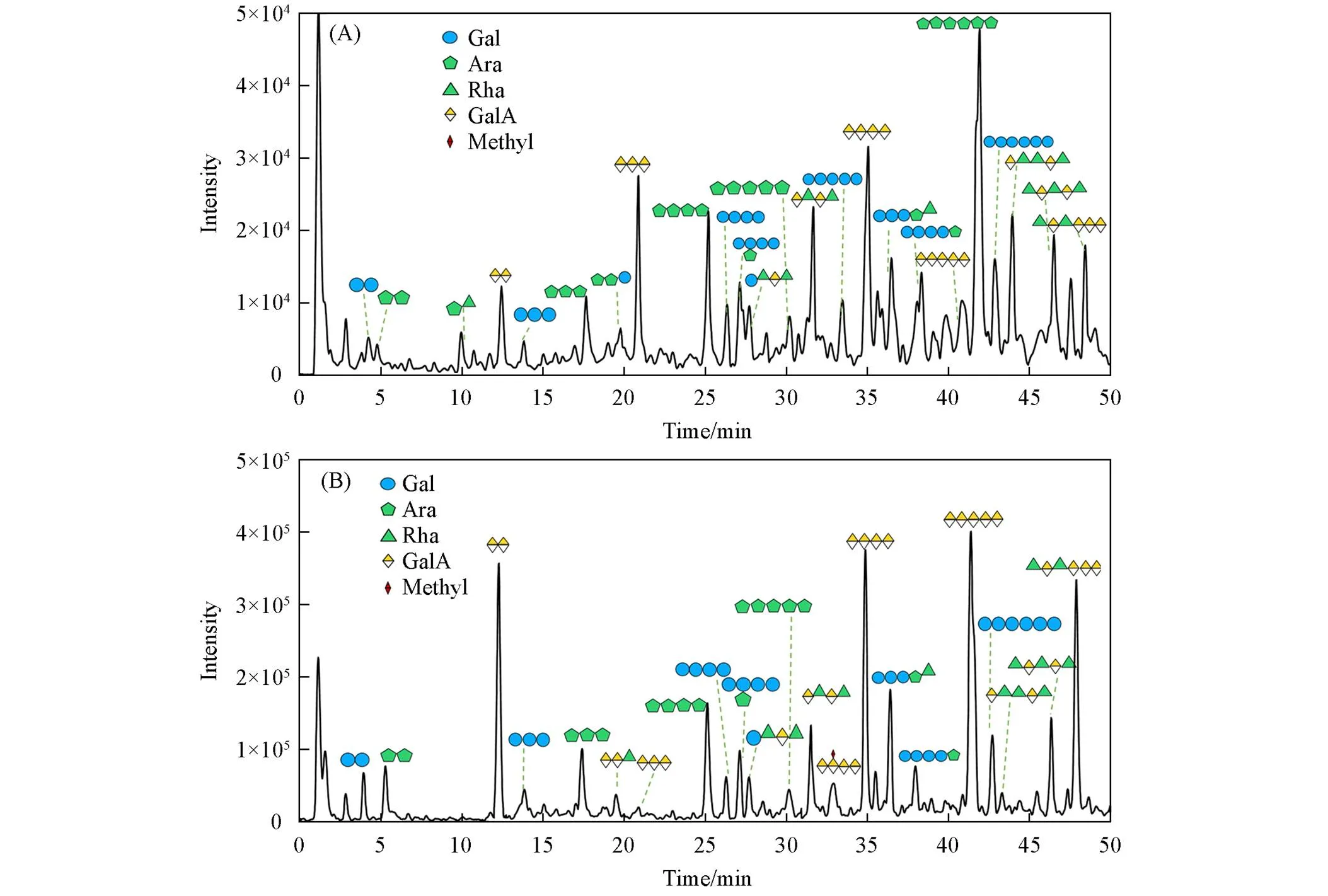
Fig.4 Annotated base peak chromatogram of characterized oligosaccharides from SBPW(A) and SBP3(B)
SBPW经顺序酶降解后共检测到22种寡糖[图4(A)]. 从一级质谱图可以看到, 中性糖寡糖存在 [M-H]-和[M+HCOO]-离子, 而半乳糖醛酸寡糖仅以[M-H]-的离子存在. 根据确定各峰的归属 (表3), 寡糖聚合度范围集中在2~7, 主要为阿拉伯糖寡糖和半乳糖寡糖, 证明中性糖内切酶能有效地降解果胶的侧链. 此外, 还有少量的半乳糖醛酸寡糖(GalA oligo)和鼠李糖半乳糖醛酸寡糖(Rha-GalA oligo), 分别来自SBPW的HG和RGI结构域.
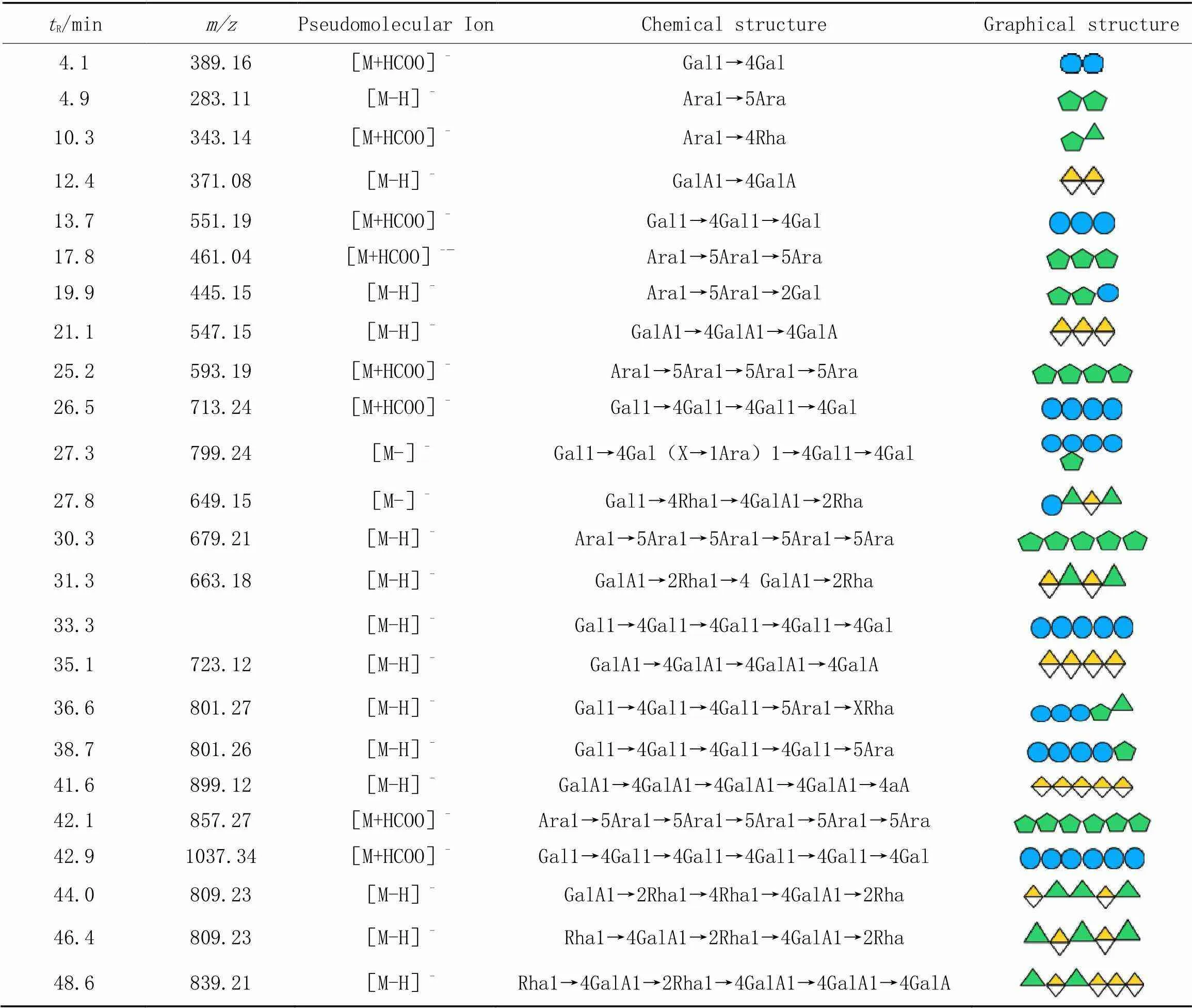
Table 2 Signal attribution of SBPW

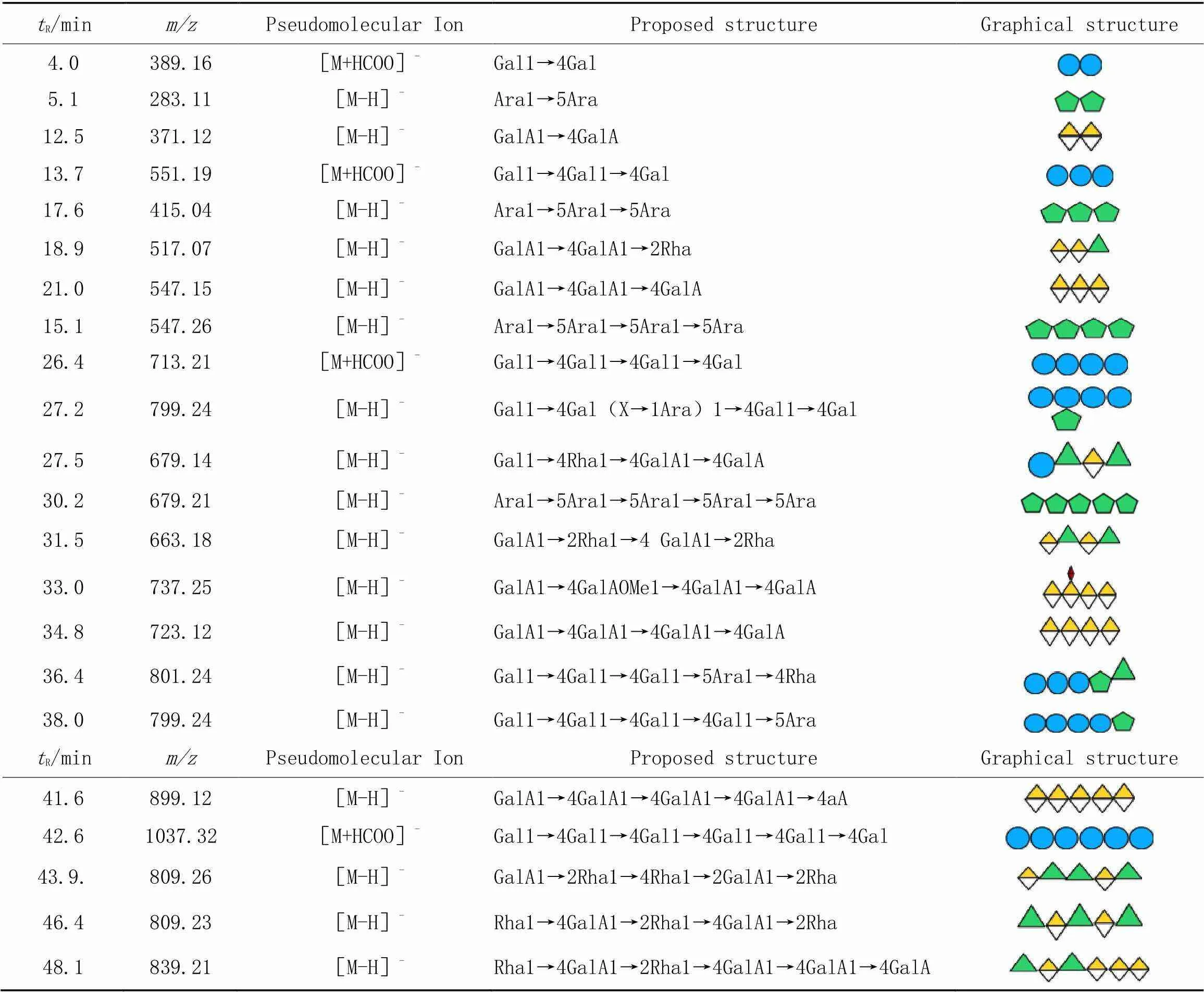
Table 3 Signal attribution of SBP3

进一步结合二级质谱分析了寡糖结构, 阿拉伯二糖(Ara2)的二级质谱见图5. C1(149.0460)和Y1(151.0571)是典型糖苷键断裂产生的碎片离子峰, 环内裂解碎片的缺失使得难以确定其具体链接信息, 结合endo-arabinanase能在一定程度上专一酶解断裂1,5连接的阿拉伯聚糖, 因此推断Ara2是-1,5链接的阿拉伯二糖[32]. 保留时间17.8 min处的=593.19的离子归属于[Ara4+HCOO]-, 除糖苷键断裂产生的C1(149.04), B2(265.09), B3397.14), Y1(151.06)和Y2(283.10)等碎片外, 阿拉伯四糖也产生了0,3A2(191.06). 结合文献[14]报道, 推断该寡糖为-Ara(1→5)-Ara (1→5)-Ara(1→5)-Ara. 进一步分析了半乳寡糖链的连接情况结构[图5(E)], 对于1,4连接的六碳糖而言, 易发生0,2A,2,4A和2,5A的跨环断裂[1], 由此可确定SBPW中半乳四糖的结构为-Gal(1→4)-Gal(1→4)-Gal(1→4)-Gal, 与endo-galactanase的酶解规律保持一致[33]. 此外, 图5(C)显示了Ara2Gal的二级质谱图, 出现的Y1181.07)说明还原后的Gal位于为还原末端, C1(149.04)和C2(281.09)片段则表明Ara位于非还原端, 由碎片0,3A2(191.06)可推断阿拉伯糖为1,5连接, 未观察到Gal产生环内断裂[34], 推测Ara和Gal之间是1,3连接, 因此Ara2Gal的结构为-Ara(1→5)-Ara(1→3)-Gal. 根据MS/MS分析, SBPW其余寡糖结构见表3. 中性糖侧链主要以1,5连接的阿拉伯聚糖和1,4连接的半乳聚糖为主, 部分的Gal和Ara的-3位分别被-Ara和-Gal取代构成了带分枝的结构, 并且中性糖侧链主要通过1,4糖苷键与甜菜果胶的RG-Ⅰ的-Rha连接[图5(E)].

Fig.5 MS/MS spectra of SBP3 reduced oligosaccharides and oligosaccharides Ara2(A) , Ara4(B), Gal5(C), Ara2Gal(D), Gal3Rha(E), GalA2(F), Rha2GalA2(G) and Rha3GalA2(H)(alditol form of reduced oligosaccharides)
图4(B)给出顺序酶解得到的SBP3的寡糖序列, 共解析到22种寡糖结构, 聚合度分布在2~7, 与酶解后凝胶色谱柱分析结果一致[图3(B)]. 与水洗脱组分SBPW相比, SBP3降解后的寡糖主要为GalA Oligo, 其次是Rha-GalA oligo, 结合单糖分析(表1)结果, SBP3链由HG和RG-Ⅰ构成[(HG)/(RG)= 3∶2]. 在GalA2(371.09)的MS/MS谱图[图5(F)]中, 除了B1(177.02), C1(193.04)和Y1(195.05)的糖苷键碎片外, 也产生了环内裂解的2,4A2(235.05), 推断该寡糖为-GalA(1→4)- GalA[35]. 以此解析其它的半乳糖醛酸寡糖(表4). 值得注意的是, 在SBPW和SBP3中, 带有甲酯基团的半乳糖醛酸寡糖几乎没有被检测到, 这是因为果胶酶仅能高效地作用于HG结构域中无甲酯基的-1,4-D-GalA, 释放出半乳糖醛酸寡糖. 图5(G)为GalA2Rha2的二级质谱图, 通过糖苷键碎片B1(175.02), C1(193.03), B2(323.08)和C2(339.09)确定了非还原端是GalA, 而Rha则位于还原端,1,3A2(235.05)碎片说明GalA于Rha之间以1,2糖苷键链接, 结合RG-Ⅰ结构域的特征, 确定GalA2Rha2的结构为-GalA(1→2)-Rha(1→4)α-GalA(1→2)-Rha. 在寡糖GalA2Rha3(809.26)的二级质谱图[图5(G)]中, Z1(165.08)说明Rha位于还原端, 同时, B1(175.02), C1(193.03), B2(323.10), C2(339.09), C3(485.15)和B4(648.19)离子说明GalA2Rha3从非还原端开始顺序为GalA-Rha-Rha-GalA-Rha,1,3A2(235.05)和2,4A3(381.10)碎片证明GalA连接于Rha的-2位, 而2个相邻Rha则以1,4糖苷相连, 即该寡糖片段为-GalA(1→2)-Rha(1→4)-Rha(1→4)-GalA(1→2)-Rha. 结合MS/MS解析SBP3寡糖具体结构见表4.
3 结 论
通过高温热酸提取得到甜菜果胶(SBP), 分析结果显示SBP是一类高中性糖侧链的低酯果胶(w=344400). 用强阴离子交换色谱分离纯化SBP后, 以水洗脱组分(SBPW)和盐洗脱组分(SBP3)为研究对象, 采用顺序酶降解法, 联合PGC-MS/MS分析, 共鉴定出22种寡糖序列. 进一步结合单糖分析发现, SPBW是一类富含中性糖侧链的RG-Ⅰ果胶, 在Rha的-4被1,5连接的阿拉伯聚糖和1,4连接的半乳聚糖取代. SBP3主链由HG和RG-Ⅰ构成[(HG)/(RG)=3∶2], HG为-1,4链接的同聚半乳糖醛酸, RG-Ⅰ 结构域主要由[→4)--GalA-(1→2)--Rha-(1→]重复单元构成, 但也发现了-GalA(1→2)-Rha(1→4)-Rha(1→4)-GalA(1→2)-Rha的新特征结构, HG和RG-Ⅰ结构域直接通过-1,4糖苷键相连. SBP3的RG-Ⅰ区域侧链主要为包括-(1→4)半乳聚糖和(1→5)阿拉伯聚糖, 以及带有少量Ara分支的-(1→4)半乳聚糖. 本文实现了对结构复杂的果胶精细结构的高效快速分析, 新发现的结构信息完善了现有的甜菜果结构研究, 也为SBP的功能研究和应用提供了理论依据.
[1] Mao G. Z., Wu D. M., Wei C. Y., Tao W. Y., Ye X. Q., Linhardt R. J., Orfila C., Chen S. G.,, 2019,, 65—78
[2] Somerville C., Bauer S., Brininstool G., Facette M., Hamann T., Milne J., Osborne E., Paredez A., Persson S., Raab T., Vorwerk S., Youngs H.,, 2004,(5705), 2206—2211
[3] Atmodjo M. A., Hao Z. Y., Mohnen D., 2013,, 747—779
[4] Blanco P. F., Steigerwald H., Schulke S., Vieths S., Toda M., Scheurer S.,, 2021,(10), 43
[5] Gao X. G., Zhi Y., Sun L., Peng X. X., Zhang T., Xue H. T., Tai G. H., Zhou Y. F.,, 2013,(47), 33953-33965
[6] Mohnen D.,, 2008,(3), 266—277
[7] Larsen N., de Souza C. B., Krych L., Cahu T. B., Wiese M., Kot W., Hansen K. M., Blennow A., Venema K., Jespersen L.,, 2019,, 223
[8] Zhu K., Mao G. Z., Wu D. M., Yu C. X., Cheng H., Xiao H., Ye X. Q., Linhardt R. J., Orfila C., Chen S. G.,, 2020,(32), 8688—8701
[9] Wu D. M., Chen S. G., Ye X. Q., Ahmadi S., Hu W. W., Yu C. X., Zhu K., Cheng H., Linhardt R.J., He Q. J.,, 2022, 107209
[10] Wu D. M., Zheng X. L., Hu W. W., Zhu K., Yu C. X., He Q. J., Linhardt R. J., Ye X. Q., Chen S. G.,, 2021,, 100283
[11] Mao G. Z., Li S., Orfila C., Shen X. M., Zhou S. Y., Linhardt R. J., Ye X. Q., Chen S. G.,, 2019,(12), 7828—7843
[12] Wei Z. H., Zhu P., Huang Q. R.,, 2019,, 448—458
[13] Gromer A., Penfold R., Gunning A. P., Kirby A. R., Morris V. J.,, 2010,(16), 3957—3969
[14] Levigne S.V., Ralet M. C. J., Quéméner B. C., Pollet B. N. L., Lapierre C., Thibault J. F. J.,, 2004,(3), 1173—1180
[15] Funami T., Nakauma M., Ishihara S., Tanaka R., Inoue T., Phillips G. O.,, 2011,(2), 221—229
[16] Zhu K., Ye X. Q., Liu D. H., Chen S. G.,, 2021,(1), 23—32(朱凯, 叶兴乾, 刘东红, 陈士国. 未来食品科学, 2021,(1), 23—32)
[17] Wang J. Q., Zhao J., Nie S. P., Xie M. Y., Li S. P.,, 2021,, 116436
[18] Liang Q. T., Zou Q., Lin J. H., Liu S. T., Wei Z.,, 2021,(6), 1776—1784(梁群焘, 邹强, 林江慧, 刘树滔, 魏峥. 高等学校化学学报, 2021,(6), 1776—1784)
[19] Li C., Wang C. J,. Jin W. J., Han J. L., Yang M. F., Gao X., Huang L. J., Wang Z. F.,, 2019,(1), 69—75(李成, 王承健, 晋万军, 韩健利, 杨梅芳, 郜茜, 黄琳娟, 王仲孚. 高等学校化学学报, 2019,(1), 69—75)
[20] Dubois M., Gilles K. A., Hamilton J. K., Rebers P. A., Smith F.,, 1956,(3), 350—356
[21] Meseguer I., Aguilar V., González M. A. J., Martı́Nez C.,, 1998,(4), 285—291
[22] de Arcuri B. E. F., de Recondo M. E. F., Recondo E. F., Carbohydrate Research, 1980,(2), 165—176
[23] Levigne S., Thomas M., Ralet M. C., Quemener B., Thibault J. F.,, 2002,(6), 547—550
[24] Logtenberg M. J., Donners K. M. H., Vink J. C. M., van Leeuwen S. S., de Waard P., de Vos P., Schols H. A.,, 2020,(29), 7800—7808
[25] Sun R. C.,Hughes S.,, 1999,(3), 273—281
[26] Yapo B.M., Robert C., Etienne I., Wathelet B., Paquot M.,, 2007,(4), 1356—1364
[27] Buchholt H. C., Christensen T. M. I. E., Fallesen B., Ralet M. C., Thibault J. F.,, 2004,(2), 149—161
[28] Wang X., Chen Q. R., Lu X.,, 2014,, 129—137
[29] Guillotin S. E., Van Loey A., Boulenguer P., Schols H. A.,Voragen A .G. J.,, 2007,(1), 85—91
[30] Ognyanov M., Remoroza C., Schols H. A., Georgiev Y. N., Petkova N. T., Krystyjan M.,, 2020,, 115549
[31] Westphal Y., Schols H. A., Voragen A. G. J., Gruppen H.,, 2010,(5), 689—695
[32] Huang C. C., Yan J. Y., Zhan L. P., Zhao M., Zhou J. Y., Gao H. Y, Xie W. C., Li Y., Chai W. G.,, 2019,, 25—35
[33] Lee S. J., In G., Lee J. W., Shin K. S.,, 2021,, 13—22
[34] Palma A. S., Liu Y., Zhang H. T., Zhang Y. B., McCleary B. V., Yu G. L., Huang Q. L., Guidolin L. S., Ciocchini A. E., Torosantucci A., Wang D. N., Carvalho A. L., Fontes C. M. G. A., Mulloy B., Childs R. A., Feizi T., Chai W. G.,, 2015,(4), 974—988
[35] XIE B. Y., Yi L., Zhu Y. T., Chang X. M., Hao J., Pang L., Ouyang Y. L., Yuan S., Zhang Z. Q.,, 2021,, 117080
Combined PGC-Triple-Tof-MS Enables the Separation, Identification of Sugar Beet Pectin Derived Oligomers
ZHUKai1, LIJie1, WUXiaoyi1, HUWeiwei1, WUDongmei1, YUChengxiao1, GEZhiwei4, YEXinqian1,2,3, CHENShiguo1,2,3*
(,,,,,,310058,;,,310058,;,,315100,;,,310058,)
Sugar beet pectin(SBP) was extracted by high-temperature acid method, the water-eluted components(SBPW) and salt-eluted components(SBP3) were obtained by strong anion exchange chromatography. The results of monosaccharide composition and molecular weight analysis showed that SBPW was mainly composed of galactose(Gal), arabinose(Ara) and galacturonic acid(GalA), with a molecular weight of 1100, while SBP3 was dominated by GalA and weighted 41450. Combined sequential enzymatic degradation and porous graphitized carbon column-quadrupole-time-of-flight mass spectrometry(PGC-Triple-Tof MS), the fine structure of SPPW and SPP3 oligosaccharides was analyzed. The results showed that the main chain of SPBW was [→4)--GalA-(1→2)--Rha-(1→] repetitive units composed of RG-Ⅰ pectin, and neutral sugar side chain [-(1→5) arabinan and-(1→4) galactan] were substituted for Rha at the-4 position. SBP3 consisted of HG and RGⅠ with a molar of 3:2, HG was a linear structure of-1,4-linked GalA, HG and RG-Ⅰ domains were connected directly by-1,4 glycoside bonds. New characteristic structures of oligosaccharide have also been found, similar to-GalA(1→2)-Rha(1→4)-Rha(1→4)-GalA(1→2)-Rha.
Sugar beet; Pectin; Oligosaccharide; Structure analyses; Porous graphitized carbon column-Tandem mass spectrometry
O629.1
A
10.7503/cjcu20220023
2022-01-09
2022-02-16.
陈士国, 男, 博士, 教授, 主要从事碳水化合物功能研究,果蔬副产物可持续加工技术的研究. E⁃mail: chenshiguo210@163.com
浙江省重点研发项目(批准号:2021C02001)和浙江大学校级科研发展专项(批准号:2021FZZX001⁃54)资助.
the Zhejiang Province Key R & D Projects, China(No.2021C02001) and the Zhejiang University Scientific Research Development Project, China(No.2021C02001).
(Ed.: L, H, W, K)
