改性SnO2光催化剂的制备及其对罗丹明B降解行为研究
2022-07-18何子正李冬云葛洪良
何子正,徐 扬,李冬云,王 睿,葛洪良
(中国计量大学 材料与化学学院,浙江 杭州 310018)
随着城市的发展,人们在享受便捷生活的同时也在承受着水污染带来的风险与考验[1]。根据《2020年中国生态环境统计年报》,在调查统计的42个工业行业中,化学需氧量(chemical oxygen demand, COD)排放量排名前三的行业依次为纺织业、化学原料和化学制品制造业、农副食品加工业。纺织业的快速发展带来的染料污染较为严峻,而印染废水成分较为复杂,含有大量有机物,不仅对人体产生致癌作用,也会影响水中微生物的生存,降低水体的自净化能力。因此,治理印染废水具有重大现实意义[2-5]。
与传统的物理吸附沉降、微生物分解相比,光催化降解染料因其具有反应条件温和、操作简便、效率高及无二次污染等特点受到了广泛的研究[6-7]。其中,SnO2由于其优异的化学稳定性,无毒副作用且价格便宜受到了广泛的关注,在太阳能电池[8]、超级电容器[9]、气敏传感器[10]等领域已有广泛应用。在光催化领域,由于其优异的耐酸碱性,良好的光响应活性,使其具有成为优秀催化剂的潜力。但由于其宽带隙的特点(Eg=3.6 eV),且电子-空穴分离效率低,导致其可相应的波段为紫外光,从而限制了其应用[11]。为了提高SnO2的光催化效率,国内外学者做了多种改性研究,如构建异质结[12]、形貌调控[13]等,而掺杂金属离子[14-15]作为其中一种改性手段因制备工艺简单受到广泛关注。
基于此,本实验以碳微球为硬模板,通过溶剂热法及低温煅烧制备出空心SnO2微球,并对其进行In3+离子掺杂改性,在250 W高压汞灯的照射下,探究样品对于罗丹明B染料的光催化降解效率。
1 实验部分
1.1 实验试剂
葡萄糖(C6H12O6,AR)购自天津科密欧化学试剂有限公司,氯化铟(InCl3,AR)、二水合氯化亚锡(SnCl2·2H2O,AR)、罗丹明B(C28H31ClN2O3,AR)均购自上海麦克林生化科技有限公司,无水乙醇(C2H6O,AR)购自杭州高晶精细化工有限公司,去离子水使用净水设备自制得到。
1.2 样品的制备
1.2.1 碳微球的制备
称取5 g葡萄糖,溶于50 mL去离子水中,磁力搅拌20 min,将溶液转移至100 mL水热反应釜,烘箱180 ℃保温6 h。将反应产物离心,并用去离子水和无水乙醇交替清洗3次,放入烘箱中60 ℃干燥12 h,使用玛瑙研钵将碳块进行充分研磨后得到符合要求的碳微球模板[16]。
1.2.2 SnO2基纳米材料的制备
按照摩尔比分别称取SnCl2·2H2O与InCl3,溶解于40 mL无水乙醇中,充分搅拌直至溶液澄清,记为溶液A;称取适量的碳微球作为硬模板,超声分散于20 mL无水乙醇,处理20 min,记为溶液B。将溶液A与溶液B混合,磁力搅拌30 min,将溶液转移至反应釜中,烘箱180 ℃保温4 h。将反应产物离心,并用去离子水和无水乙醇交替清洗3次,放入烘箱中60 ℃干燥12 h,使用玛瑙研钵充分研磨后,将产物550 ℃煅烧10 min后得到空心SnO2材料[17]。
实心球制备方法与之相似,制备时不再添加碳微球模板,直接将金属盐溶解于60 mL无水乙醇,充分搅拌混合均匀后,将前体溶液倒入100 mL水热反应釜中,180 ℃保温4 h。将白色沉淀离心分离,干燥研磨后得到实心SnO2颗粒。
1.3 材料表征
采用X射线衍射仪(Smart Lab SE,HITACHI,日本)进行相组成表征,以Cu Kα谱线为射线源(λ=0.154 18 nm),扫描电压为40 kV,扫描电流为30 mA,步长0.02°,衍射角2θ的范围是10°~90°;采用场发射扫描电镜(SU 8010,HITACHI,日本)对材料进行形貌表征;使用同步热分析仪(PE,NETZSCH,德国)对材料的热稳定性进行表征,在空气气氛下,25 ℃至950 ℃范围内进行样品热行为表征,升温速率为10 ℃/min;使用分光光度计(U-4100,HITACHI,日本)进行吸收光谱表征。
1.4 光催化性能测试
将制备好的材料各取出30 mg,添加到体积50 mL,质量浓度10 mg/L的RhB溶液中,暗室环境下磁力搅拌1 h,使之达到吸附脱附平衡。以中心波长为365 nm,功率为250 W的汞灯作为光源,前1 h内每20 min取出3 mL溶液,随后每30 min取出3 mL溶液,离心处理,将上层清液分离取出,使用分光光度计进行吸光度检测,判断RhB的降解程度,检测范围是450~600 nm。使用罗丹明B的最大吸收波长(λ=554 nm)的吸光度计算降解率,计算公式如下[18]:
其中:C0是光降解前RhB溶液质量浓度,C是降解t时刻的RhB溶液质量浓度;A0是初始RhB溶液的吸光度,A是降解t时刻RhB溶液吸光度。
2 结果与讨论
2.1 催化剂的热稳定性分析
当SnO2通过溶剂热包覆在碳微球表面后,为除掉碳微球模板,需确定最低的煅烧温度,对C@SnO2进行TG-DSC测试,具体结果见图1。

图1 C@SnO2粉体的TG-DSC曲线
从图中看出,材料的质量损失分两个阶段,质量开始损失温度分别在30 ℃和270 ℃。在100 ℃以下区间,质量的损失比例为5.72%,这是乙醇和水的挥发造成的,具体原因为C@SnO2在干燥时产生结块,结块内部干燥不彻底,有部分无水乙醇残留,且试样进行研磨后由于表面积大,表面吸附了空气中的水[19];第二阶段根据外推法可以得到,质量开始损失的温度为270 ℃,并一直持续到550 ℃,质量损失比例达到59.78%,分别存在347 ℃和460 ℃的放热峰,347 ℃的吸热峰认为是二次脱水以及样品稠密化引起[20],460 ℃的吸热峰可认为是有机碳微球模板燃烧与分解产生CO2的过程[17];在550 ℃之后试样质量几乎没有发生变化,DSC曲线也没有明显的吸放热峰。因此认为,在550 ℃时,碳微球已经全部除去且SnO2结晶过程也在此之前完成。由此可以确定,煅烧的最低温度为550 ℃。
2.2 材料的形貌表征
2.2.1 不同种类球体的形貌
对制备出的各类样品进行SEM检测,结果如图2。从图2(a)中可以看出,碳微球的直径在200 nm左右,分散性良好。添加金属盐后,溶剂热产物形貌与碳微球差别不大,直径也类似,由于使用水热法制备的碳微球表面含有羟基与羰基基团,有利于金属阳离子吸附到碳微球表面,同时碳微球为Sn2+的结晶提供了成核位点,可减少成核势垒[17],见图2(b);550 ℃煅烧10 min以制得的SnO2空心球直径在200~300 nm,由于粒径过小且经历煅烧过程,空心微球的表面能较大,因此存在一定程度的团聚现象。而中间的破损可以证明材料的中空结构形貌。产生破损的原因可能是由于在煅烧加热时碳微球体积膨胀,受热不均匀产生的,或是在水热加热时由于碳微球的聚集导致此处并没有晶核产生沉积[17],见图2(c)。实心SnO2球体,直径分布在500~700 nm,见图2(d)。

图2 不同样品的SEM图
2.2.2 碳微球使用量对空心SnO2形貌的影响
为确定最佳的碳微球与金属盐的比例,得到形貌均一的空心球,固定金属盐为0.45 mmol,分别添加质量为0.1~0.4 g的碳微球作为模板剂进行制备空心SnO2基材料,结果见图3所示。从图中观察到,所有的样品均含有直径在200~300 nm之间的球体,不同的是,当碳微球的使用量为0.1 g时,样品中含有数量较多的直径在微米级的大球,见图3(a)。推测是由于碳微球的数量不足,使得Sn2+离子在碳微球表面形成晶核的数量有限,或溶液中Sn2+离子的浓度过高,使Sn2+离子在溶液中自身形成晶核,进而进行生长导致[20]。当碳微球添加量为0.2 g时直径在微米级的大球数量明显减少;继续添加碳微球模板,当质量达到0.3 g时,产生大球的现象明显好转,样品中只存在个别微米级的球体,所制备的样品几乎全部为直径在200~300 nm的纳米球体。

图3 不同碳微球模板数量制备的SnO2中空微球SEM图
与之前规律不同的是,继续添加碳微球数量至0.4 g后,微米球的数量并没有进一步减少直至消失,最后的结果与0.3 g时类似,推测这是由于Sn2+离子的浓度偏高导致其在溶液中自发成核[21]。综合实验结果来看,在金属原子摩尔数为4.5 mmol时,选取0.3 g碳微球作为模板剂使用。
2.3 XRD分析
碳微球的XRD结果如图4(a),可以看出整个衍射谱并没有特征衍射峰的存在,只有一个非晶态的“馒头峰”。因此,水热反应后得到的碳微球并没有发生结晶,得到的是无定形碳或者为高分子聚合物[22]。图4(b)为SnO2包覆碳微球样品的XRD衍射图谱,可以看出,材料的结晶度很差,这可能是由无定形的碳微球所引起,但从图中几个宽化的衍射峰看出,这些峰位与SnO2标准卡(PDF#41-1445)基本对应,因此可以判断此次溶剂热反应合成出了SnO2。

图4 不同样品的XRD图
另对实心SnO2球,空心SnO2球以及In3+掺杂的空心SnO2进行XRD表征,结果见图4(c),所有样品均显示生成良好的四方金红石型SnO2,与标准卡对应一致。其中In3+离子掺杂样品的XRD图谱也表现出SnO2的晶相,并未有与In元素相关物质的衍射峰,表明In3+离子以掺杂离子的形态进入了SnO2的晶格中[23]。
2.4 光催化活性测试

图5 光催化测试吸收光谱图
分别称取30 mg SnO2实心球、SnO2空心球与In3+掺杂SnO2空心球,加入至50 mL,质量浓度为10 mg·L-1的RhB溶液,暗环境中磁力搅拌1 h,使达到吸附脱附平衡,光源为中心波长365 nm的汞灯,按照一定时间要求取样3 mL至离心管中,离心后将上清液小心取出,使用分光光度计进行表征,具体结果如图5所示。随着催化时间的增加,3种样品的吸收峰强度均逐渐下降,同时,以纯SnO2作为催化剂的RhB特征吸收峰发生了蓝移,4 h内,最大吸收峰由554 nm移至543 nm。与之不同的是,In3+离子掺杂后,RhB的特征吸收峰蓝移幅度更大,由554 nm转移至535 nm。这是由于RhB有两种光降解路径,其一为整个共轭发色团结构的裂解,其二为N-脱乙基化[24]。第一条路径主要由体系中的活性物质,将RhB直接降解为CO2、H2O等最终产物,主峰位置保持不变,而强度降低。在具有N-去乙基化的第二条途径中,主峰位置会根据以下物质吸收最大值逐渐蓝移:RhB,554 nm;N,N,N-三乙基罗丹明,539 nm;N,N-二乙基罗丹明,522 nm;N-乙基罗丹明,510 nm;罗丹明,498 nm[25]。在大多数情况下,这两种降解途径共存并竞争。结合实验数据,作者认为SnO2对RhB的降解路径以第一种为主,而In3+离子的掺杂一定程度上促进了第二条降解路径的发生,但由于吸收峰的蓝移程度有限,N-脱乙基的作用效果并不明显,仍可认为In3+改性后的样品仍以第一条降解路径为主。

图6 不同样品降解率随时间变化曲线
由图6为不同样品降解率随时间变化曲线。从图中可以看出,空白样品的降解幅度极低,可认为RhB仅在汞灯照射、未加催化剂的条件下基本不发生降解。汞灯照射4 h后实心SnO2的降解率为76.7%,而空心SnO2的降解率为81.6%,这是由于空心SnO2的比表面积较大导致的,但掺杂In3+离子的空心SnO2球体降解率更高,达到91.8%。添加的SnO2催化剂在受到紫外光照射后,由于紫外光的光子能量大于其禁带宽度,位于价带中的电子被激发,一部分跃迁至导带,在价带形成数量相等的空穴,产生光生电子-空穴对[26]。部分氧化还原电势较高的电子和空穴转移至材料表面,并与环境中的H2O发生反应,形成活性较高的·OH和·O2-,从而对RhB产生降解效果[27]。
由于In3+对Sn4+的不等价掺杂使得材料中产生更多的氧空位,降解时有更多的反应位点,根据Kroger-Vink表示法,产生氧空位的缺陷方程如下:
In2O3↔2In′Sn+V··o+3Oo。
而氧空位被认为可以增强对紫外线的吸收[28],这对RhB的降解是有益的。
另外,掺杂使得SnO2的禁带中形成掺杂能级,可改善催化剂对光子的吸收能力,产生的陷阱能级可提高对电子和空穴的捕获,抑制光生载流子的复合,进而提高光生载流子的分离效率。掺杂空位和缺陷态会充当电子和空穴的复合中心,掺杂剂随着其缺陷状态的增加而使材料的带隙变窄,进而对光源有更高的利用率,这些空位和缺陷状态被认为可以增强光催化活性[29]。
图7显示的是不同样品对RhB溶液降解的一阶动力学模型拟合曲线。具体计算如下[4]:
ln(C/C0)=-kt。
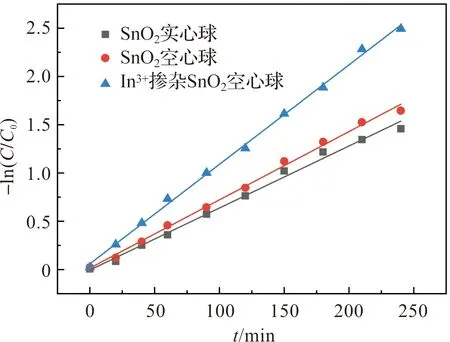
图7 不同样品的降解动力学曲线图
其中:C为不同降解时间t时刻的RhB溶液浓度,C0为初始RhB溶液浓度,k(min-1)为降解速率常数。计算结果显示,In3+掺杂SnO2空心球具有最大的k值,具体结果为k(SnO2实心球)=0.006 4 min-1,k(SnO2空心球)=0.007 1 min-1,k(In3+掺杂SnO2空心球)=0.010 3 min-1,所有的拟合数据的R2均大于0.99,拟合优度较高,计算结果具有可信度。
3 结 语
本研究以SnO2为研究对象,探究了以碳微球为硬模板制备SnO2空心球的工艺,并通过热分析确定去除模板的最低温度为550 ℃;4.5 mmol金属盐与0.3 g碳模板达到的匹配度最佳,制备的SnO2实心球、空心球以及In3+离子掺杂的空心球均显示出良好的四方金红石相;3种材料均对RhB溶液产生降解作用,4 h的降解率均超过70%,2种空心结构材料降解率大于SnO2实心球,而In3+离子的引入,使得材料中的氧空位增多,4 h对RhB溶液的降解率达到91.8%。
