外周血清NLRP3、HMGB1水平与急性ST段抬高型心肌梗死患者PCI术后缺血再灌注损伤的关系
2022-07-18左文霞刘彬黄园琴肖红艳
左文霞,刘彬,黄园琴,肖红艳
急性ST段抬高型心肌梗死(ST-elevation myocardial infarction,STEMI)为冠状动脉不稳定斑块破裂、糜烂、侵蚀和内皮损伤基础上继发血栓形成而导致的急性心肌缺血性坏死(acute myocardial ischemic necrosis,AMIN),经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)为STEMI再灌注的主要方法之一,能及时开通梗死相关动脉,改善患者预后[1-2]。但PCI术后血液重新灌注可能进一步加剧缺血心肌损伤,称为心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI),影响患者预后[3]。MIRI病理机制复杂,炎性反应、细胞焦亡和细胞凋亡等在其发生发展中发挥重要作用[4-5]。核苷酸寡聚化结构域样受体热蛋白结构域相关蛋白3(nucleotide oligomerization domain-like receptor thermal protein domain associated protein 3,NLRP3)是一种大分子蛋白复合体,激活后能募集炎性因子和诱导细胞焦亡[6]。高迁移率族蛋白B1(high mobility group protein B1,HMGB1)是一种高度保守的染色体结合蛋白,能结合多条信号通路诱导炎性细胞聚集和促进细胞凋亡[7]。体外研究发现,NLRP3、HMGB1在大鼠MIRI模型梗死区域表达上调[8-9]。为此。现分析行PCI的STEMI患者外周血清NLRP3、HMGB1水平变化趋势及与MIRI的关系,以期为防治PCI术后MIRI提供参考,报道如下。
1 资料与方法
1.1 临床资料 选取2020年1月—2021年7月武汉亚洲心脏病医院ICU收治接受PCI的STEMI患者165例,男127例,女38例,年龄31~85(62.22±11.23)岁;体质量指数18~29(24.51±3.05)kg/m2;Killip分级:Ⅰ级123例,Ⅱ级24例,Ⅲ级8例,Ⅳ级10例。根据PCI术后48 h内是否发生MIRI分为MIRI组103例和非MIRI组62例。本研究经医院伦理委员会批准(2021-申报041),患者及家属均知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①符合“ST段抬高型心肌梗死基层诊疗指南(2019年)”[10]诊断标准;②年龄≥18岁;③发病至入院时间<12 h;④临床资料完整者。(2)排除标准:①PCI禁忌证者;②既往心脏移植术、冠状动脉搭桥术者;③PCI术中或术后24 h内死亡者;④近2周内有活动性感染者;⑤脑梗死、恶性肿瘤、血液系统疾病、严重肝肾功能不全者。
1.3 观测指标与方法
1.3.1 临床资料收集:通过电子病历系统收集患者临床资料,包括性别、年龄、体质量指数、病史、罪犯血管、Killip分级、发病至入院时间、血压、用药情况、住院天数,并统计住院期间心血管不良事件(恶性心律失常、心源性休克、左心室功能障碍猝死等)发生率。
1.3.2 心、肾功能及血脂指标检测:患者入院后6 h内采集静脉血6 ml,采用迈瑞BS-830全自动生化分析仪检测心肌肌钙蛋白I(cTnI)、B型脑钠肽(BNP);迈瑞BS-280彩色多普勒超声诊断仪测定左心室射血分数。 采集患者入院后次日清晨空腹肘静脉血5 ml,采用迈瑞BS-830全自动生化分析仪检测血脂[总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)]和肾功能指标[血尿素氮(BUN)、血肌酐(SCr),肾小球滤过率(eGFR)=[186×SCr(μmol/L)]-(1.154×年龄)-0.203,女性再×0.742]。
1.3.3 外周血清NLRP3、HMGB1水平检测:采集PCI术前、术后即刻和术后24 h外周血3 ml,置于-80℃冰箱中保存,采用ELISA法检测外周血清NLRP3、HMGB1水平,试剂盒购自上海梵态生物科技有限公司,所有操作严格按照试剂盒说明书进行。
1.4 MIRI诊断标准[11]冠状动脉血管开通后发生频发室性期前收缩、心动过缓、低血压,药物治疗和/或电复律、电除颤治疗后,仍有严重室性心律失常,且术后冠状动脉造影提示冠状动脉前向血流心肌梗死溶栓试验分级≤2级,不合并血栓、夹层、痉挛。

2 结 果
2.1 2组临床资料比较 MIRI组患者年龄、罪犯血管为右冠状动脉、Killip分级、BUN、SCr、BNP、住院天数、心血管不良事件发生率均高于非MIRI组,收缩压、舒张压、eGFR、ACEI/ARB/ARNI使用比例低于非MIRI组,差异有统计学意义(P<0.05),见表1。

表1 MIRI组与非MIRI组临床资料比较
2.2 2组不同时间点外周血清NLRP3、HMGB1水平比较 术前血清NLRP3、HMGB1水平MIRI组高于非MIRI组;术后即刻2组均降低,MIRI组高于非MIRI组;术后24 h 2组均再升高,且MIRI组高于非MIRI组(P<0.05),见表2。
表2 MIRI组与非MIRI组不同时间点外周血清NLRP3、HMGB1水平比较
2.3 影响STEMI患者PCI术后MIRI的多因素Logistic逐步回归分析 以MIRI为因变量(是=1,否=0),以年龄、左回旋支(是=1,否=0)、右冠状动脉(是=1,否=0)、Killip分级(≥Ⅱ级=1,<Ⅱ级=0)、收缩压、舒张压、血尿素氮、血肌酐、eGFR、B型脑钠肽、使用ACEI/ARB/ARNI(是=1,否=0)、住院天数和术前外周血清NLRP3、HMGB1水平为自变量,建立多因素Logistic逐步回归模型,结果显示,年龄大、罪犯血管为右冠状动脉、BNP高、NLRP3高、HMGB1高为STEMI患者PCI术后MIRI危险因素,收缩压、舒张压高为保护因素(P<0.05),见表3。
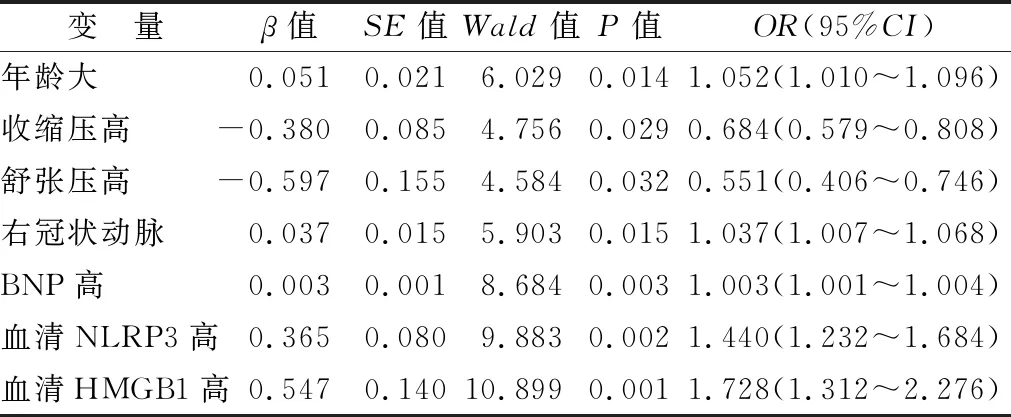
表3 STEMI患者PCI术后MIRI影响因素的多因素逐步Logistic回归分析
2.4 外周血清NLRP3、HMGB1水平预测STEMI患者PCI术后发生MIRI的价值 ROC曲线显示,血清NLRP3联合HMGB1预测STEMI患者PCI术后MIRI的AUC大于NLRP3、HMGB1单独预测(Z=2.297、3.149,P=0.022、0.002),见表 4、图1。
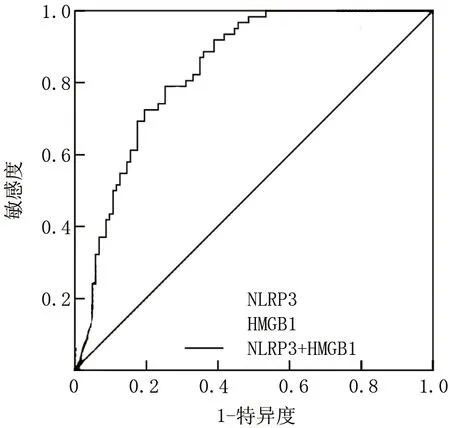
图1 外周血清NLRP3、HMGB1水平预测STEMI患者PCI术后MIRI的ROC曲线
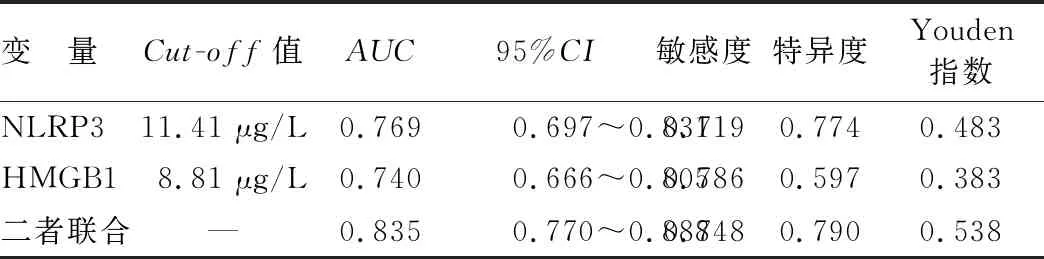
表4 外周血清NLRP3、HMGB1水平预测STEMI患者PCI术后发生MIRI的价值比较
3 讨 论
MIRI是指短时间内心肌血供中断,一定时间内恢复血供后原有缺血心肌出现较缺血时更严重的损伤,STEMI患者PCI后发生MIRI可引起恶性心律失常、心源性休克、左心室功能障碍甚至猝死等重大心血管事件,严重影响患者预后[12]。本研究结果也显示,与非MIRI组比较,MIRI组住院期间心血管不良事件发生率显著增加,住院天数显著延长。分析MIRI患者临床特征可能为防治MIRI提供更多有利信息,本研究结果显示,年龄大、罪犯血管为右冠状动脉、BNP高为STEMI患者PCI术后MIRI独立危险因素,收缩压、舒张压高为独立保护因素。有证据显示,随着年龄增大,衰老能通过增加线粒体功能障碍和内质网应激敏感度加重MIRI[13]。BNP主要由心脏分泌,在心室压力负荷增加或容量扩张时刺激分泌,BNP水平升高说明心肌受损严重,因此在PCI术后更易出现MIRI。研究指出,右冠状动脉闭塞能抑制传导系统和兴奋迷走神经,心脏活动的起源和/或传导系统障碍可导致心律失常,迷走神经兴奋能阻断交感神经作用,减少神经递质释放,引起血压降低,因此罪犯血管为右冠状动脉时常表现出低血压和心律失常,会增加MIRI风险[11]。本研究中MIRI组血压显著降低,并且收缩压、舒张压高为STEMI患者PCI术后MIRI独立保护因素,分析也与罪犯血管为右冠状动脉有关,同时低血压可能减少主动脉供血,导致心脏供血减少,引起MIRI,因而MIRI组降低血压类药物ACEI/ARB/ARNI的使用比例更低。MIRI发病机制复杂,与炎性反应、细胞焦亡、细胞凋亡等密切相关,目前尚无可靠的指标能预测PCI术后MIRI发生,寻找MIRI新靶标是亟需解决的问题。
细胞焦亡是一种炎性程序性细胞死亡方式,特征为细胞不断膨大直至破裂,细胞内容物释放可引起强烈炎性反应,细胞焦亡高度促炎性在MIRI病理过程中发挥重要作用[5]。NLRP3炎性小体是由NLRP3、含半胱氨酸的天冬氨酸蛋白水解酶-1(cysteinyl aspartate specific proteinase-1,Caspase-1)、凋亡相关微粒蛋白组成的一种大分子蛋白复合体,当NLRP3被激活,其N-末端的效应结构域能募集Caspase-1和凋亡相关微粒蛋白的前体,形成NLRP3炎性小体,通过内源性或外源性损伤相关分子模式完成自身组装活化,介导无菌炎性反应[6]。Caspase-1、Caspase-4/5/11 途径是细胞焦亡的主要信号通路,而NLRP3作为下游Caspase家族成员的激活平台,能通过促进炎性因子的转录生成和激活炎性复合物介导细胞焦亡过程[14]。Bian等[15]建立心肌梗死小鼠模型发现,心肌梗死后NLRP3炎性小体激活,能活化白介素-1β、白介素-18等炎性因子,扩大梗死面积和恶化心功能。在MIRI大鼠模型中,NLRP3表达上调能诱发心肌细胞焦亡加重MIRI,沉默或抑制NLRP3表达能降低心肌炎性反应和心肌细胞焦亡,缩小心肌梗死面积[16-17]。细胞凋亡是由基因调控的主动死亡过程,与钙超载、线粒体损伤等有关,缺血再灌注的心肌组织存在典型的凋亡形态和DNA梯状电泳改变,导致心肌细胞凋亡[18-19]。HMGB1几乎在所有真核细胞的细胞核中存在,由死亡细胞被动释放到胞外,胞外HMGB1能结合Toll样受体4和晚期糖基化终产物受体产生核因子-κB,形成炎性反应通路,加剧组织损伤[7]。同时HMGB1还可通过激活c-jun氨基末端激酶通路和激活Caspase级联反应,诱导细胞凋亡[20]。体外研究显示,HMGB1在大鼠心肌梗死区域内大量表达,HMGB1高表达与MIRI发生密切相关,抑制HMGB1表达能恢复大鼠MIRI功能指数,缓解心肌炎性反应,减少心肌细胞凋亡,缩小梗死面积[21-22]。尽管近年来多项实验探究了NLRP3、HMGB1与心肌梗死后MIRI的关系,但关于STEMI患者PCI术后MIRI患者外周血清NLRP3、HMGB1水平变化尚无研究报道。本研究结果显示,2组患者术前、术后即刻、术后24 h外周血清NLRP3、HMGB1水平均表现为先降低后升高,且2组不同时间点外周血清NLRP3、HMGB1水平变化趋势存在差异。说明2组患者在PCI术后开通血管后外周血清NLRP3、HMGB1水平降低,但MIRI组因术前外周血清NLRP3、HMGB1水平更高心肌损伤更严重,在PCI术后即刻外周血清NLRP3、HMGB1水平虽然有所降低,却还是高于非MIRI组;术后24 h时2组患者因缺血心肌得以恢复血供,但同时又增加了缺血心肌组织损伤,因此外周血清NLRP3、HMGB1水平再次显著升高,MIRI组因缺血心肌组织损伤更严重,所以外周血清NLRP3、HMGB1水平升高较非MIRI组更为明显,这也是2组患者不同时间点外周血清NLRP3、HMGB1水平变化趋势不一致的原因。本研究进一步分析显示,术前外周血清NLRP3、HMGB1水平升高是STEMI患者PCI术后MIRI独立危险因素,预测MIRI发生的AUC分别为0.769、0.740,进一步说明血清NLRP3、HMGB1参与MIRI发生,并可作为MIRI发生预测指标。结果还显示,血清NLRP3联合HMGB1预测STEMI患者PCI术后MIRI的AUC显著增加,达到了0.835,说明联合检测外周血清NLRP3、HMGB1水平能提升MIRI预测价值。
综上所述,PCI术后发生MIRI的STEMI患者外周血清NLRP3、HMGB1水平升高,为MIRI发生的独立危险因素,可作为PCI术后MIRI预测指标。但本研究为单中心小样本量研究,存在一定的选择偏倚;同时本研究采用临床表现作为MIRI诊断标准,未通过冠状动脉血流储备或心脏磁共振成像进一步确诊,因此本研究结果可能与实际结果存在差异;最后本研究未对患者进行随访,评估外周血清NLRP3、HMGB1水平与患者远期预后的关系。
利益冲突:所有作者声明无利益冲突
作者贡献声明
左文霞:提出研究方向,设计研究思路,实施研究过程,数据收集、分析,论文撰写、修订及终审;刘彬:设计研究方案、研究流程,起草论文,修订论文,论文终审;黄圆琴:实施研究过程,数据收集,分析整理,进行文献调研与整理;肖红艳:进行文献调研与整理
