伊立替康活性代谢物SN38对皮肤鳞状细胞癌细胞坏死性凋亡的调节机制
2022-07-18王佳雯朱君
王佳雯 朱君
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,CSCC)是人类常见的皮肤肿瘤,约占所有非黑素细胞皮肤癌的20%[1],在老年人中更常见,多发生在头面部、外阴和外生殖器区域,治疗以手术切除、激光、冷冻和放疗为主[2]。SN38是伊立替康的活性代谢物,其类似的药效机制与5-氟尿嘧啶(5-FU)、奥沙利铂相似,均可以引起DNA损伤的反应,被认为是决定细胞死亡或存活的结果[3-5]。坏死和凋亡是细胞死亡的两种主要形式,坏死在传统意义上通常被认为是一个“非程序性”的细胞死亡过程,但最近研究发现它也可以通过一种称为坏死或程序性坏死的机制发生[6]。与细胞凋亡不同,坏死不是由胱门蛋白酶介导的,但可以被RIP1的特异性小分子抑制剂Necrostatin-1(NEC-1)抑制,通过作用于蛋白丝氨酸(RIP1)和苏氨酸激酶(RIP3)的激酶部分,引发RIP1激酶的二聚化,抑制激酶活性,阻断RIP1和 RIP3的相互磷酸化。坏死可由活性氧(reactive oxygen species,ROS)、细胞因子、烷基化DNA损伤或照射触发,并通过独特的信号通路受体相互作用RIP1/RIP3执行[7-8],在与肿瘤坏死因子相关的细胞凋亡诱导配体诱导的坏死中,聚(ADP-核糖)聚合酶-1(PARP-1)也可作为RIP1/RIP3的下游效应因子。越来越多的证据表明,坏死调节因子的遗传或表观遗传调控发生在癌症中,并与患者的临床结果相关[8]。该研究旨在探讨伊立替康活性代谢物SN38对CSCC细胞A431坏死性凋亡的调节机制。
1 材料与方法
1.1 细胞培养 人CSCC细胞A431购自南京科陌生物科技有限公司,采用RMPI-1640培养液和10% 胎牛血清(Thermo Fisher Scientific,美国)在37 ℃、5% CO2细胞培养箱中培养。
1.2 细胞转染 将对数期生长的A431细胞使用6孔
板进行细胞铺板,待细胞融合度达到70%左右时参照Lipofectamine 2000转染试剂(Thermo Fisher Scientific,美国)说明书将shRIP3或shRNA转染A431细胞(System Biosciences,CA,美国):(1)将A431细胞用胰酶消化,以1,000 r/min离心5 min,洗涤后采用RMPI-1640培养液重悬,置于24孔板中培养过夜,每孔5×104个;(2)将shRIP3或shRNA转染A431细胞48 h后收集假病毒颗粒;(3)用聚烯(8μg/mL)存在下的假病毒颗粒感染A431细胞,用嘌呤霉素选择48 h以稳定shRIP3或shRNA表达。通过RT-PCR法证实了RIP3基因的敲低。用免疫荧光检测shRIP3转染效率。
1.3 细胞增殖试验 采用噻唑蓝比色法测定人CSCC细胞增殖能力。将对数期生长细胞使用96 孔板进行铺板,随后分别使用伊立替康和伊立替康加NEC-1干预,随后连续4 d每天每孔加入16μL MTT(5 mg/mL),在细胞培养箱中孵育4 h弃去上清液,添加150μL二甲亚砜溶解沉淀,常温摇床放置20 min,最后通过酶标仪测定各孔480 nm波长时的吸光度。
1.4 细胞凋亡试验 采用流式细胞仪技术检测细胞凋亡。将对数期生长细胞使用6 孔板进行铺板,随后分别使用伊立替康和伊立替康加NEC-1干预。待干预48 h后,参照 AnnexinV FITC试剂盒(BD,美国)说明书处理各组细胞,随后采用流式细胞仪技术测定各组细胞凋亡率。
1.5 蛋白质印迹法 将对数期生长细胞使用6孔板进行铺板,随后分别使用伊立替康和伊立替康加NEC-1干预。待干预48 h 后,将收集好的细胞参照RIPA裂解液说明书提取总蛋白,定量、变性,制备凝胶,每孔上样量40 μg,常规电泳、转膜、封闭,抗RIP抗体(1∶1,000)(Abcam,美国),抗RIP3抗体(1∶1,000)(Abcam,美国)及抗GAPDH抗体(1∶2,000),4 ℃孵育过夜,第2天使用相应二抗室温孵育1 h后,ECL发光液处理后暗室内曝光胶片,扫描结果保存。
1.6 统计学方法 采用SPSS 19.0统计软件。所有实验均独立重复3次,计量资料符合正态分布以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t法。以P<0.05为差异有统计学意义。
2 结果
2.1 NEC-1对SN38干预A431细胞增殖的影响 SN38组A431细胞增殖率低于正常对照组,而SN38+NEC-1组A431细胞增殖率高于SN38组,但仍较正常对照组低,差异有统计学意义(P<0.05),提示SN38可以抑制A431细胞增殖,使用RIP1的特异性小分子抑制剂NEC-1干预后可降低A431细胞对SN38的敏感性,从而导致细胞增殖能力增加。见图1。

图1 NEC-1对SN38干预A431细胞增殖的影响
2.2 NEC-1对SN38干预A431细胞凋亡水平的影响 正常对照组A431细胞凋亡率为(4.02±0.04)%,SN38组A431细胞的凋亡率为(19.00±2.06)%,而SN38+NEC-1组A431细胞凋亡率为(11.37±1.67)%,组间差异有统计学意义(P<0.05),提示SN38可以促进A431细胞凋亡,使用RIP1的特异性小分子抑制剂NEC-1干预后可降低SN38对A431细胞的凋亡水平。见图2。

图2 NEC-1对SN38干预A431细胞凋亡水平的影响
2.3 NEC-1对SN38干预A431细胞坏死性凋亡蛋白水平影响 SN38组RIP1/RIP3蛋白表达量较正常对照组明显增加,SN38+NEC-1组RIP1/RIP3蛋白表达量较SN38组明显降低,差异有统计学意义(P<0.05),提示SN38可特异性影响RIP1/RIP3蛋白表达水平。见图3。
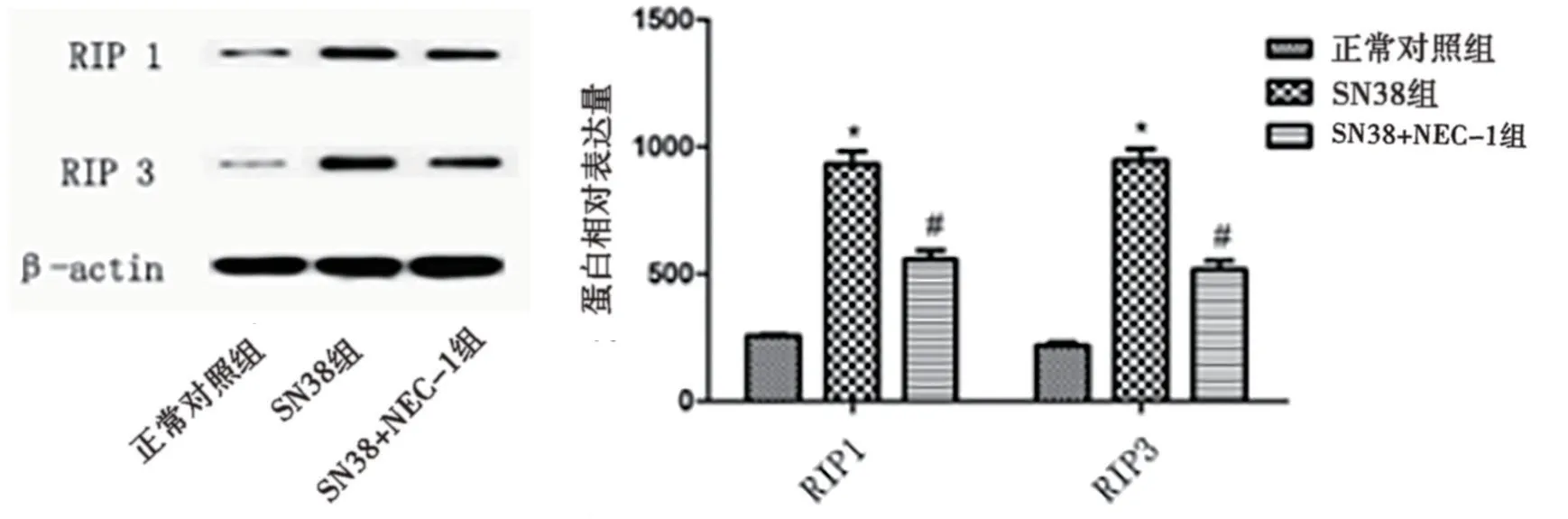
图3 NEC-1对SN38干预A431细胞坏死性凋亡蛋白水平的影响
2.4 NEC-1对SN38干预A431细胞坏死性凋亡下游效应蛋白的影响 SN38组PARP-1蛋白较正常对照组明显增高,SN38+NEC-1组PARP-1蛋白较SN38组明显降低,差异有统计学意义(P<0.05),提示SN38可影响PARP-1蛋白表达水平。见图4。

图4 NEC-1对SN38干预A431细胞坏死性凋亡下游效应因子的影响
2.5 转染shRNA和shRIP3效率的免疫荧光检测 空白对照组未见到荧光染色,SN38+shRNA组(空载体组)可以见到细胞内出现免疫荧光,SN38+shRIP3组细胞内也出现免疫荧光。见图5。

图5 shRNA和shRIP3转染效率的免疫荧光(×40)
2.6 shRIP3对SN38干预A431细胞坏死性凋亡蛋白水平的影响 SN38+shRIP3组RIP1/RIP3蛋白表达量较SN38组明显降低,而SN38+shRNA组与SN38组比较差异有统计学意义(P<0.05),提示SN38可特异性影响RIP1/RIP3蛋白表达水平。见图6。

图6 shRIP3对SN38干预A431细胞坏死性凋亡蛋白水平的影响
2.7 shRIP3对SN38干预A431细胞凋亡水平的影响 正常对照组的细胞凋亡率为(0.23±0.03)%,SN38组A431细胞的凋亡率为(11.60±2.52)%,而SN38+shRIP3组A431细胞凋亡率为(5.58±0.85)%,组间差异均有统计学意义(P<0.05),提示SN38可特异性影响RIP1/RIP3蛋白表达水平促进A431细胞凋亡。见图7。

图7 shRIP3对SN38干预A431细胞凋亡水平的影响
2.8 shRIP3对SN38干预A431细胞坏死性凋亡下游效应蛋白的影响 SN38组PARP-1蛋白表达量较正常对照组明显增高,SN38+shRIP3组PARP-1蛋白较SN38组明显降低,差异有统计学意义(P<0.05),见图8。提示SN38可影响PARP-1蛋白表达水平。

图8 shRIP3对SN38干预A431细胞坏死性凋亡下游效应蛋白的影响
3 讨论
CSCC是一种起源于角质形成细胞的皮肤癌,具有很强的转移潜能[11]。年龄、种族、暴露于紫外线辐射、阳光敏感的皮肤和免疫抑制是CSCC的典型危险因素[12]。在大多数情况下,非转移性CSCC可以通过手术切除来治愈。然而,转移性、复发性、不可切除的CSCC病例仍需要新的治疗策略和药物。
SN38是伊立替康的活性代谢物,是一种广泛应用的拓扑异构酶I抑制剂,通过促进坏死的进展,抑制细胞增殖,诱导DNA损伤积累,并且这种损伤所导致的TNF/TNFR信号通路介导的细胞毒性使SN38诱导的RIP1激活和坏死对结直肠癌有治疗作用[13]。目前,对伊立替康耐药或敏感性的基础仍未明确,因此有必要确定识别易感患者和逆转耐药的策略[14-16]。最近有研究发现,这种耐药性可能与代谢改变有关,包括ATP柠檬酸裂解酶的上调、AKT通路的激活[15]、p38MAPK通路的上调[16]和肿瘤缺氧[17],使用各种信号抑制剂的试验正在进行中。本研究发现,SN38干预的A431细胞增殖能力下降,凋亡水平增高,可能是与SN38诱导的RIP1/RIP3信号通路激活有关,聚(ADP-核糖)聚合酶-1(PARP-1)作为RIP/RIP3的下游效应因子也随之被激活。
坏死是一种具有坏死形态的程序性细胞死亡,发生在多种生物过程中,包括炎症、免疫反应、胚胎发育和代谢异常。目前,普遍将坏死定义为由受体相互作用的RIP1/RIP3的信号转导介导的细胞死亡,大量研究强调了RIP1/RIP3在癌症中的作用[18]。CHEN等[17]研究发现,坏死是应对严重应激和阻断细胞凋亡的关键细胞杀伤机制,并提出它可以作为一种替代的细胞死亡方案来预防癌症。既往研究表明,RIP3表达的增加与癌症的发展相关,包括结肠癌、肺癌、鼻咽癌、非霍奇金淋巴瘤[19-20]。本研究发现,应用坏死性凋亡抑制剂或者基因沉默RIP3(shRNA RIP3)可使A431细胞对伊立替康耐药性增加,说明在一定程度上A431细胞对伊立替康的耐药性是由于抑制坏死性凋亡实现的,激活坏死性凋亡信号通路可能增加A431细胞对伊立替康化疗的敏感性。
综上所述,伊立替康活性代谢物SN38对可抑制A431细胞增殖,使其凋亡水平增加,可能是由SN38诱导RIP1/RIP3/PARP-1信号通路实现的,而当坏死性凋亡信号通路受到抑制时,A431细胞对SN38的敏感性降低,使其耐药性增强。因此,激活坏死性凋亡信号通路可能是治疗CSCC的潜在靶点,为临床上CSCC的耐药提供了新的治疗思路。
