L3骨骼肌质量指数在胃癌患者营养风险评估及术后并发症的应用价值
2022-07-18裴大兵张翼臻张海平卢荣丁小兵张旭华
裴大兵 张翼臻 张海平 卢荣 丁小兵 张旭华
[摘要] 目的 探討L3骨骼肌质量指数在胃癌患者营养风险评估及术后并发症的应用价值。方法 回顾性分析选择2018年7月~2021年7月井冈山大学附属医院收治的92例胃癌行根治术患者作为研究对象,根据骨骼肌指数(SMI)高低分组,高SMI 69例,低SMI 23例,比较SMI高低组患者的年龄、性别、体质量指数(BMI)、血红蛋白、血清总蛋白、白蛋白、营养风险筛查2002评分(NRS 2002)、术前患者整体营养状况主观评定法(PG-SGA)评分、手术时间、手术方式、手术切除范围、出血量、住院时间、术后并发症的差异,并对患者术后并发症相关因素进行单因素及Logistic回归分析,筛选术后并发症的危险因素。结果 高骨骼肌患者的BMI、血清总蛋白、白蛋白、血红蛋白分别为(23.38±3.13)kg/m2、(69.75±7.21)g/L、(43.13±3.81)g/L、(132.21±20.45)g/L,均分别高于低骨骼肌患者的(20.68±2.79)kg/m2、(67.19±8.32)g/L、(40.19±5.12)g/L、(124.57±22.56)g/L,高骨骼肌患者术后并发症3例低于低骨骼肌患者的13例,差异有统计学意义(P<0.05)。高骨骼肌患者年龄、出血量[(58.72±10.13)岁、(155.49±133.59)ml]低于低骨骼肌患者[(62.65±10.91)岁、(160.19±125.49)ml],高骨骼肌患者手术时间、住院时间分别为(215.79±51.49)min、(19.39±4.49)d,高于低骨骼肌患者的(207.79±61.49)min、(12.89±6.39)d,但差异无统计学意义(P>0.05)。NRS2002评分高低SMI组间比较,差异有统计学意义(χ2=4.215,P=0.018);PG-SGA评分高低SMI组间比较,差异有统计学意义(χ2=27.680,P=0.037),L3-SMI可用于筛查胃癌患者术前营养风险。Logistic回归分析结果显示:低L3-SMI是影响胃癌术后并发症的危险因素(OR=2.913,95%CI:2.513~3.732;P=0.046)。结论 L3-SMI可用于评估胃癌患者的营养风险,是胃癌术后并发症的危险因素。
[关键词] 骨骼肌质量指数;胃癌;营养风险;术后并发症
[中图分类号] R735.2;R730.6 [文献标识码] B [文章编号] 1673-9701(2022)17-0047-04
Application value of L3 skeletal muscle mass index in nutritional risk assessment and postoperative complications for patients with gastric cancer
PEI Dabing1 ZHANG Yizhen2 ZHANG Haiping3 LU Rong3 DING Xiaobing1 ZHANG Xuhua1
1. Department of General Surgery, Affiliated Hospital of Jinggangshan University, Ji'an 343000, China; 2. Department of Pathology, Affiliated Hospital of Jinggangshan University, Ji'an 343000, China; 3. Department of Imaging, Affiliated Hospital of Jinggangshan University, Ji'an 343000, China
[Abstract] Objective To explore the application value of L3 skeletal muscle mass index in nutritional risk assessment and postoperative complications for patients with gastric cancer. Methods A total of 92 patients with gastric cancer who underwent radical gastrectomy in the Affiliated Hospital of Jinggangshan University from July 2018 to July 2021 were retrospectively analyzed as the research objects. According to the skeletal muscle index (SMI), they were divided into two groups: 69 patients with high SMI and 23 patients with low SMI. The following indicators were compared between the high SMI group and the low SMI group: age, gender, body mass index (BMI), hemoglobin, total serum protein, albumin, Nutritional Risk Screening 2002 (NRS 2002) score, preoperative Patient-Generated Subjective Global Assessment (PG-SGA), operation time, operation mode, resection scope, bleeding amount, length of hospital stay and postoperative complications. Univariate and Logistic regression analyses on the related factors for postoperative complications were carried out to screen the risk factors for postoperative complications. Results The BMI, serum total protein, albumin and hemoglobin of patients with high SMI [(23.38±3.13) kg/m2, (69.75±7.21) g/L, (43.13±3.81) g/L and (132.21±20.45) g/L respectively] were higher than those of patients with low SMI [(20.68±2.79) kg/m2, (67.19±8.32) g/L, (40.19±5.12) g/L and (124.57±22.56) g/L]. The postoperative complication in patients with high SMI (3 cases) was less than that in patients with low SMI (13 cases), with statistically significant differences (P<0.05). The age and bleeding amount of patients with high SMI [(58.72±10.13) years old, (155.49±133.59) ml] were lower than those of patients with low SMI [(62.65±10.91) years old, (160.19±125.49) ml]. The operation time and length of hospital stay in patients with high SMI [(215.79±51.49) min, (19.39±4.49) days] were longer than those in patients with low SMI [(207.79±61.49) min, (12.89±6.39) days], without statistically significant difference (P>0.05). There was a statistically significant difference in NRS 2002 score between the high SMI group and the low SMI group (χ2=4.215, P=0.018); there was a statistically significant difference in PG-SGA score between the high SMI group and the low SMI group (χ2=27.680, P=0.037). L3 SMI could be used to screen preoperative nutritional risks in patients with gastric cancer. Logistic regression analysis showed that low L3 SMI was a risk factor for postoperative complications of gastric cancer (OR=2.913, 95%CI:2.513-3.732; P=0.046). Conclusion L3 SMI can be used to evaluate the nutritional risks of patients with gastric cancer and is a risk factor for postoperative complications of gastric cancer.
[Key words] Skeletal muscle mass index; Gastric cancer; Nutritional risk; Postoperative complications
胃癌(gastric cancer,GC)是全球恶性肿瘤第二致死原因[1]。胃癌治疗以手术切除为主,术后并发症影响患者的预后[2]。术前营养状况与术后并发症发生密切相关,严重营养不良导致术后并发症增加[3,4]。营养风险筛查2002评分(nutritional risk screening 2002,NRS 2002)、患者整体营养状况主观评定法(scored patient-generated subjective global assessment,PG-SGA)评分、体质量指数(body-mass index,BMI)、白蛋白是常用的营养评价工具及指标。近年来,第三腰椎(third lumbar spine,L3)平面CT图像骨骼肌指数(skeletal muscle index,SMI)被用来评估胃癌患者的营养状况,有研究认为骨骼肌减少与恶性肿瘤患者的术后并发症显著相关[4]。本研究旨在通过回顾性分析L3-SMI高低组患者的营养评价表得分及指标情况,探讨SMI指标与胃癌患者的营养状态的关系及研究SMI对胃癌手术指标如手术方式、术后并发症等的影响。
1 资料与方法
1.1 一般资料
回顾性分析选择2018年7月~2021年7月井冈山大学附属医院收治的92例行胃癌根治术患者作为研究对象,收集患者的临床病历资料、影像资料。纳入及排除标准参考Huang DD、Kamarajah SK文献[10,19]。纳入标准:①年龄≥18周岁;②术前胃镜证实为胃癌行根治术;③术前未行任何治疗,术前1个月内在井冈山大学附属医院行腹部CT检查;④本研究需要的基本病历资料完整病例。排除标准:①有慢性疾病者;②腹部CT檢查不符合要求者;③有营养疾病者。其中男57例,女35例,平均年龄(60.62±10.89)岁。本研究经井冈山大学附属医院医学伦理委员会审批。
1.2 方法
1.2.1 患者营养评估 入院12 h内,由有经验的医师与护士各1名进行NRS2002、PG-SGA营养评估。(1)NRS2002评估表[6]:①年龄评分:年龄<70岁为0分,年龄≥70岁加1分;②现患疾病的严重程度评分:不同疾病严重程度分别加0~3分;③营养状况的受损情况评分:0~3分。参考指标:近期饮食摄入的减少量、体重的丢失量及BMI大小。总评分为7分,患者总分≥3分为有营养风险,<3分为营养正常。(2)PG-SGA评估表[7]:①患者自评:患者自身进食情况、体重、自感症状、活动能力和身体功能进行自我评估。②医护人员评估:医护人员根据患者的疾病状态、代谢状态及体格检查结果进行评估。总评分分为定量和定性评分,定量评分结果为四个等级:0~1分为营养状况良好,2~3分为可疑营养不良,4~8分为中度营养不良,≥9分为重度营养不良。
1.2.2 L3-SMI测定 分析术前GE公司lightspeed VCT机扫描的图像,选用L3平面成像,选取两个连续图像,计算骨骼肌(包括竖脊肌、腰大肌、腰方肌、腹直肌、腹内斜肌、腹横肌、腹外斜肌)的横截面积之和(图1)并取平均值。SMI(cm2/m2)=骨骼肌面积(cm2)/身高2(m2),取四分位数为分组的截止值[8]。女性SMI值≥30 cm2/m2为高SMI组,SMI值<30 cm2/m2为低SMI组;男性SMI值≥38.3 cm2/m2为高SMI组,SMI值<38.3 cm2/m2为低SMI。根据计算的SMI数值,参照四分位数为分组的截止值,基于SMI分为高低组。
1.3 观察指标及评价标准
①根据SMI分组,比较两组患者的年龄、性别、BMI、白蛋白、血清总蛋白、血红蛋白、手术方式、手术切除范围、手术时间、出血量、住院时间、术后并发症情况;②根据PG-SGA及NRS2002评分比较两组的SMI,评价患者的营养风险;③比较一般指标及营养指标,单因素分析筛选与术后并发症有关因素,多因素分析筛选出术后并发症危险因素。
1.4 统计学方法
采用SPSS 22.0统计学软件进行数据分析,计量资料以均数±标准差(x±s)表示,组间比较采用t检验,计数资料以[n(%)]表示,组间比较采用χ2检验,采用Logistic回归分析确定术后并发症的危险因素,P<0.05为差异有统计学意义。
2 结果
2.1 高低SMI组患者的一般指标、营养指标比较
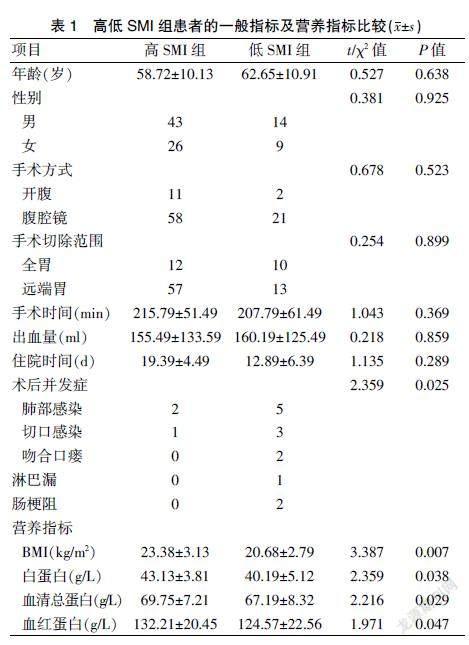
根据资料92例患者中高SMI患者69例,低SMI患者23例,两组患者的术后并发症、BMI、白蛋白、血清总蛋白、血红蛋白比较,差异有统计学意义(均P<0.05),两组患者的年龄、性别、手术方式、手术切除范围、手术时间、出血量、住院时间比较,差异无统计学意义(均P>0.05)。见表1。
2.2 高低SMI组患者营养方法评分比较
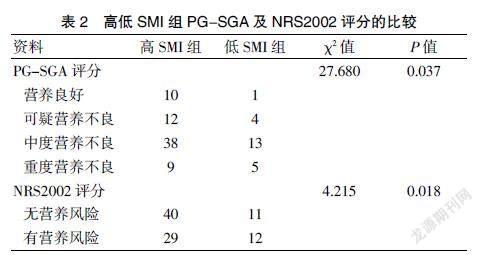
根据PG-SGA评分,低SMI组营养状况低于高SMI组,组间比较,差异有统计学意义(χ2=27.68,P=0.037)。NRS2002评分,组间比较差异有统计学意义(χ2=4.215,P=0.018),SMI可用于筛查患者术前营养风险。见表2。
2.3 单因素分析胃癌术后并发症相关因素
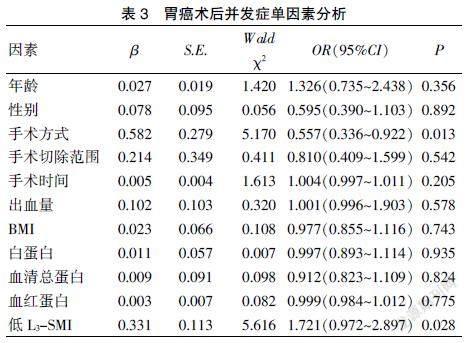
对一般指标及营养指标单因素分析显示,手术方式及低L3-SMI是影响胃癌术后并发症发生的相关因素(P<0.05)。见表3。
2.4 Logistic回归分析术后并发症危险因素
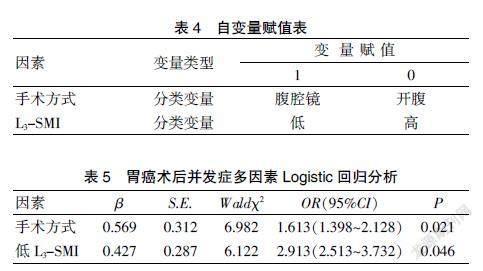
将表3结果显示有统计学意义的因素纳入自变量并赋值。见表4。将胃癌术后是否出现并发症作为因变量(1=出现,0=未出现),经Logistic回归分析得出:手术方式和低L3-SMI是影响胃癌术后并发症的危险因素。见表5。
3 讨论
胃癌患者的营养状况评估有BMI、血红蛋白、血清总蛋白、白蛋白等指标及NRS 2002、PG-SGA评分工具。本研究显示两组患者的BMI、血红蛋白、白蛋白、血清总蛋白比较,差异有统计学意义(P<0.05),表明患者术前存在营养风险可能。
胃癌患者行根治术后由于禁食及手术应激使营养缺乏加重,导致术后并发症发生增加,本研究发现高SMI组患者术后并发症3例,低SMI组患者术后并发症13例,组间比较,差异有统计学意义(P=0.025),低SMI患者的并发症更严重。主要原因:低SMI患者急性期蛋白合成不足、免疫细胞活性下降,导致患者对感染的抵抗力减弱;肠道缺乏谷氨酰胺出现细菌移位也增加术后感染风险,谷氨酰胺减少导致肠黏膜萎缩肠道吸收功能下降且氨基酸供应不足使组织愈合能力差,两者导致肠瘘风险增加[9,10]。
PG-SGA、NRS2002及人体成分营养指标对预测胃癌根治性切除患者术前的营养状态有一定的意义,但PG-SGA及NRS2002一致性较差,说明两者单独使用有各自的优缺点[11]。所以本研究分析SMI高低组的PG-SGA及NRS2002情况,结果显示:低SMI组营养状况的PG-SGA评分低于高SMI组,组间比较差异有统计学意义(χ2=27.680,P=0.037)。对NRS2002评分,组间比较差异有统计学意义(χ2=4.215,P=0.018),表明L3-SMI可用于筛查患者的手术前营养风险。Sieber等[12]报道,营养不良是肌肉减少症的主要原因。肌肉减少症的发生还与患者的内分泌及代谢变化、骨骼肌线粒体功能下降、胰岛素抵抗等有关[13,14]。骨骼肌减少症更容易出现在营养不良的胃癌患者中。有研究表明,术前有肌肉减少症的胃癌患者术后拥有更差的总生存期[15]。因此,临床上对肌肉减少症患者的及时识别及干预意义重大,以期改善临床结局。
肌肉减少症能增加胃癌患者术后并发症的发生。Zhuang等[16]研究发现,肌肉减少症是胃癌根治术后严重并发症的独立危险因素(OR=3.010,P<0.001);Lou等[17]研究认为,肌肉减少症是超重或肥胖胃癌患者(BMI≥23 kg/m2)根治术后并发症的独立危险因素(OR=6.071,P=0.002)。本研究对患者一般指标及营养指标单因素分析显示,手术方式及低L3-SMI是影响胃癌术后并发症发生的相关因素(P<0.05),进一步通过Logistic回归分析显示,手术方式(OR=1.613, 95%CI:1.398~2.128;P=0.021)和低L3-SMI(OR=2.913,95%CI:2.513~3.732;P=0.046)是影响胃癌术后并发症的危险因素。
综上所述,L3-SMI可用于评估胃癌患者的营养风险,是影响胃癌术后并发症的危险因素。
[参考文獻]
[1] Torre LA,Bray F,Siegel RL,et al. Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] 李子禹,吴舟桥,王一丁,等.腹腔镜胃癌术后主要并发症防治策略[J].中华普外科手术学杂志(电子版),2021, 15(2):133-138.
[3] Leide DSNF,Calado FPGP,Damasceno DSCM,et al. Nutritionnal status and its impact on time and relocation in postoperative complication of abdominal patients undergoing surgery[J].Nutr Hos,2014,30(3):629-635.
[4] Teker AM,Korkut AK. Impact of controlling nutritional status score(COUNT) and prognostic nutritional index(PIN)on patients undergoing coronary artery bypss graft surgery[J].Heart Surg Forum,2019,22(4):E294-E297.
[5] Shachar SS,Williams GR,Muss HB,et al. Prognostic value of sarcopenia in adults with solid tumours: A meta-analysis and systematic review[J].Eur J Cancer,2016,57:58-67.
[6] Kondrup J,Rasmussen HH,Hamberg O,et al. Nutritional risk screening(NRS 2002): A new method based on an analysis of ntrolled clinical trials[J].Clinical Nutrition,2003, 22(3):321-336.
[7] Detsky AS,Mclaughlin JR,Baker JP,et al. What is subjective global assessment of nutritional status[J].JPEN J Parenter Enteral Nutr,1987,11(1):8-13.
[8] Martin L,Birdsell L,Macdonald N,et al. Cancer cachexia in the age of obesity: Skeletal muscle depletion is a powerful prognostic factor,independent of body mass index[J].Journal of Clinical Oncology,2013,31(12):1539-1547.
[9] Lutz CT,Quinn LS. Sarcopenia,obesity,and natural killer cell immune senescence in aging:Altered cytokine levels as a common mechanism[J].Aging,2012,4(8):535-546.
[10] Lo WD,Evans DC,Yoo T. Computed tomography-measured psoas density predicts outcomes after enterocutaneous fistula repair[J].Journal of Parenteral & Enteral Nutrition,2018,42(1):176-185.
[11] 韩菲,卞晓洁,陈大宇,等.不同营养筛查方法对胃癌胃切除患者适用性的对比[J].药学与临床研究,2019,27(6):449-453.
[12] Sieber CC. Malnutrition and sarcopenia[J].Aging Clinical and Experimental Research,2019,31(6):793-798.
[13] Ongaro E,Buoro V,Cinausero M,et al. Sarcopenia in gastric cancer: When the loss costs too much[J].Gastric Cancer,2017,20(4):563-572.
[14] Distefano G,Standley RA,Zhang X,et al. Physical activity unveils the relationship between mitochondrial energetics,muscle quality,and physical function in older adults[J].J Cachexia Sarcopenia Muscle,2018,9(2):279-294.
