阿司匹林和氯吡格雷联合应用对小鼠脑缺血损伤后骨髓及脑内炎症反应的影响
2022-07-16董雯姜鸣钰陈文涛刘文倩陈青芳赵顺英叶维贞温少红刘向荣
董雯,姜鸣钰,陈文涛,刘文倩,陈青芳,赵顺英,叶维贞,温少红,刘向荣
临床研究证明,阿司匹林和氯吡格雷联合应用能有效降低轻型缺血性卒中和TIA患者的卒中复发率[1-2]。进一步分析发现,阿司匹林和氯吡格雷联合应用的最佳持续时间为卒中发生后的21 d[3],但目前阿司匹林和氯吡格雷联合作用的机制尚不明确。
中性粒细胞是人体固有免疫系统中重要的效应细胞,主要产生于骨髓[4]。脑缺血后,中性粒细胞通过分泌炎症因子,释放自由基,形成中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)增加血栓形成等机制介导脑缺血损伤[5]。小胶质细胞是中枢神经系统中主要的免疫效应细胞[6],激活的小胶质细胞根据功能主要分为促炎(M1)和抗炎(M2)两种极化表型[7]。脑缺血后,小胶质细胞介导脑缺血损伤还是神经保护作用取决于其在促炎和抗炎表型中的动态平衡[8]。本研究利用小鼠大脑中动脉远端缺血再灌注模型分析阿司匹林和氯吡格雷联合应用对脑缺血后骨髓中性粒细胞分泌的炎症因子、小胶质细胞3D形态以及极化状态的影响,以探索双联抗血小板治疗可能的作用机制。
1 对象与方法
1.1 实验动物 选取雄性C57BL/6小鼠20只(8~10周龄,体质量25±0.5 g,北京华阜康生物科技控股有限公司),饲养于12 h循环照明,温度22~24 ℃环境中,自由摄食水。本实验遵照动物伦理(批号:202002003)相关要求进行。
1.2 模型制作与分组 模型制作:小鼠异氟烷麻醉后取右侧卧位,在右耳和右眼之间正中开口,找到并结扎大脑中动脉远端。1 h后解开结扎线实现再灌注。术中通过监测脑血流判断模型成功。术中小鼠肛温保持在37±0.5 ℃。
模型成功后小鼠随机分为对照组和双抗组,每组各10只。对照组在再灌注即刻通过灌胃给予饮用水100 μL;双抗组在再灌注即刻通过灌胃给予阿司匹林(剂量12 mg/kg,每只实际用量0.3 mg)与氯吡格雷(剂量12 mg/kg,每只实际用量0.3 mg)混悬液100 μL,每日1次,连续21 d。
1.3 骨髓中性粒细胞分离 应用骨髓中性粒细胞分离试剂盒(索莱宝,中国)。造模后21 d处死小鼠,分离股骨和胫骨,用含10%胎牛血清的培养基冲洗髓腔以获得骨髓,制备骨髓单细胞悬液,室温离心,吸取中性粒细胞层。应用清洗液重悬细胞,离心后备用。
1.4 炎症因子测定 应用RNA提取试剂盒(Qiagen,德国)提取骨髓中性粒细胞RNA,应用逆转录试剂盒(Invitrogen,美国)将信使RNA(messenger RNA,mRNA)逆转录成互补DNA(complementary DNA,cDNA),之后进行实时荧光定量PCR扩增。应用2-△△Ct计算对照组与双抗组之间扩增指标的相对表达量。扩增指标包括IL-1β、IL-6、IL-10、几丁质酶样蛋白(chitinase-like 3,Chil3/YM1)、诱导型一氧化氮合酶(i nducible nitric-oxide synthase,iNOS)、TNFα、精氨酸酶1(arginase1,Arg1)、转化生长因子β(transforming growth factor β,TGFβ)、CD206、CD32。引物序列见表1[9]。
1.5 组织免疫荧光染色 小鼠脑组织固定后包埋,行冰冻切片。应用Triton X100透化切片,室温封闭1 h,之后进行离子化钙结合适配分子1(ionized calcium binding adapter molecule 1,Iba1)(和光纯药,日本)和CD16(BD bioscience,美国)或Iba1和CD206(R&D Systems,美国)共染过夜。磷酸盐吐温缓冲液洗后,应用抗兔(Jackson,711-545-152)、抗大鼠(Jackson,712-165-150)和抗羊(Jackson,705-165-003)荧光二抗分别进行标记。CD16+Iba1+标记梗死周边区M1型小胶质细胞;CD206+Iba1+标记梗死周边区M2型小胶质细胞。使用激光共聚焦显微镜(Carl Zeiss,德国)拍摄图像。应用软件Imaris 9.0.1对小胶质细胞3D图像进行分析,包括细胞突起长度、突起数量、突起分叉点数量和终末点数量。应用Image J软件统计CD16和Iba1双阳以及CD206和Iba1双阳细胞数。
1.6 统计方法 使用GraphPad Prism 8.0.2软件进行统计,计量资料符合正态分布,用表示,两组间比较采用独立样本t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 骨髓中性粒细胞相关炎症因子表达情况与对照组相比,双抗组促炎因子I L-1β的mRNA水平下降,抗炎因子YM1和CD206的mRNA水平上升,差异有统计学意义,2组其他炎症因子的表达差异无统计学意义(表2)。

表2 脑缺血再灌注后21 d骨髓中性粒细胞炎症因子相对表达量
2.2 脑缺血再灌注后小胶质细胞形态学变化对单个小胶细胞形态的3D分析显示,与对照组相比,双抗组脑梗死周边区小胶质细胞突起长度(109.40±23.42 μmvs. 92.48±28.25 μm,P=0.014)、突起数量(58.63±39.55个vs. 13.27±10.54个,P<0.001)、突起分叉点数量(25.43±17.54个vs. 5.70±5.03个,P<0.001)、突起终末点数量(30.00±19.97个vs. 7.63±5.55个,P<0.001)均增加(图1)。2.3 脑缺血再灌注后小胶质细胞极化状态 脑缺血再灌注21 d后双抗组与对照组梗死周边区小胶质细胞数量无统计学差异,单位面积(1 mm2)中分别有395.5±85.59个和413.3±97.84个(P=0.588)。但2组的小胶质细胞极化情况差异有统计学意义,双抗组和对照组梗死周边区域单位面积(1 mm2)中CD16阳性的小胶质细胞分别有119.4±37.43个和220.2±63.07个,双抗组较低(P<0.001);C D 2 0 6 阳性的小胶质细胞数量分别为198.2±40.16个和122.8±29.88个,双抗组较高(P<0.001)(图2)。
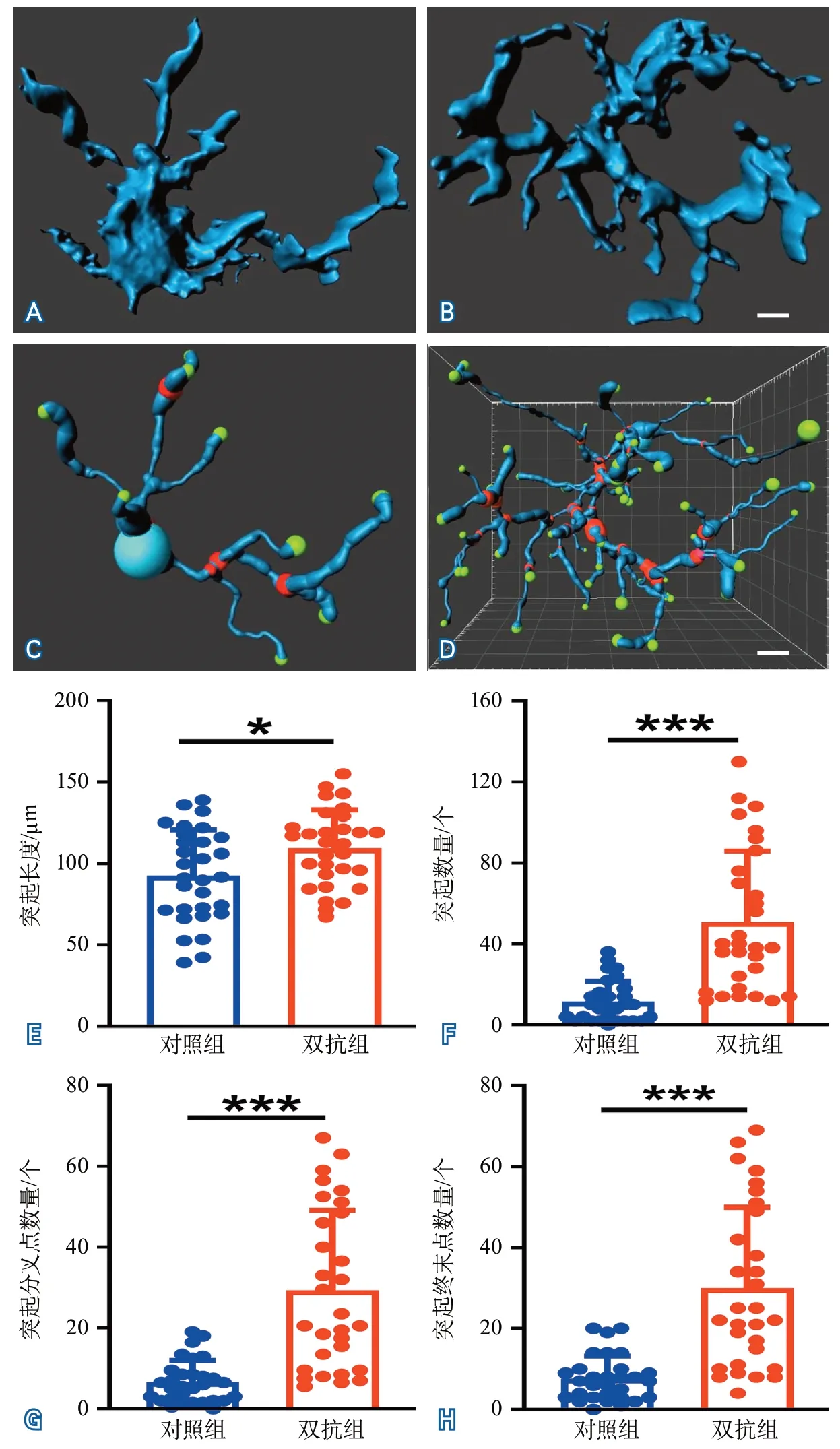
图1 脑缺血再灌注后21 d脑组织梗死周边区小胶质细胞形态

图2 脑缺血再灌注后21 d不同组别脑组织小胶质细胞极化状态
3 讨论
本研究应用小鼠轻型急性脑缺血再灌注模型,连续21 d给予阿司匹林和氯吡格雷灌胃,发现联合用药显著降低骨髓中性粒细胞促炎因子IL-1β的表达,同时提高抗炎因子YM1和CD206的表达。联合用药增加脑梗死周边区小胶质细胞分支,同时促进小胶质细胞由M1型向M2型转化。以上结果提示,阿司匹林和氯吡格雷联合应用可能通过降低骨髓和脑内的炎症反应,从而保护脑缺血损伤。
炎症是脑缺血后主要的病理过程,同时也是影响卒中预后的重要因素[10]。中性粒细胞被认为是固有免疫系统的第一道防线。临床研究和动物实验均表明,中性粒细胞的功能异质性取决于疾病和炎症阶段[11]。促炎型即N1型中性粒细胞通过产生IL-1β、TNFα、NO和过氧化氢等细胞因子或效应因子,加重炎症损伤。相反,N2型中性粒细胞表达YM1、CD206和Arg1[12],并产生抗炎因子IL-10、TGFβ和VEGF等,有助于组织重建和损伤修复,从而起到神经保护作用[13]。本研究中,双抗组促炎因子水平降低,抗炎因子水平升高,提示阿司匹林和氯吡格雷联合用药可能通过提高中性粒细胞的抗炎作用促进脑缺血损伤的恢复。
静息状态下,小胶质细胞通过突触摆动执行免疫监视功能,维持脑组织内微环境的动态平衡[14]。疾病状态下,小胶质细胞形态发生改变,表现为突起数量、分叉点数量和终末点数量增多,以便提高小胶质细胞的免疫监测范围[15]。小胶质细胞激活后分为促炎(M1型)或抗炎(M2型)两种表型。M1极化表型通过释放促炎因子加速脑缺血损伤进程;M2型具有抗炎功能,可保护神经细胞存活[8]。因此,小胶质细胞从M1型向M2型转化被认为是治疗脑缺血损伤的潜在方向之一。本研究发现,阿司匹林和氯吡格雷联合应用之后,脑梗死周边区小胶质细胞呈现出多突起多分支状,扩大了其免疫监测范围;另外,小胶质细胞向M2抗炎表型转化,提示双抗联合用药可抑制梗死周边的炎症反应。
小胶质细胞异常激活可通过加重脑白质损伤导致认知功能下降[16]。本课题组前期研究结果显示,阿司匹林与氯吡格雷联合应用能显著改善脑缺血小鼠的认知功能[17]。结合本课题组一系列研究结果,提示阿司匹林和氯吡格雷联合应用可通过减少骨髓中性粒细胞和脑内小胶质细胞的炎症反应从而起到神经保护作用。然而,联合用药如何影响骨髓中性粒细胞抗炎和促炎因子的释放以及小胶质细胞的极化还需进一步的探索。
【点睛】本研究在小动物缺血再灌注模型中验证了阿司匹林和氯吡格雷联合应用21 d可提高骨髓中性粒细胞的抗炎作用以及调节脑内小胶质细胞的激活与极化,提示双联抗血小板治疗可能通过上述机制起到抑制脑缺血损伤的作用。
