电化学适配体传感器检测生物标志物研究进展
2022-07-15冯雪晴金中淦
冯雪晴,居 漪,李 卿,金中淦
(上海市临床检验中心,上海 200126)
长期以来,生物传感器一直被期望成为医学诊断和医疗领域的重要检测和治疗技术[1-2]。然而,在人体样本的复杂生物环境下,生物传感器的检测性能受到限制[3]。目前,除用于糖尿病监测的血糖仪外,生物传感器的商业化和实际应用很少。为快速、准确检测疾病的生物标志物,研究人员通过各种分子生物技术和纳米技术来提高生物传感器的性能[4-5]。近年来,适配体作为高亲和性和高特异性的“化学抗体”,受到越来越多的关注。适配体生物传感器的优势是能够很好地模拟含有生物标志物的天然生物界面[6],可以利用电活性物质在界面处通过构象改变产生的信号变化产生可被捕捉的生物信号。本文对采用适配体纳米技术构建电化学生物传感器的方法,以及生物传感器在疾病生物标志物检测中的应用进行综述。
1 生物传感器
生物传感器是用来检测生物标志物并将其转化为可检测的信号的装置,由靶受体和信号转换器2个部分组成。靶受体与生物标志物间的相互作用使信号形成,理想的靶受体应具有高度特异性和选择性,可有效识别和特异性结合生物标志物,达到快速响应和输出信号的目的。
适配体通过被固定在传感器的界面上来捕获溶液中的生物标志物。适配体识别生物标志物后,其电活性物质与电极的构象发生改变,电流响应随电子转移能力的改变发生相应变化,进而定量测定待测物浓度。与溶液中的识别不同,界面处的适配体识别受到待测生物标志物可及性的限制,这些限制对灵敏度、特异性和检测速度造成了影响,需要减少界面的异质性,并克服能量障碍,以改善适配体在生物传感界面处的热力学和动力学反应[7]。以在金电极表面组装巯基适配体为例,适配体的巯基可以与金电极形成Au-S键,并相互作用,使其从溶液中自发吸附到金电极上,然后重组为自组装单层[8],当Au-S键的自由能低于溶解适配体的溶剂时,即可以形成稳定的自组装单层。
2 适配体纳米技术
适配体是一段寡核苷酸序列,利用指数富集进化技术从寡核苷酸的配体库中被筛选出来。与诊断试剂常用的抗体相比,适配体可以识别生物标志物细微的结构差异,且解离常数高,可识别皮摩尔~纳摩尔级生物标志物靶标[9-11]。功能性适配体可与有机、无机、生物分子结合并发生反应,如蛋白质,氨基酸、金属离子、病毒、细菌、药物、甚至细胞[12-14],在疾病诊断和治疗、临床检验和药物开发等方面有着巨大的发展潜力。1980年,JONES等[15]首次提出具有特定序列和结构的寡核苷酸可以用于电极表面的自组装,利用热力学定律可以精确得出适配体的折叠状态和适配体之间的相互作用。由于可以控制适配体的形状和长短,且可被灵活修饰,这种高度灵活的组装能够形成具有特定理化性质和功能的结构。这些优势可以应用在生物传感器的构建上。
3 生物传感器组装方式
3.1 小分子辅助界面
适配体可以通过非特异性吸附于金电极表面来有效识别标志物。小分子辅助界面可以使适配体垂直定向在界面上,并通过6-巯基己醇、二硫苏糖醇和3-巯基丙酸等分子取代适配体碱基的非特异性吸附,提高其特异性识别能力。由巯基适配体和6-巯基己醇组成的间隔双组分单分子层可以最大限度地减少适配体和金电极的非特异性吸附,提高适配体在金电极界面的识别效率。目前,小分子辅助界面已被广泛应用于提高适配体传感器的识别效率、降低检测限、增强灵敏度。ZHANG等[16]使用适配体/6-巯基己醇混合自组装单层,将表面识别效率提高到了85%,通过将适配体的表面分子密度从1.2×1013个/cm2降低到1.2×1012个/cm2,提高了检测灵敏度,证实了使用6-巯基己醇和巯基适配体形成二元自组装单层有利于提高生物传感器的性能。
3.2 多腺嘌呤介导的界面
适配体碱基和金电极相互作用的相关研究结果表明,适配体碱基对金电极的亲和力遵循A>C≥G>T的顺序[17]。腺嘌呤在金电极表面上吸附力很强,结合力可与众所周知的Au-S键相媲美,金元素的存在甚至可以使腺嘌呤和胸腺嘧啶的双链体变性。腺嘌呤与金电极的强结合亲和力在设计不含巯基的适配体中具有很好的应用前景[18]。为了控制适配体的构象和接枝密度,可用腺嘌呤作为锚定基团和密度控制基团,使电极上的适配体密度随着腺嘌呤长度的增加而降低;此外,腺嘌呤可优先与金电极结合,阻止其他材料吸附于金电极,这一特性非常有效地阻止了其他材料的非特异性吸附。
3.3 纳米材料组装界面
纳米材料[19-20]组装界面一般通过改变界面处的传质来提高生物传感器的便捷性。BESANT等[21]开发了纳米材料微电极,用于研究生物传感器的灵敏度;他们通过在硅片上制备电沉积后组装巯基适配体来制备纳米材料微电极,并进行分子动力学模拟,证实了纳米材料微电极可以抑制适配体聚集,并增加界面传质,从而提高适配体的识别性能;该研究结果显示,纳米材料微电极适配体传感器的灵敏度与普通电极相比,提高了10 000倍;并发现纳米材料微电极传感器的超高灵敏度具有很多优势,如可以在30 min内检测到细菌的RNA。基于纳米材料微电极的适配体检测平台可用于检测一系列生物标志物,包括病原抗菌药物耐药性标志物和肿瘤生物标志物。
3.4 基于框架核酸的组装界面
框架核酸的中空结构使空间能够被最大化利用,非常适合在界面处组装[22],可以提供具有低成本和高重现性的高分辨率的界面。适配体连接的框架核酸锚定到界面上,可用于生物传感的开发。PEI等[23]在框架核酸的顶部连上1个适配体,结果显示,凝血酶与适配体形成了稳定的夹层结构,这一方法可用来特异性检测凝血酶。类似的方法也可以应用于其他标志物的检测。
4 适配体传感器在生物标志物检测中的应用
4.1 用于肿瘤生物标志物检测
目前,适配体生物传感器已被用于各种肿瘤生物标志物、抗原和细胞的检测,如人类表皮生长因子受体2、血管内皮生长因子、表皮生长因子受体、PDGF黏液蛋白1、前列腺特异性抗原和癌胚抗原。
4.1.1 抗原类生物标志物检测 过去几十年,基于适配体的生物传感器因其良好的灵敏度和选择性、快速响应和低成本等优点,被广泛应用于低浓度抗原类标志物的检测。癌胚抗原(carcinoembryonic antigen,CEA)是在胚胎内胚层上皮中发现的潜在生物标志物,一般用于监测结直肠癌的治疗效果,以及辅助诊断乳腺癌、胃肠道肿瘤、肝癌、肺癌、卵巢癌和胰腺癌。MAZLOUM-ARDAKANI等[24]开发了一种基于多壁碳纳米管、血红素和石墨烯纳米片的电化学适配体传感器,用于检测CEA,线性范围为1.0×10-15~1.0×10-8g/mL,检测限为0.82 fg/mL;检测原理为纳米复合材料多壁碳纳米管可提高导电性,并加速血红素和电极之间的电子转移,当CEA结合适配体时,血红素的信号会进一步降低。这种低成本、高灵敏度和特异性的生物传感器在临床样本CEA检测中有较大的应用价值。见图1。
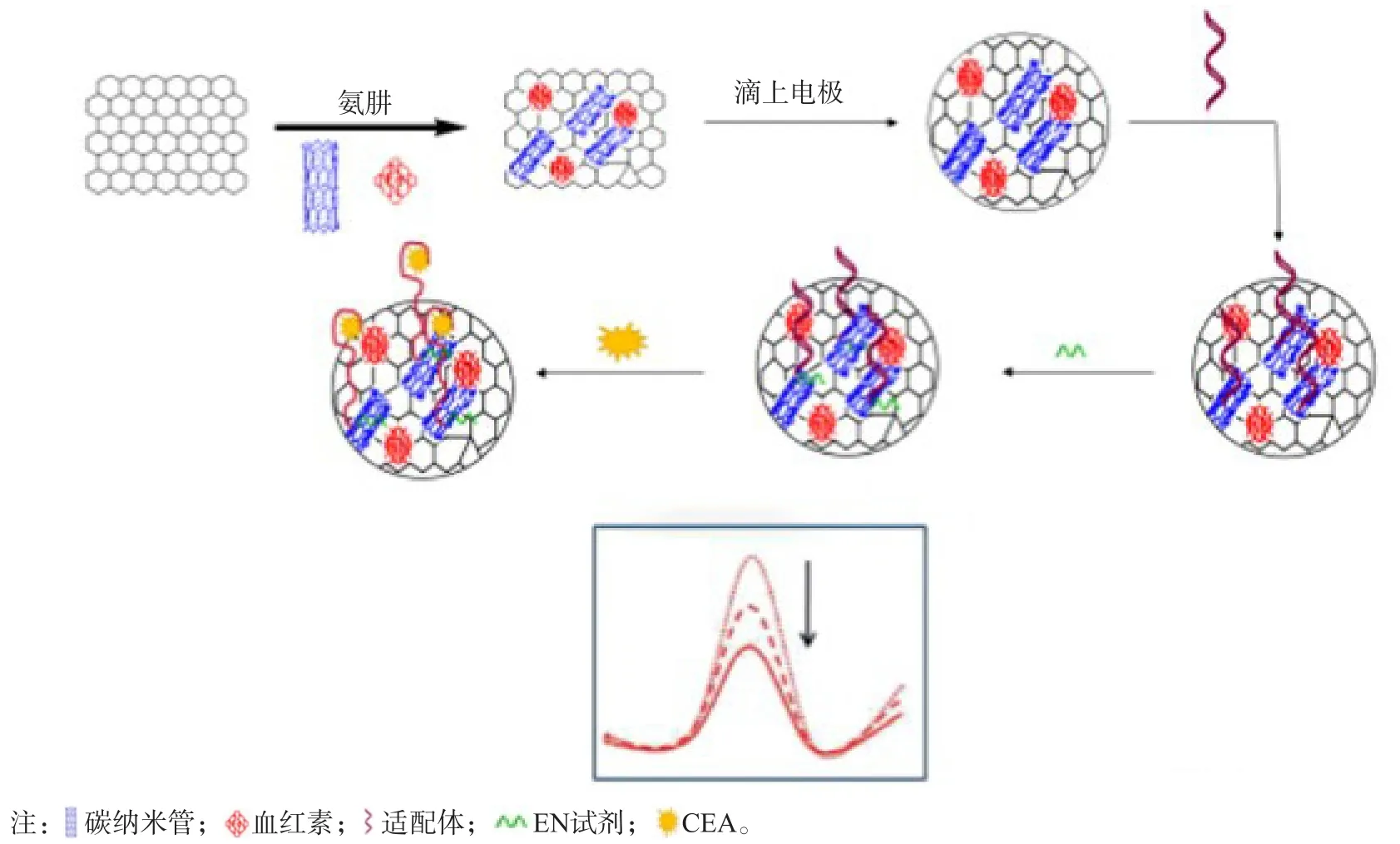
图1 用于检测CEA的适配体传感器的制备和工作示意图[24]
4.1.2 循环肿瘤细胞检测 循环肿瘤细胞由原发肿瘤组织脱落后,可进入血液循环和淋巴循环,因其在肿瘤转移早期阶段出现,已成为癌症监测和诊断的重要生物标志物[25]。YANG等[26]开发了一种DNA标记夹心电化学生物传感器,基于3D石墨烯和金纳米笼/氨基化多壁碳纳米管混合物,采用差分脉冲伏安法检测乳腺癌细胞MCF-7;由于纳米材料具有放大信号的优势,这种电化学传感器检测MCF-7细胞时表现出高特异性和高灵敏度的优势,检测范围为1.0×102~1.0×106个/mL,检测限低至80 个/mL。这种方法具有很大的实际应用潜力,在癌症诊断中具有较好的前景。
4.1.3 外泌体检测 外泌体是一种细胞外囊泡,直径为30~150 nm,可以调节肿瘤微环境,被认为是最重要的肿瘤生物标志物之一[27]。
ZHOU等[28]将适配体固定在电极的表面,在互补适配体的一端修饰电活性物质亚甲蓝,当目标外泌体存在时,CD63适配体可以识别外泌体上的CD63蛋白膜,电活性物质在电极上的电信号发生改变,从而实现外泌体的检测。见图2。
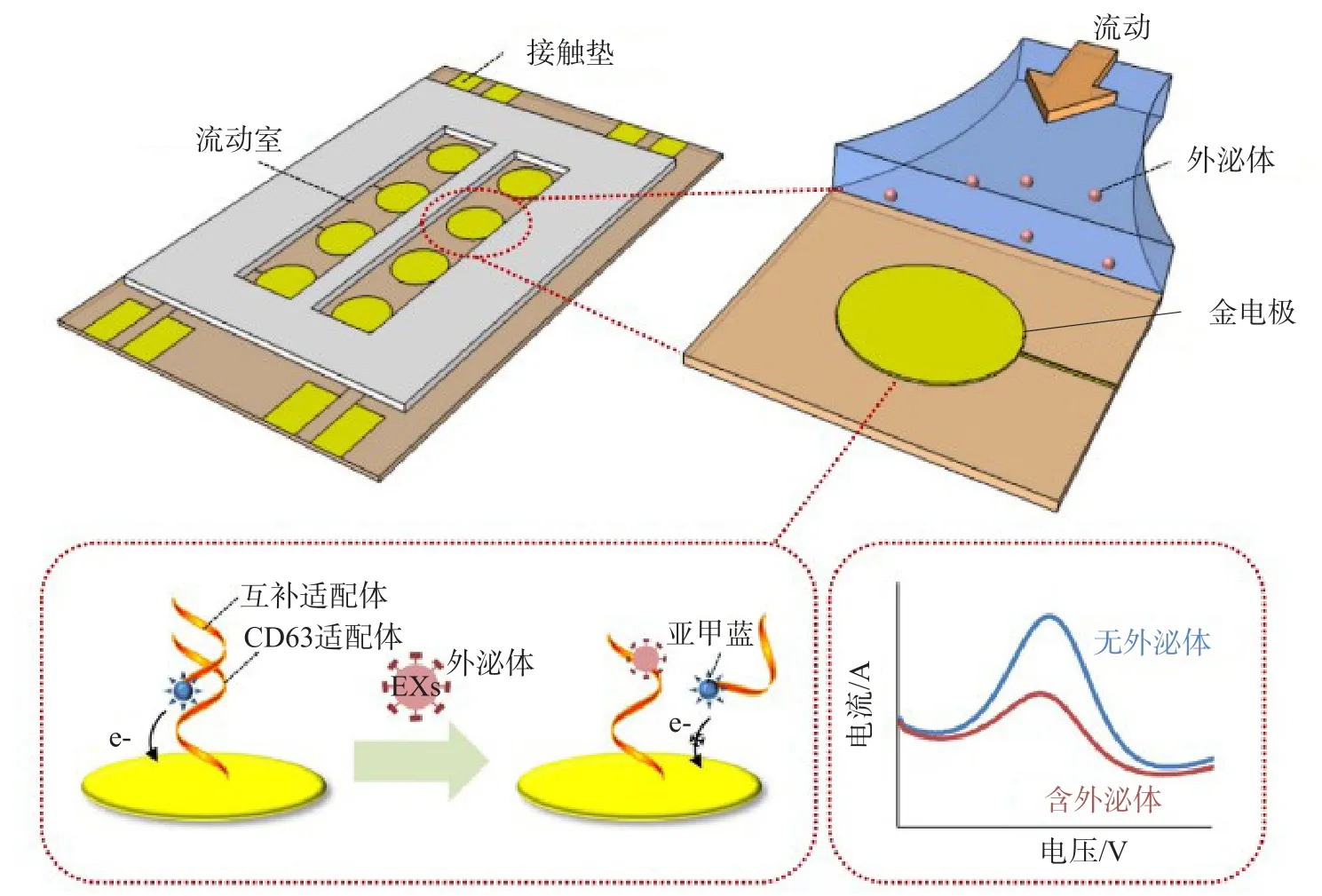
图2 基于适配体检测外泌体的示意图[28]
4.2 用于心血管疾病生物标志物检测
心血管疾病是人类健康的最大威胁,具有高患病率、高致残率和高死亡率的特点。开发操作简单、灵敏、低成本的心血管疾病生物标志物传感器非常必要。QIAO等[29]开发了基于适配体-MoS2纳米共轭物的电化学传感器,用于检测心肌肌钙蛋白I,并与基于Au@SiO2@Au纳米颗粒的电化学传感器的检测效能进行比较,结果显示,2种传感器均可以检测人血液样本中的心肌肌钙蛋白I,但基于适配体-MoS2纳米共轭物的电化学传感器检测心肌肌钙蛋白I的线性范围为10 pmol/L~1.0 μmol/L,检测限为0.95 pmol/L,较适配体Au@SiO2@Au传感器具有更低的检测限;此外,在不含有肌酸激酶MB同工酶和肌红蛋白的样本中,2种传感器均表现出良好的诊断效能。
4.3 用于阿尔茨海默病生物标志物检测
阿尔茨海默病的神经紊乱是进行性且不可逆的,会导致患者记忆丧失,且患者后期一般生活无法自理。β-淀粉样蛋白是临床早期诊断阿尔茨海默病的生物标志物。目前,已经有适配体生物传感器用于Aβ蛋白检测,基于这种电化学生物传感器开发的检测设备,具有灵敏度高、操作简单、性能稳定、成本低、可小型化的优点,有较好的临床应用前景。
ZHANG等[30]发现,具有电活性的茎环适配体被固定在金电极上后,适配体上修饰的电活性物质二茂铁(Fc)可通过识别淀粉样蛋白寡聚体前后的构象变化导致的电荷转移量的变化来检测淀粉样蛋白寡聚体,茎环(B-3'Fc)适配体与淀粉样蛋白寡聚体结合后,Fc峰电流会降低;此外,通过优化交流伏安法的检测频率,可以进一步降低传感器的检测限,但同时会使检测范围变窄;基于这一发现,他们开发了一种基于茎环的电化学适配体传感器,可高选择性和高灵敏度地定量亚皮摩尔浓度的淀粉样蛋白寡聚体,可能有利于阿尔茨海默病的诊断。
4.4 病原微生物标志物检测
微生物中的致病菌可以导致人类疾病,给人类健康和公共卫生带来诸多挑战。传统的微生物检测方法需要在培养基中培养病原菌,然后进行鉴定。用这种方法得到的结果虽然准确,但是至少需要4~7 d才能得到结果。其他方法,如酶联免疫吸附试验,依赖于抗原-抗体反应,易受pH值和温度等环境因素的影响。电化学适配体生物传感器病原体检测技术具有操作简单、成本低、灵敏度高、信号稳定、可小型化等诸多优势,且可与微制造工艺兼容,并进行真实样品检测[29]。
DAI等[31]发现,具有反式切割活性的Cas12a核酸内切酶可对单链DNA启动反式切割,将标记有亚甲基蓝的单链DNA固定在金电极电化学传感器,在待测物存在的条件下,Cas12acrRNA可启动对非特异性单链DNA 的反式切割,使亚甲蓝的电流降低;基于这一发现,他们开发了一种基于CRISPR Cas12a(cpf1)的电化学生物传感器——E-CRISPR,为了证明其系统通用性,他们将开发的E-CRIPSR首次应用于人乳头瘤病毒和细小病毒B1916核酸检测,结果显示,由于优化了Cas12a体外反式切割的化学环境,无需任何酶促进扩增,E-CRISPR达到了皮摩尔水平的检测限;他们进一步设计了基于E-CRISPR级联的蛋白质靶点,用于检测临床样本中的转化生长因子-β1蛋白。相信在电化学和CRISPR的结合下,E-CRISPR可以成为便携、精准和低成本的即时诊断系统的强大推动力。E-CRISPR的检测原理见图3。
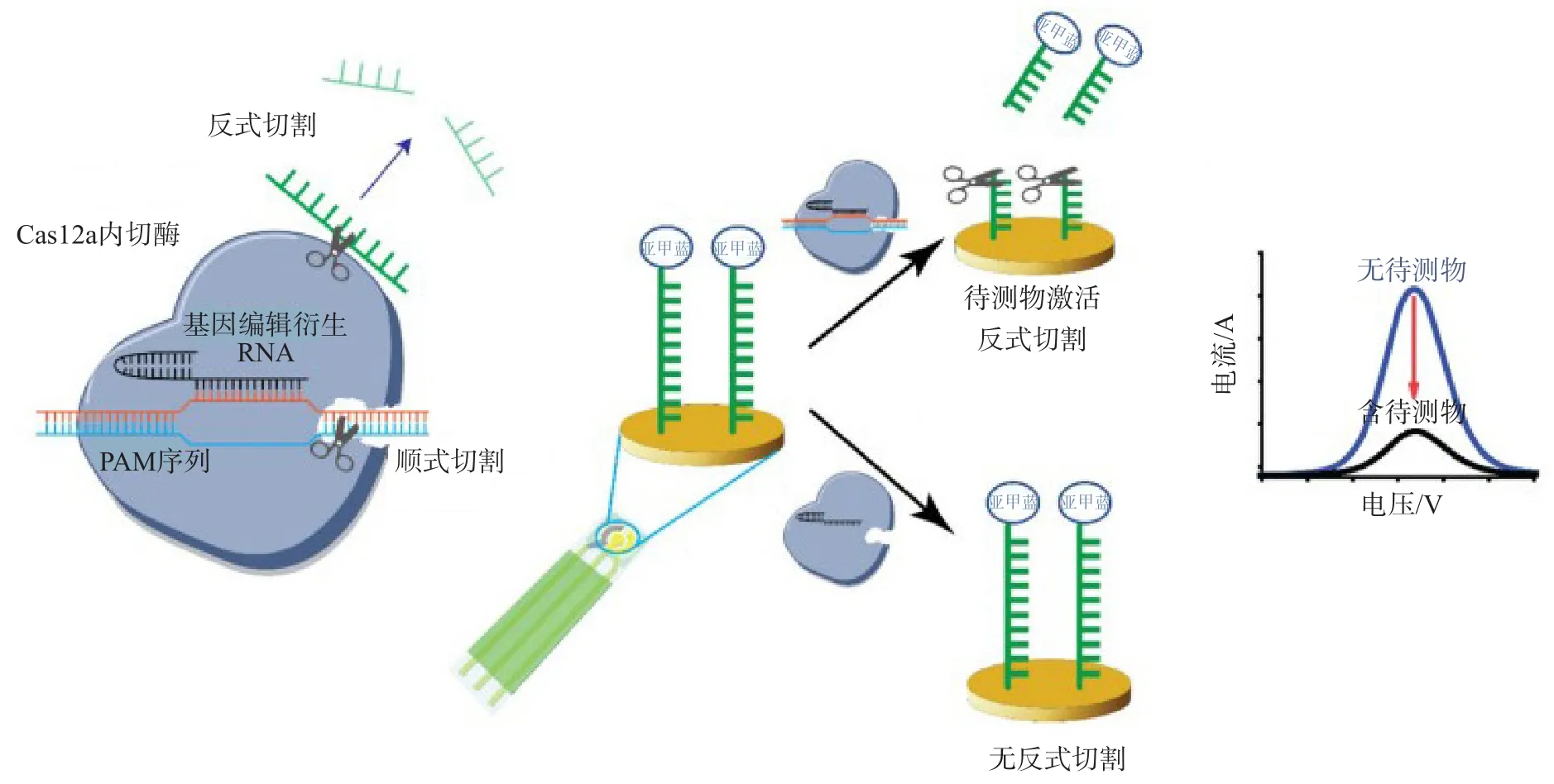
图3 E-CRISPR的检测原理[31]
5 总结和展望
适配体传感器在生物标志物的定量和定性检测上有很多的应用。寡核苷酸适配体被认为是可识别生物标志物的智能分子。但是,尽管适配体已经被用于多种传感平台,仍有很多需要解决的问题和挑战。
(1)大规模生产DNA/RNA适配体成本较高,且由于酶的存在,许多适配体在人血液中会被快速降解。有研究发现,添加具有生物相容性的官能团可提高其耐酶性;开发异种核酸作为有效和通用的适配体,在适配体的实际应用中也有较好的前景[32]。
(2)灵敏度需要进一步提高。将适配体与量子点、金属纳米粒子等纳米材料结合[33-34],采用DNA纳米机器和滚动圆放大、聚合酶链反应等技术,可以提高适配体传感器的灵敏度。ZHANG等[35]提出了一种组装方法——Bindinginduced DNA,可以检测复杂样本中低浓度的目标分子,这种检测方法可以应用于脂类、核酸、低聚糖、病毒和病原体等多种生物分子的检测。另外,信号放大也是在极低浓度被测物条件下提高检测灵敏度的有效策略[36]。
(3)适配体临床检测应用受限。虽然目前关于适配体传感器的研究较多[37-38],但因信噪比较低、细胞基质和体液可能会掩蔽适配体、多通道检测困难等不足,使适配体传感器的临床应用受到很大限制。传感器的设计方面,可以将多个适配体固定在检测平台上,以同时检测多种疾病标志物;另外,以纳米技术为基础的检测平台,有望实现高选择性、高特异性、低成本、高效、快速、多通道检测的目标。相信随着研究的不断深入,适配体传感器会广泛应用于临床检测。
