一种啮齿类动物脑内微透析记录的清醒活动装置的设计和应用研究
2022-07-15张钰周澧张玲孙秀萍李祥磊秦川
张钰,周澧,张玲,孙秀萍,李祥磊,秦川*
(1. 中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021;2. 国家人类疾病动物模型资源库,北京 100021;3. 国家卫生健康委员会人类疾病比较医学重点实验室,北京 100021;4. 北京市人类重大疾病实验动物模型工程技术研究中心,北京 100021)
实验动物脑内微透析技术是神经系统研究中的一种经典的微量化学采样与检测技术,用于在体检测实验动物特定脑区的化学成分分泌情况。 实验原理是局部微透析半透膜探针采样。 首先通过脑内立体定位手术向啮齿类动物(大鼠、小鼠)或非人灵长类动物的目标脑区植入微透析探针,探针含有半透膜以及流入、流出两个方向的管路。 手术恢复后,进行在体的微透析记录采样。 记录过程中缓慢向探针流入管路泵入人工脑脊液,于探针的半透膜处进行物质交换(即“微透析”),目的脑区特定的化学成分可以跨越半透膜。 按一定的时间间隔收集流出端样品,记录结束后再对样品进行化学成分的测定和分析,可以检测化学物质分泌的实时变化[1]。 该实验的优势是动物无须麻醉,在一定空间范围内进行清醒、自由活动,可以很好的反应动物在清醒、自由活动的情况下目标脑区的化学物质、神经递质分泌情况,同时也可实时结合动物的认知或行为任务,观测化学物质合成和分泌规律,是研究实验动物脑内化学物质分泌的关键技术方法[2]。
啮齿动物保持微透析收集阶段清醒活动,不受到外界环境应激和刺激,是稳定记录的重要基础。为实现啮齿动物微透析的清醒记录,本研究自行设计制作一种啮齿动物可用的脑内微透析清醒活动装置,结合现有商品化的装置并改进其多种不足[3]。 发明目的是供啮齿类实验动物(大鼠、小鼠)在此装置内进行清醒、自由活动的同时,头部的脑内微透析液体管路不缠绕打结,稳定收集脑内微透析的流出液样品。
为了验证该装置的有效性、科学性和稳定性,进行了小鼠黑质-纹状体的多巴胺神经递质微透析记录实验。 向小鼠的黑质、纹状体分别手术植入微透析探针,通过微透析的清醒活动记录收集样品,进行多巴胺神经递质(DA)和代谢产物二羟基苯乙酸(DOPAC)的分析测定。 实验结果表明,自行设计制作的微透析清醒活动装置可以实现小鼠的自由活动、线路不缠绕打结,多巴胺和DOPAC 的采样稳定,可以获得理想实验结果。 设计成功后,申请国家发明专利和实用新型专利两项,并顺利获批授权。
1 材料与方法
1.1 材料
1.1.1 实验动物
9 只8 周龄 SPF 级雄性 C57BL/6 小鼠,体重20~25 g,购于北京华阜康生物科技股份有限公司【SCXK(京)-2020-0004】,饲养于中国医学科学院医学实验动物研究所、北京协和医学院比较医学中心南纬路啮齿动物行为学设施【SYXK(京)-2018-0019】。 动物设施内温度 24 ~ 26℃,光照 12 h 明亮:12 h 黑暗,小鼠自由饮水饮食。 本实验中动物的使用已经过中国医学科学院医学实验动物研究所实验动物使用与管理委员会(IACUC)批准(ILASQC-2017-002)。 实验中所有的动物实验操作过程严格按照实验动物使用的3R 原则和实验动物福利伦理的相关规定进行。
1.1.2 主要仪器
(1)微透析清醒活动装置的制作:双通道不锈钢转环(INSTECH,美国),液体管路、样品收集管(CMA,瑞典),铁架台,1 mL 塑料吸头,小鼠饮水瓶,塑料桶,铁丝,纸胶带,塑料板等。
(2)小鼠微透析探针埋置手术:啮齿动物脑立体定位仪(深圳市瑞沃德生命科技有限公司,中国),啮齿动物呼吸麻醉机(深圳市瑞沃德生命科技有限公司),微透析探针(CMA,瑞典,其中纹状体探针半透膜长度2 mm、黑质探针长度1 mm),异氟烷(深圳市瑞沃德生命科技有限公司),生理盐水、医用酒精、牙科水泥、医用棉签、手术器械等。
(3)小鼠的微透析清醒记录:四通道微量注射泵,微透析液体管路(CMA,瑞典),自制记录装置,啮齿动物腰部塑料固定扎环,50 μL EP 管,高氯酸,氯化钠,氯化钾,氯化钙,氯化镁,稀盐酸等。
1.2 方法
1.2.1 微透析清醒活动装置制作
参考相关文献和国外产品,根据实验需求和可操作性,自行设计制作微透析的啮齿动物清醒活动装置[4-5]。 取适量长度铁丝按示意图结构弯折,将塑料片打孔连接铁丝,插入1 mL 塑料吸头并固定,用于记录过程中放入样品收集管。 将双通道转环、铁丝、塑料片和纸胶带按装置示意图连接固定,最下端铁丝为弯钩形,用于记录过程中与小鼠塑料圈勾住固定。 铁架台通过直角夹固定横杆,将装置的双通道转环用直角夹固定在横杆上。 塑料桶侧壁打孔,将小鼠饮水瓶的瓶口插入固定,放置于铁架台底座上(图1)。
1.2.2 动物分组和微透析探针手术埋置
C57BL/6 小鼠9 只,分别在右侧黑质、右侧纹状体脑区进行手术埋置微透析探针。 小鼠使用异氟烷吸入麻醉,固定于小鼠脑立体定位仪上,眼睛涂抹眼药膏,顶部头皮备皮,碘伏消毒,头顶正中切口,钝性分离组织,暴露颅骨和前囟,黑质坐标(AP= - 3.2 mm; ML = 1.25 mm; DV = 4.6 mm),纹状体坐标(AP = 1.0; ML = 1.5; DV = 3.2),颅骨表面打孔,按目标脑区坐标颅骨开窗,旋入颅骨螺丝固定。 缓慢垂直植入微透析探针,用牙科水泥固定。 手术过程中注意无菌操作规范,手术结束后,小鼠腹腔注射非甾体抗炎药美洛昔康(2 mg/kg)。术后恢复7 d,可进行记录实验。
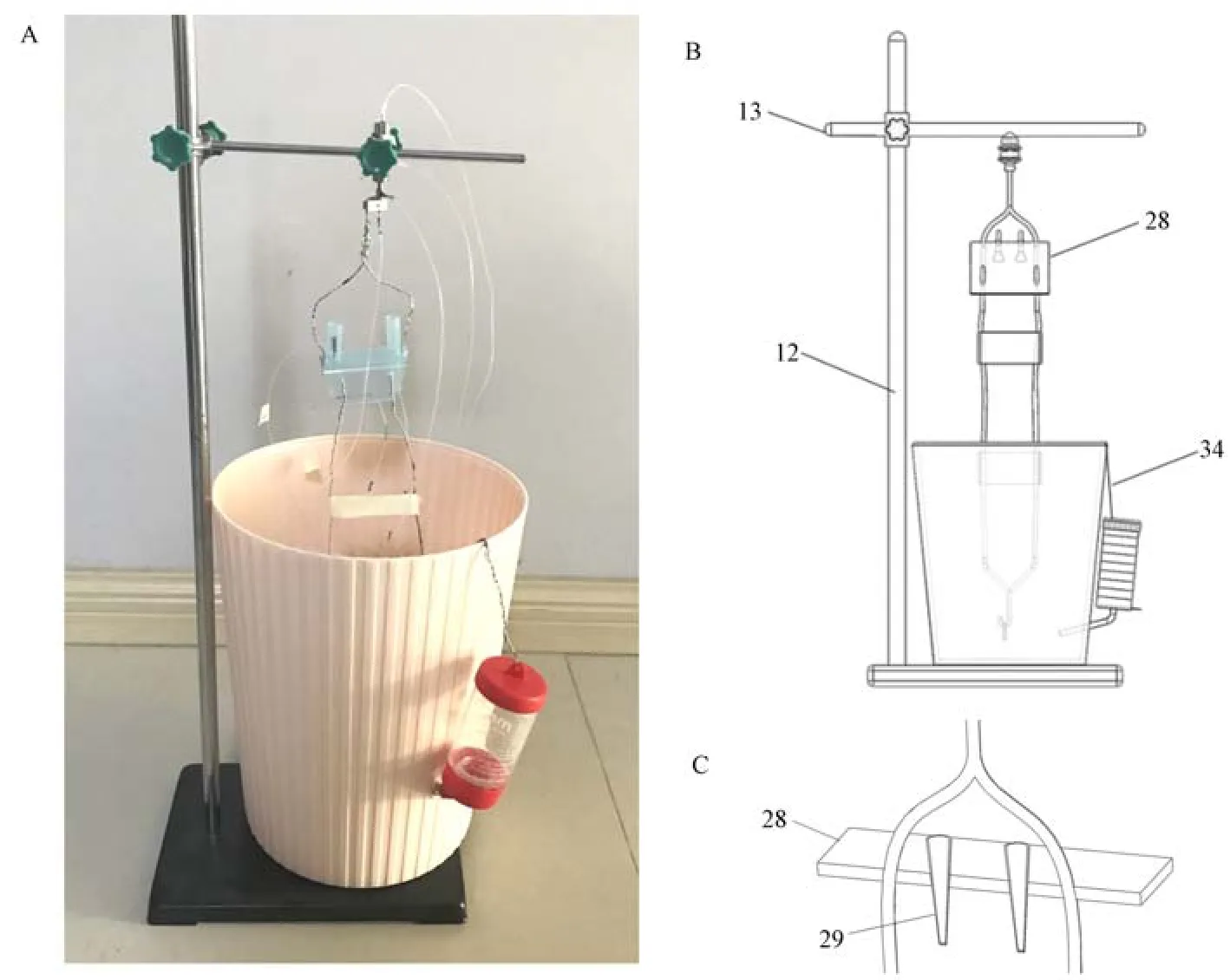
注:A:装置实物图;B:装置整体示意图;C:装置局部示意图,12:铁架台垂直杆,13:铁架台水平杆,28:手工切割的塑料片结构,用于打孔放置两个1 mL 塑料吸头(29),记录过程中放置EP 管收集管,34:动物饮水瓶。
1.2.3 小鼠微透析清醒记录
将脑内已植入微透析探针的小鼠置于装置内,连接管路,打开微透析泵,以2 μL/min 流速缓慢泵入人工脑脊液(表1),平衡4.5 h,动物在此期间在装置内自由活动。 开始正式收集后,先收集30 min空白样品,随后每20 min 更换1 次收集管,共记录200 min,收集样品10 管。 记录结束后将样品送样上机,检测其中的神经递质DA 和DOPAC 浓度。 本次实验样品委托法国波尔多大学Erwan Bezard 教授实验室进行化学成分检测[6]。

表1 微透析用人工脑脊液配方Table 1 Artificial cerebrospinal fluid for microdialysis
1.3 统计学分析
2 结果
2.1 啮齿动物脑内微透析清醒记录装置的埋置和记录
本实验使用自主设计制作的啮齿动物脑内微透析清醒记录装置,可实现啮齿类动物小鼠或大鼠两个脑区的同时记录。 首先检测使用的有效性、科学性、稳定性。 通过立体定位手术向小鼠纹状体和黑质分别植入微透析探针。 动物术后恢复7 d 后可在记录收集阶段进行小鼠黑质和纹状体的神经递质微透析采样,可以实现两个脑区同时的记录收集(见图2)。

图2 微透析记录清醒活动装置用法示意图Figure 2 Schematic diagram of usage of the rodent awake activity device for brain microdialysis recording
啮齿动物脑内微透析记录实验时,动物无须麻醉,腰部用塑料环固定,将动物腰部固定环与装置下方挂钩相连,头部埋置的微透析探针管路末梢与装置的液体管路相连,动物置于塑料桶内。 连接注射泵、微量进样针、液体管路、转环。 在装置上的2个1 mL 塑料吸头中放入样品收集管,将液体管路的末端插入,并用纸胶带稍加固定,分别收集小鼠纹状体、黑质的样品。 记录过程中,小鼠在塑料桶内进行清醒活动,自由饮水、饮食,液体管路可随动物的运动旋转,不易拆绕打结。 每20 min 更换1 次样品收集管,取得小鼠脑内黑质或纹状体的微透析样品。 整个记录过程中动物自由运动状态良好,装置使用稳定,取样收集便利。
2.2 脑内在体微透析测定小鼠纹状体、黑质的多巴胺递质
以啮齿动物的多巴胺能神经通路研究为例,定量验证此装置的采样能力。 多巴胺(dopamine,DA)是中枢神经系统含量最丰富的儿茶酚胺类神经递质,在中脑-皮层通路(mesocortical system)、中脑边缘通路(mesolimbic system)、黑质-纹状体通路(nigro-striatal system) 和结节- 漏斗通路(tuberoinfun-dibular system) 发挥重要的生理功能[7],其功能异常与成瘾、帕金森病、精神分裂症等神经系统疾病息息相关[8-13]。 瑞典科学家阿尔维德·卡尔松(Arvid Carlsson)和美国科学家保罗·格林加德(Paul Greengard)有关神经递质多巴胺的研究获得2000 年诺贝尔生理学或医学奖( https:/ /www. nobelprize. org/prizes/medicine/2000/press-release/)[14]。 多巴胺在神经元内主要通过单胺氧化酶(MAO)的作用转化为二羟基苯乙酸(DOPAC)[15]。 在鼠脑中,多巴胺代谢的最终产物是 DOPAC,而在人或非人灵长类动物中,DOPAC 受到细胞外儿茶酚胺氧位甲基转移酶(COMT)的作用还可转化为高香草酸(HVA)(图3)。 实验研究大多通过啮齿动物多巴胺能神经突触末梢释放神经递质DA 和DOPAC 的化学含量研究脑内多巴胺能神经通路功能。 本研究对小鼠黑质和纹状体分别手术植入脑内微透析探针,进行自由活动状态下的在体微透析收集。 实验结束后,对实验小鼠进行大脑取材和定位验证,纹状体和黑质的微透析探针末梢定位准确,均位于目标脑区(图4)。
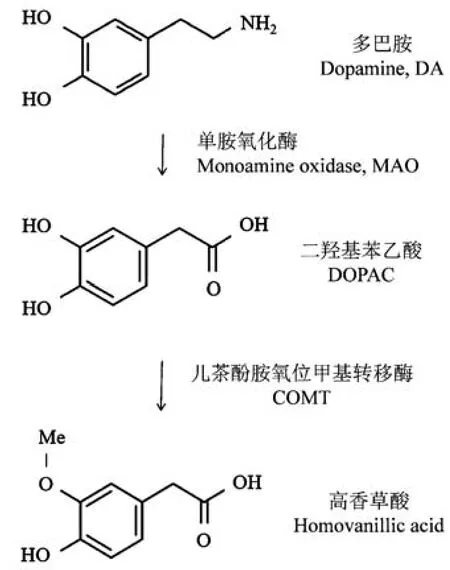
图3 神经系统多巴胺代谢示意图Figure 3 Schematic diagram of dopamine metabolism in the nervous system
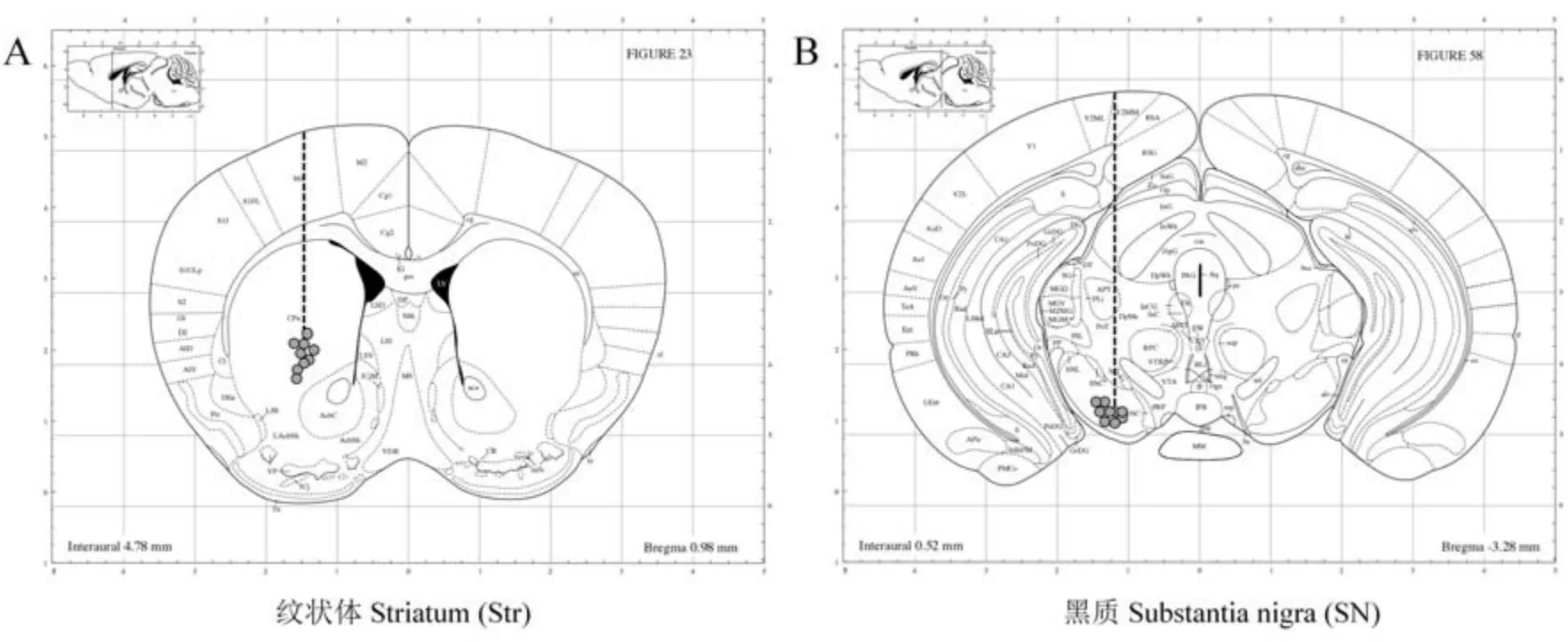
图4 小鼠脑内微透析探针埋置位点Figure 4 Sites of microdialysis probe implantation in mice brain
记录完成后,对收集的样品送样,检测其中神经递质DA 和DOPAC 的化学含量。 对于小鼠的黑质-纹状体神经通路,神经元胞体位于黑质,在胞体内实现神经递质的合成和传导,神经细胞发出轴突投射到纹状体部位,与其他神经元形成大量突触,通过突触前膜释放大量神经递质成分,通过突触间隙作用于下游神经元。
经测定,DA 在小鼠黑质的含量在记录期间随时间变化基本稳定,绝对浓度为(0.11 ± 0.01)nmol/L。 各时段之间无明显差异,其中最高为(0.15 ± 0.04) nmol/L,最低为(0.10 ± 0.00)nmol/L。 DA 在小鼠纹状体的含量在记录期间随时间变化基本稳定,绝对浓度为(0.22 ± 0.05)nmol/L。 各时段之间无明显差异,其中最高为(0.32 ± 0.11) nmol/L,最低为(0.22 ± 0.04)nmol/L(图5)。
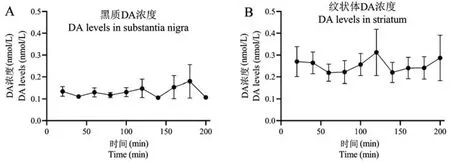
图5 微透析记录清醒活动装置测定小鼠黑质、纹状体多巴胺浓度Figure 5 Neurotransmitter dopamine levels in the substantia nigra and striatum of mice measured by the rodent awake activity device for brain microdialysis recording
DOPAC 在小鼠黑质的含量在记录期间随时间变化基本稳定,绝对浓度为(3.38 ± 0.59)mol/L。各时段之间无明显差异,其中最高为(3.80 ± 0.73)nmol/L,最低为(2.41 ± 0.54)nmol/L。 DOPAC 在小鼠纹状体的含量为在记录期间随时间变化基本稳定,绝对浓度为(20.35 ± 6.87)nmol/L。 各时段之间无明显差异,其中最高为(23.86 ± 7.14)nmol/L,最低为(19.33 ± 6.29)nmol/L(图 6)。
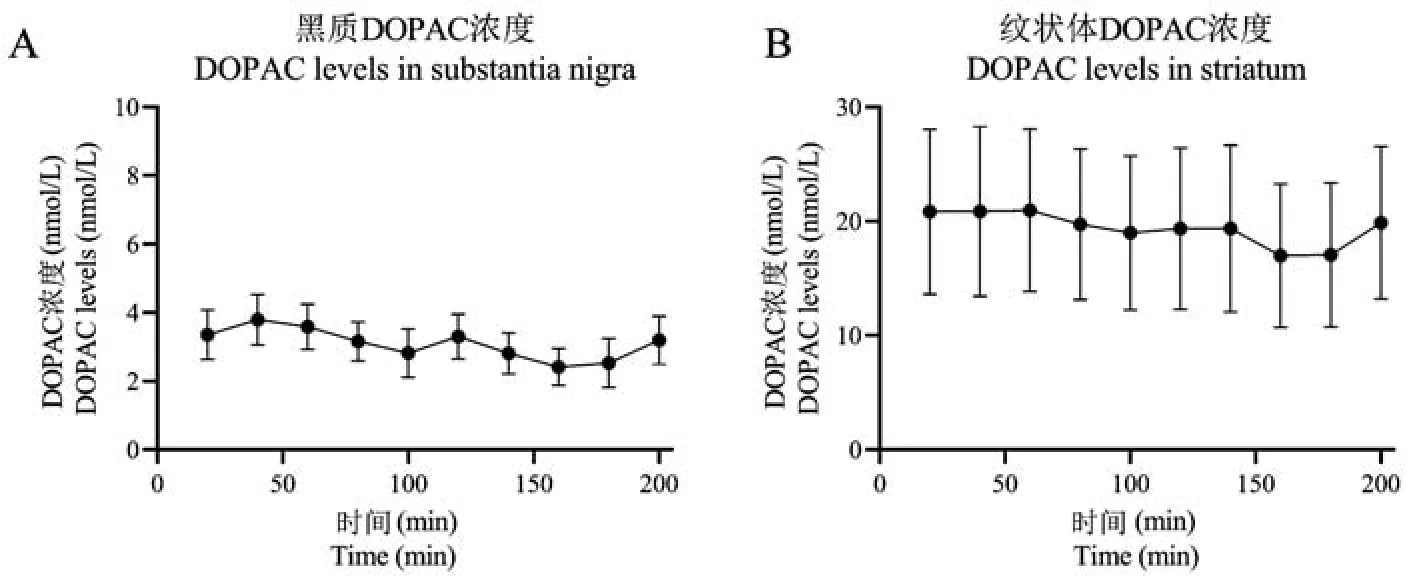
图6 微透析记录清醒活动装置测定小鼠黑质、纹状体DOPAC 浓度Figure 6 Neurotransmitter DOPAC levels in the substantia nigra and striatum of mice measured by the rodent awake activity device for brain microdialysis recording
3 讨论
神经递质是神经系统重要的信号传导途径,通过旁分泌的形式在神经元、神经胶质细胞之间实现调控作用。 神经递质的合成、分泌、摄取和重吸收是神经系统的重要生理功能,在疾病状态下,神经递质的含量、分泌及重吸收障碍是病理学和病理生理学改变的化学基础。 神经系统实验研究中,模型动物的脑内化学物质分泌、浓度和受体的变化是疾病机制研究的几个重要层次[16]。 实现脑内化学递质稳定、可靠的记录是本装置的制作目标。
3.1 装置的设计和使用
国内外现有部分在售的脑内微透析清醒活动装置,最常见的是国外产品,基本由动物活动箱(含动物水瓶)和微透析转环装置两部分组成。 动物活动箱大多为立方体的活动空间,在装置的外侧固定有动物水瓶。 微透析转环装置从侧方固定在动物活动箱的一个侧壁上缘,使二者一体化。 以上产品有两点不足。 第一,动物活动箱通常为方形,对动物的自由活动有所限制,活动箱的边缘和角落不易清洗,容易藏匿污渍、动物尿液等,残留的个体气味会对随后动物的检测产生干扰。 动物在不同位置(如长边或角落)会出现生理性的位置偏好,啮齿类动物具有筑巢、避光的习性,在方形空间中更偏爱在角落中运动,因此对动物的自由活动有一定影响。 第二,微透析转环装置(金属棒和转环线缆装置)以侧方的上边缘处卡扣的形式固定在活动箱的一侧,虽然装置已经尽量轻便,但该装置的重心在一侧,容易造成整体放置不稳定,而且微透析转环装置结构比较细,受力较易折断,易损耗报废。 进口产品在购买和使用过程中存在诸多不便,如进度缓慢、价格较高、维修困难、技术支持难等,本文装置设计通过自主设计改进并制作,力求更好实现啮齿类动物清醒状态下的脑内微透析记录。
本装置的适用范围是啮齿类实验动物,常用的如大鼠、小鼠,根据研究需要也可进行金黄地鼠、豚鼠等动物的脑内微透析采样,动物的自由活动可通过更换相应尺寸的活动圆筒实现。 在本文的研究中,我们实验了清醒、自由活动小鼠的黑质和纹状体微透析采样分析,小鼠在装置内清醒、自由活动,可顺利采样记录,装置圆筒的直径为:底座17 cm,上缘20 cm。 如使用大鼠开展实验,为实现动物的清醒、自由活动,可将装置的圆筒更换为较大尺寸,并在铁架台上固定;同时在预实验过程中观察采样管路长度是否合适,并进行微调,保证大鼠的自由活动和稳定记录。 本实验室现有的大鼠活动装置的圆筒直径为30 cm 或45 cm。
3.2 实验动物的化学物质采样和分析应用范围
在体微透析实验可用于多种化学成分的检测,除本文的多巴胺和DOPAC 神经递质之外,该技术还可检测GABA、谷氨酸、乙酰胆碱等神经递质,乳酸、尿酸、丙酮酸、组胺、褪黑素、P 物质、缓激肽等代谢产物。 该技术适用的实验动物,除啮齿动物大鼠、小鼠以外,还可用于豚鼠、金黄地鼠、兔、狗、猫、猪、羊、非人灵长类等动物。 检测的组织或器官包括脑、脊髓、血液、心脏、肝、肾、脂肪组织和肾上腺等[17-18]。 不同实验动物、不同组织的检测根据实验需求选用相应的采样模式,可进行清醒或麻醉记录,利用不同规格、不同实验目的的装置展开研究。
3.3 神经化学分析新技术和展望
脑内微透析实验属于神经化学检测方法,通过在体采样、化学成分分析获得化学物质的浓度数据。 在神经系统发挥功能的生理过程中,神经递质常表现为低浓度的实时变化,因此对技术也提出更高的挑战,如要求采样过程的稳定性、化学成分检测的特异性和灵敏度、更高的时间和空间分辨率等。 本装置可为实验动物在体神经化学检测提供稳定的采样活动装置。 近年来发展的一系列神经递质检测方法,如荧光探针、电化学检测等,具有较好的特异性、灵敏度及时空分辨率,借助微电子、计算机技术的飞速发展也实现了神经递质化学检测的技术更新。
本研究基于脑内微透析清醒记录技术的原理和现状,自行设计制作一种啮齿类动物脑内微透析记录的清醒活动装置,并通过小鼠的黑质-纹状体多巴胺能神经通路进行该装置的记录实验,取得稳定的实验结果。 现已申请并授权获批国家专利两项:发明专利(202110525342.5)[19],实用新型专利(202121027247.4)[20]。
