注射用右雷佐生与几种配伍溶媒的稳定性考察
2022-07-15宗在伟田帅华刘红伟王押林张高雅陈虹宇
宗在伟,田帅华,刘红伟,王押林,张高雅,陈虹宇*
1 江苏奥赛康药业有限公司,211112;2 南京医科大学,210029
右雷佐生(曾用名右丙亚胺),是消旋雷佐生(又名丙亚胺)的D-异构体,是螯合剂乙二胺四乙酸(EDTA)的亲脂性衍生物。右雷佐生是目前唯一获批的可以有效预防蒽环类药物心脏毒性的保护剂,目前已在美国、欧盟等临床上广泛应用,其保护机制主要是通过减少氧自由基的产生、降低脂质过氧化产物含量和减轻心肌细胞凋亡[1-3]。循证医学显示,铁螯合剂右雷佐生是唯一可以有效预防蒽环类药物导致心脏毒性的药物。右雷佐生已获美国FDA授予孤儿药地位和优先审评资格,主要用于降低晚期乳腺癌患者多柔比星治疗所致心肌病的发生率和严重程度,适用于接受多柔比星累积剂量达到300 mg·m-2且需继续使用多柔比星的患者。国内多中心Ⅱ期临床试验也证实右雷佐生对由多柔比星引起的心脏毒性具有明显的保护作用。目前,右雷佐生已获国内外多个权威指南推荐用于降低蒽环类药物的心脏毒性,如《美国肿瘤化疗及放疗保护剂临床操作指南(2008 年)》、《NCCN 临床实践指南:老年肿瘤(2016.V2)》、《NCCN 临床实践指南:非霍奇金淋巴瘤(2019)》和中国《蒽环类药物心脏毒性防治指南(2020 年)》等。
目前注射用右雷佐生仅两家公司获批在国内上市,分别为江苏奥赛康药业(规格250 mg 和500 mg)和南京海润医药有限公司(规格250 mg);尚未有国外企业取得注射用右雷佐生进口上市批准。
在注射用右雷佐生原研产品Zinecard®说明书中,配伍溶媒为乳酸钠林格注射液,且并未推荐其他溶媒。而于2014 年在日本上市的注射用右雷佐生,商品名SAVENE®说明书中指出,注射用右雷佐生的溶媒可为0.9%氯化钠注射液、乳酸钠林格注射液或5%葡萄糖注射液。国内目前上市的注射用右雷佐生说明书规定与原研产品相同,即使用乳酸钠林格注射液为溶媒;但目前乳酸钠林格注射液在国内普及度较差,近五成医院无此品,难以充分满足临床患者用药的需求。醋酸钠林格注射液与乳酸钠林格注射液化学组成相似,可以考虑作为乳酸钠林格注射液的潜在替代溶媒。
本研究拟采用注射用右雷佐生与醋酸钠林格注射液、0.9%氯化钠注射液、5%葡萄糖注射液进行配伍,于室温和冷藏(2~8 ℃)两个条件,进行配伍溶液稳定性研究,并与乳酸钠林格注射液配伍后溶液的稳定性进行对比,以评估使用醋酸钠林格注射液、0.9%氯化钠注射液、5%葡萄糖注射液替代乳酸钠林格注射液的可行性。结合本品关键质量属性,从有关物质、可见异物、不溶性微粒、溶液澄清度与颜色、pH 等角度进行评估,比较几种不同溶媒配伍溶液稳定性的差异,为临床安全用药提供依据。经文献调研,国内外均无关于注射用右雷佐生质量标准的相关报道,该品种也未收录于国内外各国药典标准,因此选择本公司获得国家药品监督管理局批准的药品注册标准作为本品配伍后溶液稳定性评价的标准。
1 仪器与药品、试剂
1.1 仪器
SevenExcellence pH 计(瑞士梅特勒-托利多公司);不溶性微粒仪、澄明度检测仪(天津天大天发科技公司);Agilent 1260 高效液相色谱仪(安捷伦公司);Waters Acquity Arc 高效液相色谱仪。
1.2 药品与试剂
注射用右雷佐生(规格250 mg,江苏奥赛康药业有限公司);醋酸钠林格注射液(湖北多瑞药业有限公司);乳酸钠林格注射液,0.9%氯化钠注射液,5%葡萄糖注射液(均安徽双鹤药业)。
甲醇、盐酸为色谱纯;磷酸二氢钾为AR 级。
2 方法与结果
2.1 配伍溶液的制备
2.1.1 溶媒为乳酸钠林格注射液和醋酸钠林格注射液配伍溶液 采用注射用右雷佐生注射液说明书中的配伍用法,先用25 mL 注射用水将注射用右雷佐生复溶成浓度为10 mg·mL-1溶液,参照本品说明书中载明的配伍溶液的浓度范围,再用乳酸钠林格注射液将复溶溶液稀释成浓度为1.3 mg·mL-1(溶液A)和3.0 mg·mL-1(溶液B)配伍溶液,或用醋酸钠林格注射液将复溶溶液稀释成浓度为1.3 mg·mL-1(溶液C)和3.0 mg·mL-1(溶液D)配伍溶液,测定室温下0、1、2 h 和2~8 ℃下0、2、4、6 h 溶液有关物质、相对含量、可见异物、不溶性微粒、溶液澄清度与颜色、pH 值。
2.1.2 溶媒为0.9%氯化钠注射液及5%葡萄糖注射液配伍溶液 参照日本上市的注射用右雷佐生注射液说明书的配伍用法,先用25 mL 注射用水将注射用右雷佐生复溶成浓度为10 mg·mL-1溶液,在本品说明书载明的配伍溶液的浓度范围的基础上,扩大浓度考察范围至(1.0~5.0)mg·mL-1,用0.9%氯化钠注射液将复溶溶液稀释成浓度为1.0 mg·mL-1(溶液E)和5.0 mg·mL-1(溶液F)配伍溶液,或用5%葡萄糖注射液将复溶溶液稀释成浓度为1.0 mg·mL-1(溶液G)和5.0 mg·mL-1(溶液H)配伍溶液,测定指标同“2.1.1”。
2.2 考察指标与判定标准
参照《中国药典》2020 年版四部通则0102[5]注射剂项下相关规定,结合本公司最新获批注射用右雷佐生国家药品注册标准(标准号:YBH15392021),对配伍后溶液进行有关物质、可见异物、不溶性微粒、溶液澄清度与颜色及pH 的考察。各项考察指标均应符合注射用右雷佐生国家药品注册标准(标准号:YBH15392021)。
2.3 考察方法
2.3.1 pH值参照《中国药典》2020 年版四部通则0631[4],测定“2.1”项下配伍溶液在室温下0、1、2 h和2~8 ℃下0、2、4、6 h 的pH 值。表明在室温2 h 内和2~8 ℃6 h 内,配伍溶液A~H 的pH 值均保持稳定。见表1。
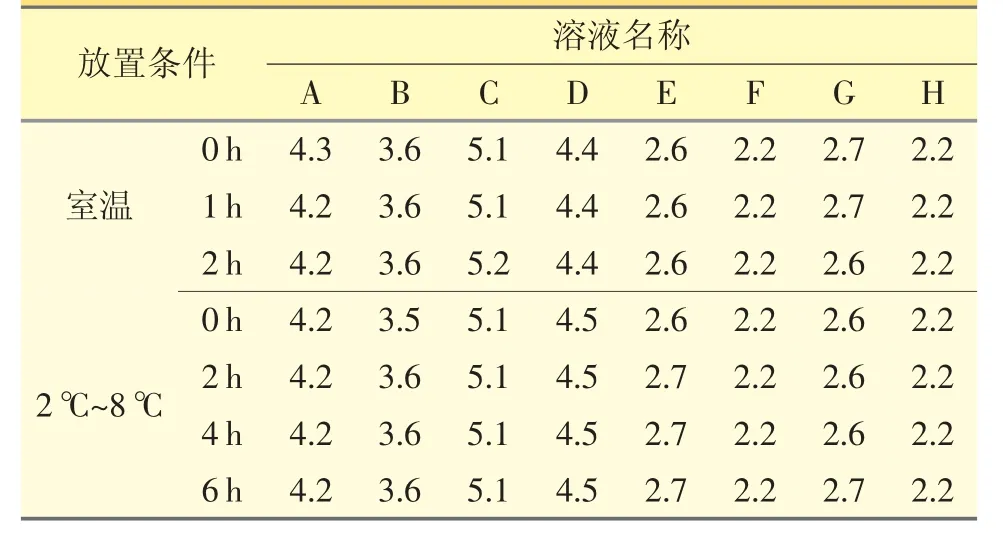
表1 注射用右雷佐生与不同溶媒配伍在室温和2~8 ℃条件下pH 值
2.3.2 可见异物和不溶性微粒 参照 《中国药典》2020 年版四部通则0904 和0903[4],测定“2.1”项下配伍溶液室温下0、1、2 h 和2~8 ℃下0、2、4、6 h 的可见异物和不溶性微粒。在室温2 h 内和2~8 ℃6 h内,配伍溶液均保持澄清,无肉眼可见漂浮物、混悬物等。按照《中国药典》2020 年版不溶性微粒光阻法测定要求,测定直径≥10 μm 和25 μm 的颗粒,在每个时间点,每次取配伍溶液1 mL,测定4 次,弃去第一次结果,后3 次平均值带入计算,溶液中微粒直径≥10 μm 应少于6000 粒,≥25 μm 应少于600粒,在室温2 h 内和2~8 ℃6 h 内,配伍溶液A~H 不溶性微粒均在规定范围内。见表2。

表2 注射用右雷佐生与不同溶媒配伍在室温和2~8 ℃条件下不溶性微粒
2.3.3 溶液澄清度与颜色 参照 《中国药典》2020年版四部通则0902 和0901[4],测定“2.1”项下配伍溶液室温下0、1、2 h 和2~8 ℃下0、2、4、6 h 的溶液澄清度与颜色。在室温2 h 内和2~8 ℃6 h 内,配伍溶液A~H 均保持澄清透明。颜色与《中国药典》规定标准橙黄色色号依次对比,配伍溶液A~H 颜色均不深于橙黄色1 号标准比色液。
2.4 有关物质测定
2.4.1 色谱条件 用十八烷基硅烷键合硅胶为填充剂;流动相A:0.01 mol·L-1磷酸盐缓冲液,流动相B:甲醇(梯度洗脱:0~15 min,100%A;15~45 min,100%→70%A;45~50 min,70%A;50~50.01分钟70%→100%A;50.01~60 min,100%A);检测波长:210 nm;流速:1.0 mL·min-1;进样量:10 μL。稀释液:0.1 mol·L-1盐酸溶液。
2.4.2 对照品溶液制备 精密称取右雷佐生对照品适量,用0.1 mol·L-1盐酸溶液溶解并稀释,制成浓度为1.0 mg·mL-1的对照品溶液。
2.4.3 专属性试验 精密量取“2.4.2”项下对照品溶液,0.1 mol·L-1盐酸溶液、乳酸钠林格注射液、醋酸钠林格注射液、0.9%氯化钠注射液、5%葡萄糖注射液各10 μL,按“2.4.1”色谱条件进样测定,见图1。
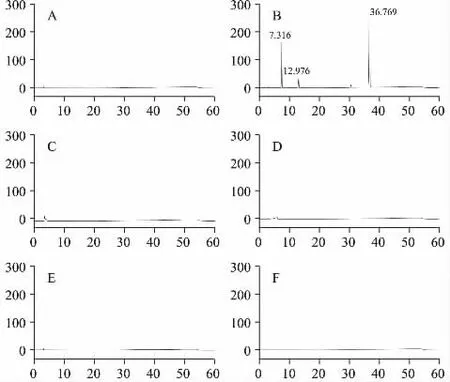
图1 专属性试验高效液相色谱图
结果表明,0.1 mol·L-1盐酸溶液和各溶媒对注射用右雷佐生测定无干扰,该方法专属性良好。
2.4.4 精密度试验 精密量取“2.4.2”项下对照品溶液10 μL,于同一天内,连续进样6 次,按“2.4.1”色谱条件进样测定,测得峰面积RSD%为0.77%。
2.4.5 准确度试验 精密称取样品适量,共9 份,分别精密加入对照品溶液,摇匀。制备成供试品溶液后进样测定,记录结果,并计算回收率,结果测得回收率在99.51%~100.4%,平均值为99.96%,RSD为0.3%。表明本方法的准确度良好。
2.4.6 配伍溶液稳定性考察 取“2.1”项下各溶液10 μL,按“2.4.1”色谱条件进样测定,计算杂质总量。在室温2 h 内和2~8 ℃6 h 内,杂质Ⅰ、杂质Ⅱ和其他杂质总量随时间变化逐渐缓慢增加,2~8 ℃条件显著延缓了杂质增长程度。见表3~表5。

表3 注射用右雷佐生配伍溶液在室温和2~8℃条件下杂质Ⅰ(%)
3 讨论
本研究中对注射用右雷佐生与醋酸钠林格注射液、0.9%氯化钠注射液、5%葡萄糖注射液进行配伍后,对配伍溶液室温2 h 内和2~8 ℃6 h 内,溶液稳定性进行了有关物质、可见异物、不溶性微粒、溶液澄清度与颜色及pH 的考察,以确定其在相关条件下溶液稳定性,并与乳酸钠林格注射液配伍后溶液的稳定性进行对比。结果表明,配伍溶液C~H 在室温2 h 内和2~8 ℃6 h 内,均能在规定范围内保持稳定,且稳定性趋势与配伍溶液A~B 一致,未出现影响质量的变化。

表4 注射用右雷佐生配伍溶液在室温和2~8℃条件下杂质Ⅱ(%)

表5 注射用右雷佐生配伍溶液在室温和2~8 ℃条件下其他杂质总量(%)
本研究表明,改变溶媒并未对注射用右雷佐生配伍溶液的稳定性造成影响。影响配伍溶液稳定性的主要是放置时间和放置条件。配伍后溶液在室温条件下2 h 内稳定,在2~8 ℃条件下6 h 内稳定。冷藏可使配伍溶液保存时间更长,在临床使用时,如遇到无法立刻使用的特殊情况,应将注射用右雷佐生的配伍溶液进行冷藏保存。使用不同溶媒出现的配伍溶液pH 值的变化,与相关溶媒的pH 调节能力有关;但配伍溶液A~H 的pH 值在考察时间内基本无变化,且均符合使用要求,提示配伍溶液稳定性并未发生改变。对有关物质进行考察,杂质Ⅰ和杂质Ⅱ均为体内代谢活性成分,不影响体内的安全性,杂质Ⅰ、杂质Ⅱ和其他杂质总量均符合本品的质量标准。
本研究结果提示,注射用右雷佐生可与乳酸钠林格注射液、醋酸钠林格注射液、0.9%氯化钠注射液、5%葡萄糖注射液进行配伍,在说明书规定的时间和条件内使用,均可保障其安全性和有效性。醋酸钠林格注射液、0.9%氯化钠注射液、5%葡萄糖注射液,均可以替代乳酸钠林格注射液使用。