LC-MS/MS 法测定人血浆中噻托溴铵的含量及其药动学研究
2022-07-15林志昊
刘 靥,林志昊,丁 黎*
1 中国药科大学 药学院药物分析系,南京 210009;2 南京科利泰医药科技有限公司,南京210009
慢性阻塞性肺病(COPD)是一种慢性炎症性气道疾病[1,2]。噻托溴铵是具有特异选择性的抗胆碱药物,可以治疗COPD。该药物与人体呼吸道中的M1、M2、M3 毒蕈碱受体具有相似的亲和力,一次性吸人对支气管的扩张作用可持续24 h,可作为长效药[3]。噻托溴铵作用于人体呼吸道,被制成粉剂通过吸入给药,由于给药剂量低至18 μg,故需要开发一种高灵敏度的分析方法以评价其人体药动学特征。目前报道的几种血浆中噻托溴铵LC-MS/MS 检测法中,有取400 μL 血浆样品经蛋白沉淀后再检测的方法,其定量下限可以达到0.5 pg·mL-1[4];有取2 mL 血浆样品经固相萃取再检测的方法,其定量下限可以达到1.5 pg·mL-1[5];有取0.5 mL 血浆样品经2 步液-液萃取再采用二维UPLC-MS/MS 检测的方法,其定量下限可以达到0.2 pg·mL-1[6]。以上几种方法,操作繁琐且样品用量较大,不适合使用96 孔板进行高通量样品处理,且灵敏度也有一定的局限性。噻托溴铵粉吸入剂人体生物等效性研究和单次给药药动学研究的给药剂量均为18 μg,在该给药剂量条件下,某些志愿者服药后血浆中噻托溴铵的峰浓度不足2 pg·mL-1,根据《化学药物制剂人体生物利用度和生物等效性研究技术指导原则》,其定量下限应能满足测定3~5 个消除半衰期时、样品中的药物浓度或能检测出Cmax的1/10~1/20 时的药物浓度,0.2 pg·mL-1的定量下限不足以满足测定要求,故有必要将检测的定量下限设定在0.1 pg·mL-1。本实验建立了采用96 孔板高通量处理噻托溴铵血浆样品LCMS/MS 检测血药浓度新方法,该法定量下限可以达到0.1 pg·mL-1,并且可以应用于噻托溴铵粉吸入剂的人体生物等效性评价及低剂量单次给药的人体药代动力学研究。
1 材料与方法
1.1 药品和试剂
噻托溴铵对照品(加拿大ECO Research Chemicals 公司,纯度:98.9%,批号:CT-11210-08);噻托溴铵-d6(加拿大Toronto Research Chemicals 公司,纯度:98.84%,批号:28-JHY-165-1);噻托溴铵粉吸入剂(18 μg,Boehringer Ingelheim Pharma GmbH &Co.KG,批号:001643);甲醇、乙腈为色谱纯;甲酸、醋酸铵为分析纯;水为超纯水。
1.2 仪器
ExionLC AD 高效液相色谱仪(日本岛津公司);Triple QuadTM6500+质谱仪(Applied Biosystems/Sciex 公司);十万分之一电子天平(中国梅特勒托利多公司)。
1.3 液质条件
色谱条件:ACE Excel 3 AQ 色谱柱(100 mm×2.1 mm,3 μm,ACE);流动相A 为含0.1%甲酸和10.0 mmol·L-1醋酸铵水溶液,流动相B 为甲醇,线性梯度(A∶B)洗脱:0 min→0.4 min(75∶25)→0.5 min→3.0 min(65∶35)→3.1 min→4.6 min(0∶100)→4.7 min(75∶25);柱温:40 ℃。
质谱条件:采用电喷雾离子化(ESI),正离子模式,多反应监测(MRM),裂解电压为5000 V,气帘气压力为241 kPa,雾化气压力为207 kPa,辅助气压力为241 kPa,干燥气温度600 ℃,检测反应离子对:噻托溴铵m/z392.1→152.1,噻托溴铵-d6 m/z 398.1→158.1。
1.4 溶液的配制
精密称取噻托溴铵与噻托溴铵-d6 对照品适量,经质量校正后,以甲醇溶解分别得到噻托溴铵与噻托溴铵-d6 储备液各1.00 mg·mL-1。将噻托溴铵的储备液以50%的甲醇水溶液稀释为一系列浓度分别为2、4、12、40、120、200、320 pg·mL-1的标准曲线工作液,以及浓度为2、5、20、100、240 pg·mL-1的质控工作液;以50%甲醇水溶液稀释噻托溴铵-d6 储备液,配制成浓度为20.0 pg·mL-1的内标工作液。
1.5 标准曲线和质控样品的配制
采用空白血浆配制标准曲线和质控样品。取380 μL 空白血浆,加入20 μL 的标准曲线工作液,配成浓度分别0.1、0.2、0.6、2、6、10、16 pg·mL-1的标准曲线样品,以及浓度分别为0.1 pg·mL-1(LLOQ QC,定量下限质控样品)、0.25 pg·mL-1(LQC)、1 pg·mL-1(GMQC,几何均值中浓度质控样品)、5 pg·mL-1(MQC,中浓度质控样品)、12 pg·mL-1(HQC,高浓度质控样品)的质控样品。
1.6 样品前处理
在冰浴上,分别向两块96 孔板加入150 μL 样品与25 μL 的内标工作溶液,涡旋1 min,再分别加入525 μL 含1%甲酸的乙腈溶液,涡旋10 min,在室温下4000 r·min-1离心10 min;将两块平行处理的96 孔板各取500 μL 上清液转移至一块干净的96孔板中,于40 ℃下以氮气流吹干,吹干的固体物以150 μL 超纯水复溶,涡旋,离心3 min 后取20 μL 上清液进样检测。
1.7 药代动力学研究
本实验经长沙市第三医院伦理委员会批准,临床受理号为CYHL2000007。14 名健康志愿者经体检证明心、肝、肾功能正常,肺活量FEV1 实测值/FEV1 预计值>80%,均符合志愿者入选条件。试验前志愿者均签署知情同意书,试验期间统一饮食。
14 名健康志愿者,在前一天晚上禁食10 h 之后,每位志愿者借助于给药设备经口吸入噻托溴铵粉吸入剂1 粒。于给药前及给药后于1、2、3、4、5、6、8、10、15、20、30、45 min,1、2、4、8、12、24、36、48、60、72、84、96 h 采集静脉血4.5 mL,将之加入到预冷的含乙二胺四乙酸二钾(EDTA-K2)抗凝剂的真空采血管中,在4 ℃下、1700×g 离心10 min,冰浴条件下分离血浆,于-70 ℃冰箱中保存待测。
2 结果
2.1 选择性,线性以及定量下限
空白基质中待测物或内标保留时间其他因素无显著干扰。见图1。噻托溴铵标准曲线在线性范围0.1~16 pg·mL-1线性良好,采用加权(Y=1/X2)最小二乘法,待测物质量浓度C(pg·mL-1)为横坐标X,以待测物峰面积与内标峰面积比值(Ai)为纵坐标Y,进行线性回归,求得回归方程。通过计算,噻托溴铵的方程为:Y=1.274×102X+2.483×103,r2=0.998 3。科学计数法表示:Y=0.127 4X+2.483×10-3。

图1 血浆样品噻托溴铵与噻托溴铵-d6 的LC-MS/MS测定色谱图
2.2 准确度和精密度
6 个重复的质控样品(LLOQ QC、LQC、GMQC、MQC 和HQC)按“1.6 样品前处理”操作,根据随行标准曲线求得实测浓度,在同一分析批中和连续3个分析批中评估批内与批间的准确度(以相对误差RE 计)与精密度(以相对标准偏差RSD 计)。见表1。

表1 人血浆中噻托溴铵测定的准确度与精密度
2.3 基质效应和提取回收率
考察3 个浓度水平的样品(0.25、5、12 pg·mL-1),以经过提取所得的待测物色谱峰面积与未经提取直接进样所得的待测物色谱图峰面积之比,来考察样品的提取回收率,每个浓度水平样品进行6 样本分析。结果所有浓度水平的血浆中噻托溴铵的提取回收率在75.6%~84.8%,精密度RSD<6.6%。说明该方法的提取回收率良好。
6 个不同来源含稳定剂的空白人血浆,按“1.6”项下方法处理后,加入不同浓度噻托溴铵标准溶液及内标,作LC-MS/MS 分析,获得峰面积与相同浓度混合标准品溶液及内标溶液直接进样获得峰面积、比较评价基质效应,噻托溴铵基质效应为100.1%~104.3%。表明该方法的基质效应可以忽略不计。
2.4 稳定性试验
配制两个浓度质控样品(LQC、HQC)并将其置于不同存放条件下,考察其稳定性。稳定性数据见表2。全血样品在冰浴条件下2 h 稳定;处理后的样品在自动进样器中5 天4 h 稳定。
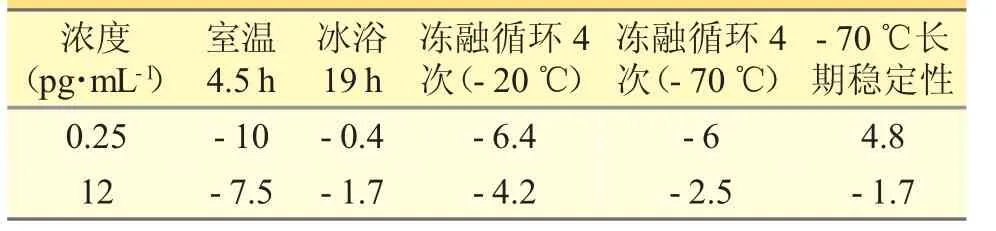
表2 噻托溴铵在不同存放条件下的血浆稳定性的RE 值(n=3,%)
2.5 药代动力学研究
按血浆样品测定方法进行样品处理与测定,按随行标准曲线计算浓度。主要药代动力学参数使用Phoenix WinNonlin software(version 6.4)依赖非房室模型计算,14 名志愿者血浆中噻托溴铵的平均药时曲线图见图2,其药代动力学参数见表3。

表3 噻托溴铵的主要药代动力学参数

图2 14 例健康志愿者空腹经口吸入噻托溴铵粉吸入剂噻托溴铵的血药浓度均值-时间曲线
3 讨论
本实验为达到0.1 pg·mL-1的定量下限,向两块96 孔板中分别加入150 μL 样品与25 μL 的内标,经蛋白沉淀后,再将两块板的上清液合并至一块96 孔板中吹干,达到富集待测物的作用,提高了灵敏度。
在实验中发现,将两个浓度的质控样品(LQC、HQC)放置室温下18 h 后,待测物的含量与新鲜配制的质控样品相比,其含量降至45%(LQC)、48%(HQC),而噻托溴铵工作溶液在室温下19 h 稳定性良好,可排除工作溶液降解的可能。经分析,噻托溴铵结构中含有酯键,易被血浆中的酯酶水解。由于低温可以降低酶促反应速率[7],故考察将质控样品放置于冰浴条件下待测物的降解情况,结果表明,冰浴16 h 人血浆中噻托溴铵的相对含量为98.0%(LQC)、99.1%(HQC),故实验在冰浴条件下操作。