系统性硬化症163例临床分析
2022-07-15蔡金云孙瑞希寸杏珠熊瑞芳
蔡金云 傅 萍 孙瑞希 寸杏珠 熊瑞芳
1昆明医科大学第二附属医院风湿免疫科,昆明,650101;2现工作单位:攀枝花市中心医院风湿免疫科,攀枝花,617000
系统性硬化症(systemic sclerosis,SSc)是一类以纤维化、胶原过度沉积于皮肤和内脏器官、多系统受累为特点的自身免疫性疾病。该病分为5种亚型[1]:(1)弥漫性皮肤系统硬化症(diffuse cutaneous systemic sclerosis,dcSSc);(2)局限性皮肤系统硬化症(limited cutaneous systemic sclerosis,lcSSc);(3)无皮肤表现的系统性硬化(sine scleroderma);(4)重叠综合征;(5)未分化结缔组织病(undifferentiated connective tissue disease,UCTD)。目前发病机制尚不清楚,多认为是环境因素作用于遗传易感个体,诱导免疫系统激活及血管损伤,进而出现皮肤和内脏纤维化[2]。2018年,我国发布了《第一批罕见病目录》,SSc和IgG4相关疾病是其中仅有的2种风湿性疾病。现对SSc患者进行疾病特点分析,以增加对该罕见病的认识。
1 临床资料
1.1 一般资料 2015年1月至2020年12月昆明医科大学第二附属医院风湿免疫科住院SSc患者163例,男 56例,女107例, lcSSc 49 例(30.1%),dcSSc 95例(58.3%),重叠综合征14 例(8.6%),UCTD 4 例(2.5%)和sine scleroderma 1例(0.6%)。年龄10~83(44.95±15.07)岁,以中老年患者(30~60岁)多见(106例,65.0%),病程1.50(0.50,4.00)年。诱因:长期接触粉尘15例(9.2%),因寒冷天气未注意保暖出现雷诺现象10例(6.1%),外伤后5例(3.1%),暴晒后3例(1.8%),以注射部位皮肤出现硬结2例(1.2%),徒手接触大量农药1例(0.6%)。既往史:高血压16例(9.8%),糖尿病5例(3.1%),脑梗塞4例(2.5%),冠心病2例(1.2%),眼睑肿瘤术后10年患者1例(0.6%)。合并症:甲状腺功能减退3例(1.8%),多发性骨髓瘤1例(0.6%)。个人史:吸烟史42例(25.8%),饮酒史38例(23.3%)。所有患者均无家族史。来源及职业:农村92例(56.4%),城市71例(43.6%); 农民76例(47.0%),退休26例(16.0%),职员14例(8.6%),工人13例(8.0%),学生9例(5.5%),自由职业9例(5.5%),无业7例(4.3%),教师6例(3.7%),医务人员3例(1.8%)。本研究经医院伦理委员会批准(审-PJ-2021-46),患者或家属均知情同意并签署知情同意书。
1.2 病例选择标准 (1)入选标准: SSc均符合2013年美国风湿免疫学会(American College of Rheumatology,ACR)/欧洲风湿病联盟(European League against Rheumatism collaborative initiative,EULAR)颁布的SSc分类标准[3];(2)排除标准:接触化学物、毒物所致硬皮样综合征者,硬肿病、硬化性黏液水肿、嗜酸性筋膜炎、慢性移植物抗宿主病、肾源性系统性纤维化、硬化萎缩性苔藓和僵硬皮肤综合征等类似疾病,活动性感染、肿瘤、其他自身免疫性疾病及病史资料不全的患者。
1.3 临床表现 皮肤病变一般经历水肿、硬化、萎缩三期,但无具体的过渡变化时间。皮肤表现:肿胀18例(11.0%), 硬化106例(65.0%),萎缩11例(6.7%)。SSc患者163例平均mRSS评分[4]12.0(7.0,16.0)分。累及脏器组织:雷诺现象(51.0%),肺受累78例(47.9%),心脏39例(24.0%),间质性肺病(Interstitial Lung Disease,ILD) 55例(33.7%),胸腔积液22例(13.5%),肺动脉高压23例(14.0%),消化道受累71例(43.6%),食管41例(25.2%),张口受限40例(24.5%),吞咽困难23例(14.1%),返流或烧心14例(8.6%),伸舌受限11例(6.7%),饮水呛咳4例(2.4%),体重减轻38例(23.3%)。关节受累74例(45.4%),肌肉受累8例(5.0%),肾脏受累8例(5.0%)。
1.4 实验室检查 152例(93.3%)抗核抗体(anti-nuclear antibody,ANA)阳性,93例(57.1%)抗拓扑异构酶1抗体(anti-topoisomerase I antibody,Scl-70)阳性,21例(12.9%)抗着丝点抗体(anti-centromere antibody,ACA)阳性,21例(12.9%)RNP/SM阳性,41例(25.2%)抗干燥综合征A抗原抗体(Sjögren’s Syndrome A antigen,SSA)阳性,7例(4.3%)抗SSB抗体阳性,34例(20.9%)抗Ro-52抗体阳性,5例(3.1%)抗PM-Scl抗体阳性。
血液系统受累41例(25.2%):贫血30例(轻度贫血23例,中度贫血7例)(18.4%),红细胞平均体积(MCV) 89.50(83.55,93.75)fl,平均红细胞血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)(%) 28.90%(26.85%,31.50%),均为正细胞性贫血。白细胞减少19例(11.7%),血小板减少4例(2.5%);同时有两系损害者:白细胞减少+贫血9例(5.5%),贫血+血小板减少3例(1.8%)。血液系统受累者呈面具脸16例(9.8%)。见表1。

表1 SSc有无血液系统受累患者临床特点比较 例(%)
血液系统受累患者肾脏受累发生率及Coombs、抗RNP/SM抗体阳性率高于未受累者,球蛋白、免疫球蛋白G(IgG)、IgA、红细胞沉降率(ESR)、C反应蛋白(CRP)、白细胞介素6(IL-6)、铁蛋白水平高于未受累者(P<0.05),见表2,3。将P<0.1的自变量的纳入多因素logistic回归分析得出球蛋白是SSc累及血液系统的独立危险因素。

表2 SSc有无血液系统受累患者实验室指标阳性例数比较 n(%)
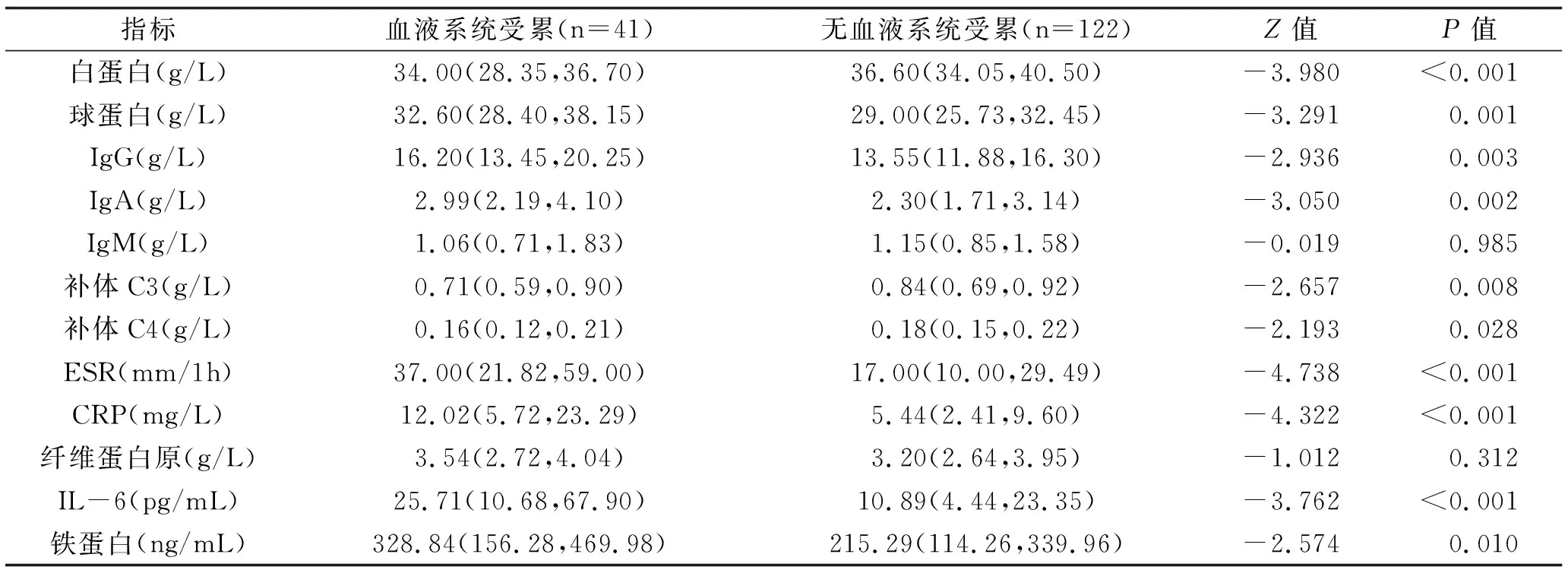
表3 SSc有无血液系统受累患者实验室指标水平比较 M(P25,P75)
1.5 诊断及鉴别诊断 依据2013年ACR/EULAR分类标准,双手手指皮肤增厚至掌指关节近端是SSc足以诊断的标准,但不适用于局灶型硬皮病、嗜酸性筋膜炎、硬化萎缩性苔藓、水肿性硬化病、肾源性硬化性纤维化等更好解释皮肤增厚的其他疾病,不适用于无肢端硬化的皮肤增厚。163例中42例(25.8%)患者行病理检查,38例(23.3%)患者符合SSc改变:真皮增厚,胶原纤维肿胀、融合,血管周围淋巴细胞浸润;其中1例(0.6%)患者外周血嗜酸粒细胞计数升高,但筋膜活检未见嗜酸粒细胞浸润,排除嗜酸性筋膜炎。1例(0.6%)患者活检示真表皮交界处嗜伊红性物质团块状沉积,真皮胶原束粗大,提示皮肤淀粉样变可能,行淀粉(刚果红染色)染色:阴性,黏蛋白(阿辛蓝染色)染色:真皮层嗜碱性黏蛋白沉积,最终诊断黏蛋白沉积。1例(0.6%)皮肤活检表皮大致正常,真皮内血管周围灶性淋巴细胞、组织细胞浸润,查见抗酸杆菌。组织液五点取材:BI值:1.6,排外SSc,最终诊断为麻风。
12例(7.4%)患者误诊为硬斑病,3例(1.8%)患者误诊为类风湿关节炎,2例(1.2%)患者误诊为天疱疮,1例(0.6%)患者误诊为白癜风,1例(0.6%)患者误诊为过敏性皮炎,1例(0.6%)误诊为嗜酸性粒细胞增多性皮炎。
1.6 治疗与预后 所有患者均采用综合治疗。150例(92.0%)患者使用糖皮质激素(GC)联合抗风湿药(DMARDs):环磷酰胺50例(30.7%)、吗替麦考酚酯33例(22.2%)、甲氨蝶呤20例(12.3%)、硫唑嘌呤15例(9.2%)、羟氯喹10例(6.1%)、沙利度胺5例(3.1%)、环孢素5例(3.1%)、雷公藤3例(1.8%)、环孢素3例(1.8%)、白芍总苷3例(1.8%)、来氟米特2例(1.2%)、昆仙胶囊1例(0.6%)。13例(8.0%)患者使用糖皮质激素联合DMARDs及托珠单抗(tocilizumab,TCZ)治疗。辅以前列腺素类似物、硝苯地平改善循环,PPI抑酸护胃等对症支持治疗。73例(44.8%)患者口服积雪苷片治疗,其中10例(13.7%)患者局部外用积雪苷软膏。GC中选用甲泼尼龙片(2~24 mg)或醋酸泼尼松片(2.5~30 mg)口服,依据肺脏、肾脏等脏器受累情况,逐渐减量停用,半年内减停。
14例(8.6%)患者在坚持使用糖皮质激素联合DMARDs治疗6个月后,IL-6、CRP、ESR、铁蛋白、mRSS评分与基线水平相比,无差异(P>0.05)。见表4。
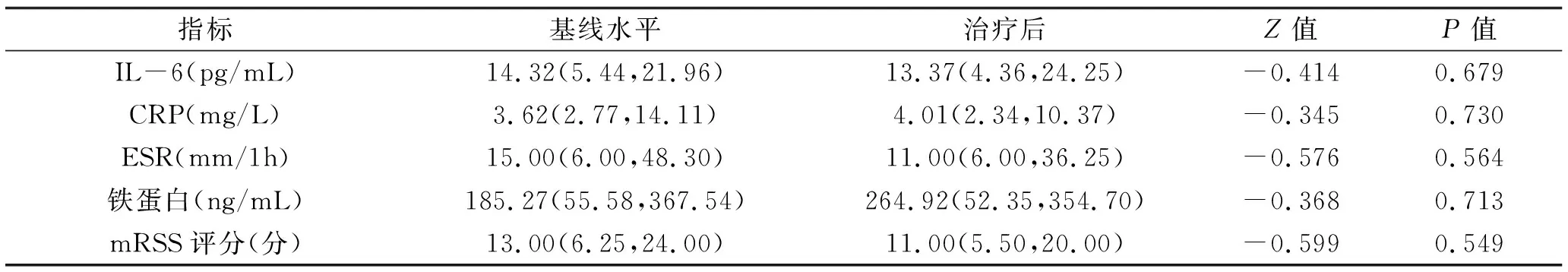
表4 接受GC联合DMARDs治疗的14例患者治疗前后的差异比较 M(P25,P75)
使用TCZ 8 mg/kg治疗的13例(8.0%)患者,治疗6个月后的ESR、mRSS评分较基线水平降低(P<0.05)。见表5。

表5 接受GC联合DMARDs+TCZ治疗的13例患者治疗前后的差异比较 M(P25,P75)
2 讨论
系统性硬化症是一种可累及各器官系统的罕见自身免疫性疾病,皮肤和内脏器官广泛的微血管损害和组织纤维化为其特征,临床表现复杂多样。雷诺现象是最早及最为常见的临床表现,皮肤硬化是其标志性病变,消化道是仅次于皮肤最常见的受累部位,其次是肺部受累,其中ILD是最常见的肺部并发症,硬皮病肾危象是其严重并发症[5,6]。
本研究以雷诺现象最多见(51.0%),其次是肺受累(47.9%),血液系统受累少见(25.2%)。
自身免疫性疾病合并血液系统损害的报道多来自于系统性红斑狼疮、类风湿关节炎、(干燥综合征)SS,在SSc中仅有少量报道,以贫血最为常见,其原因为慢性炎症性贫血、吸收不良、胃肠道黏膜毛细血管扩张、微血管内溶血性贫血[7],SSc并发血液系统损害提示病情更严重[8]。在本研究中,41例患者(25.2%)出现血液系统损害,以贫血为主要表现,其次是白细胞减少,与既往研究相符。既往研究发现抗核糖体P蛋白抗体阳性是血液系统损害的危险因素[8],抗核糖核蛋白(nuclear ribonucleoprotein,nRNP)抗体阳性是血小板减少的危险因素[9],本研究发现球蛋白水平升高是SSc累及血液系统的独立危险因素。SSc出现高球蛋白血症提示疾病炎症活跃,易与其他自身免疫性疾病重叠[7],本研究中贫血类型为正细胞性贫血,血液系统受累者较未受累者更易出现IL-6、ESR、CRP等炎症指标及自身抗体的异常,其中9例(5.5%)患者为重叠综合征(5例患者重叠系统性红斑狼疮、2例患者重叠SS、2例重叠类风湿关节炎),4例(2.5%)患者腹部超声提示脾脏增大(无巨脾)。表明血液系统损害可能与疾病活动、重叠其他自身免疫性疾病、免疫功能紊乱导致自身抗体产生、进而破坏血细胞相关,与脾功能亢进是否相关还需进一步研究。
虽SSc为罕见病,但依据典型的皮肤硬化表现及Scl-70、ACA、抗RNA聚合酶Ⅲ抗体等特异性自身抗体,其诊断并不困难[10]。但由于其发病机制不明,目前尚无确切有效的治疗方法,心肺受累是主要的致死原因。传统的DMARDs药物仍然是最重要的一线治疗药物,尤其环磷酰胺与吗替麦考酚酯,弥漫性皮肤受累者可用甲氨蝶呤[11]。当前一些抗纤维化药物、生物制剂及小分子激酶抑制剂是研究的热点。有研究证实吡非尼酮能够改善SSc-ILD患者的肺纤维化进程,提高生存率[12]。小分子酪氨酸激酶抑制剂尼达尼布能够有效降低SSc-ILD患者用力肺活量的下降速率[13]。这两种药物已被美国食品药品监督管理局(FDA)批准用于ILD治疗。
有研究表明IL-6参与了SSc发病的多个环节[14],TCZ是一种重组人源化抗IL-6受体的单克隆抗体。在SSc的治疗中,国外一系列病案报道及Ⅱ期临床试验结果表明TCZ能改善皮肤硬化[15],在104例dcSSc-ILD患者中进行的Ⅲ期临床试验得出TCZ能保护肺功能[16]。在SSc的治疗中,FDA授予了TCZ突破性治疗指定资格。国内的10 例患者[17]在接受TCZ 8 mg/kg治疗6个月后,皮肤硬化及肢端溃疡有改善趋势,但治疗前后的差异无统计学意义。本研究也发现类似结果,13例患者接受糖皮质激素联合DMARDs及TCZ 8 mg/kg治疗6个月后,mRSS评分、血沉较基线水平降低;但接受糖皮质激素联合DMARDs治疗的患者治疗前后的差异无统计学意义。因目前TCZ价格昂贵,使用其治疗的患者人数较少,还需增加样本量,最好进行前瞻性研究以进一步观察TCZ治疗SSc的疗效。
本研究存在一些局限性:SSc为罕见病,发病率低,本研究为单中心研究,样本量较少,代表性不强,可进行前瞻性研究,在更大的样本量下以更高的检验效能分析其疾病特点。
