发酵罐中不同菌源降解甘肃煤和内蒙古煤产甲烷效果分析*
2022-07-14陈林勇任恒星关嘉栋
郭 鑫 陈林勇 任恒星 关嘉栋 赵 晗 赵 娜
(煤与煤层气共采国家重点实验室,048000 山西晋城;易安蓝焰煤与煤层气共采技术有限责任公司,048000 山西晋城)
0 引 言
2020年,我国煤炭消费量占能源消费总量的56.8%,呈现出逐年下降的趋势[1],但从短期来说,煤炭在我国一次能源结构中仍将占主导地位[2]。为探寻解决煤炭利用带来的环境污染问题,寻求煤炭清洁高效利用方法已成为国内外研究的热点。SCOTT[3]提出次生生物气的形成,微生物降解煤可以产生甲烷,该技术的核心机理是微生物降解煤产甲烷,也即生物成因煤层气的生成机理。煤中的芳香族及木质素衍生的复杂碳水化合物(包含氮、硫、氧)可以作为碳源被微生物生物降解[4-9]。这种方法既能提高煤层气储量,又能增加煤层渗透性,提高煤层气采收率,是实现煤炭清洁利用的新思路[10]。
STRAPOC et al[5,11]在研究了伊利诺伊盆地生物成因气及相关微生物群落结构后,提出微生物厌氧降解煤产甲烷的大致途径。GREEN et al[12]从粉河盆地煤层气田产出水中富集了降解煤产甲烷的微生物菌群。王爱宽等[13-14]从褐煤中富集了厌氧微生物菌群,在后续的生物降解煤模拟实验中证实该菌群能够降解褐煤产甲烷,且生物源甲烷主要通过乙酸发酵途径生成,培养后期部分甲烷具有二氧化碳还原成因。FALLGREN et al[15]通过采集澳大利亚、印尼和中国的褐煤煤样进行了本源微生物降解煤产甲烷实验,结果表明,通过添加营养物质激活褐煤中的本源微生物产生甲烷是可行的。林海等[16-17]从厌氧污泥中富集了产甲烷外源菌群,并以煤为碳源对其进行了驯化,证明外源菌群可利用煤产甲烷。苏现波等[18-19]对微生物降解煤产甲烷进行了一系列实验模拟研究,结果发现,盐度、pH值和氧化还原电位都会影响低煤阶煤的生物甲烷生成。
国内研究大部分利用小型煤炭生物产气装置进行小试实验,本实验以微生物降解煤的理论为基础,在前期研究基础上,利用自主设计研发的190 L发酵罐开展本源菌群和活性污泥外源菌群对内蒙古地区和甘肃地区的煤进行微生物降解产甲烷中试放大实验,探究外源菌和本源菌的煤降解产甲烷效果。
1 实验部分
1.1 材料
1.1.1 煤样与菌群
实验煤样分别为内蒙古神华北电胜利露天煤矿5号煤层的褐煤(SL)和甘肃庆阳宁县的长焰煤(NX),埋深分别为约100 m和800 m~1 000 m。取样后,快速将所取煤样置于自制的厌氧煤样罐中,充入氮气驱替内部空气,最终保持罐内一定正压的氮气。煤样的工业分析采用SDLA618型工业分析仪(湖南三德科技股份有限公司)检测,按照GB/T 30732-2014《煤的工业分析方法》操作进行,结果见表1。
实验中的本源菌分别取自甘肃庆阳煤层气井的排采水和内蒙古煤层缝隙渗水,外源菌取自厌氧消化池中的活性污泥。水样中的菌群经过富集培养驯化后进行本源菌产气实验,污泥中的菌群经过驯化后进行外源菌产气实验。

表1 煤样的工业分析Table 1 Proximate analysis of coal samples
1.1.2 主要仪器和试剂
HIRAYAMA HVE-50型灭菌锅(日本,平山制作所株式会社)、球磨机(镇江市丰泰化验制样设备有限公司)、DWS型厌氧操作箱(英国,Don Whitley Scientific公司)、BX41型荧光显微镜(日本,奥林巴斯公司)、安捷伦7890A型气相色谱仪(美国,安捷伦科技有限公司)、自制可控温50 L和190 L发酵罐、自制煤样罐、LRH-500F型恒温培养箱(青岛明博环保科技有限公司)、SDLA618型工业分析仪,乙酸钠和葡萄糖等主要试剂购自国药集团。
1.1.3 培养基
营养液:EDTA 0.5 g/L,酵母2 g/L,K2HPO42.9 g/L,KH2PO41.5 g/L,NH4Cl 1.8 g/L,MgCl20.4 g/L,微量元素液100 μL/L,维生素液50 μL/L。
微量元素:FeCl2·4H2O 1.5 g,ZnCl20.07 g,MnCl2·4H2O 0.1 g,H3BO30.006 g,CoCl2·6H2O 0.19 g,CuCl2·2H2O 0.002 g,NiCl2·2H2O 0.024 g,NaMoO4·2H2O 0.036 g,Na2SeO31×10-7g,AlKPO40.000 01 g,纯水10 mL。
维生素:生物素0.002 g,叶酸0.002 g,盐酸吡哆辛0.01 g,核黄素0.005 g,硫胺素0.005 g,烟酸0.005 g,泛酸钙 0.005 g,微生物B120.000 1 g,硫辛酸0.005 g,对氨基苯甲酸0.005 g,纯水100 mL。
1.2 实验方法
1.2.1 菌群的驯化实验
将煤样进行破碎,研磨成粒径为0.15 mm左右的煤粉作为驯化底物[20-21],本源菌水样和活性污泥中的厌氧菌群驯化实验在实验室自己研发的50 L发酵罐中进行。在1#,2#,3#罐中分别加入20 L内蒙古煤层气井排采水、20 L甘肃煤层气井排采水和5 L活性污泥,三个罐体内均加入500 g煤粉,并添加营养液至40 L,从发酵罐底部向上曝气20 min,达到驱除罐体以及液体中的氧气,并使得菌源、煤粉、营养液混合均匀。置于35 ℃恒温室静置培养60 d,即可得到富集驯化菌液[22]。为保证菌源的活性,从采样到装罐要尽快完成。
1.2.2 本源菌与外源菌发酵产气实验
首先,将风干后煤样破碎为2 cm左右大小的煤块后,加入10 kg至190 L发酵罐中,随后,按照实验组成,将各成分尽快加入至190 L发酵罐中,封闭罐体,启动液体循环泵,罐体由下至上通入高纯氮气30 min,达到驱除罐体和液体中的氧气,并使得菌源和营养液混合均匀。每天进行气体组分测定。本源菌和外源菌降解煤产气实验方案见表2。
发酵罐内产生气体的体积使用理想气体状态方程计算,公式如下:
(1)
式中:p1为发酵罐内压力,kPa;t1为发酵罐内温度,℃;V1为发酵罐上浮体积,65 L;p2为标准大气压,101.3 kPa;t2为环境温度,℃;V2为发酵罐产生气体体积,L。
产甲烷总量VCH4(L)公式如下:
VCH4=V2×φCH4
(2)
式中:φCH4为测得甲烷的体积分数,%。
甲烷产率Y(mL/g)使用如下公式计算:
Y=VCH4/m煤
(3)
式中:m煤为10 kg。
1.2.3 甲烷体积分数的测定
甲烷体积分数的测定采用安捷伦7890A型气相色谱仪进行测定。色谱柱为Agilent Carbonplot(60 m×320 μm),载气为高纯N2。填充柱进样口温度为150 ℃,隔垫吹扫流量为3 mL/min,进样量为500 μL,柱箱温度为25 ℃,保持7.5 min,检测器为TCD,检测温度为200 ℃,参比流量为400 mL/min,尾吹流量为8 mL/min。
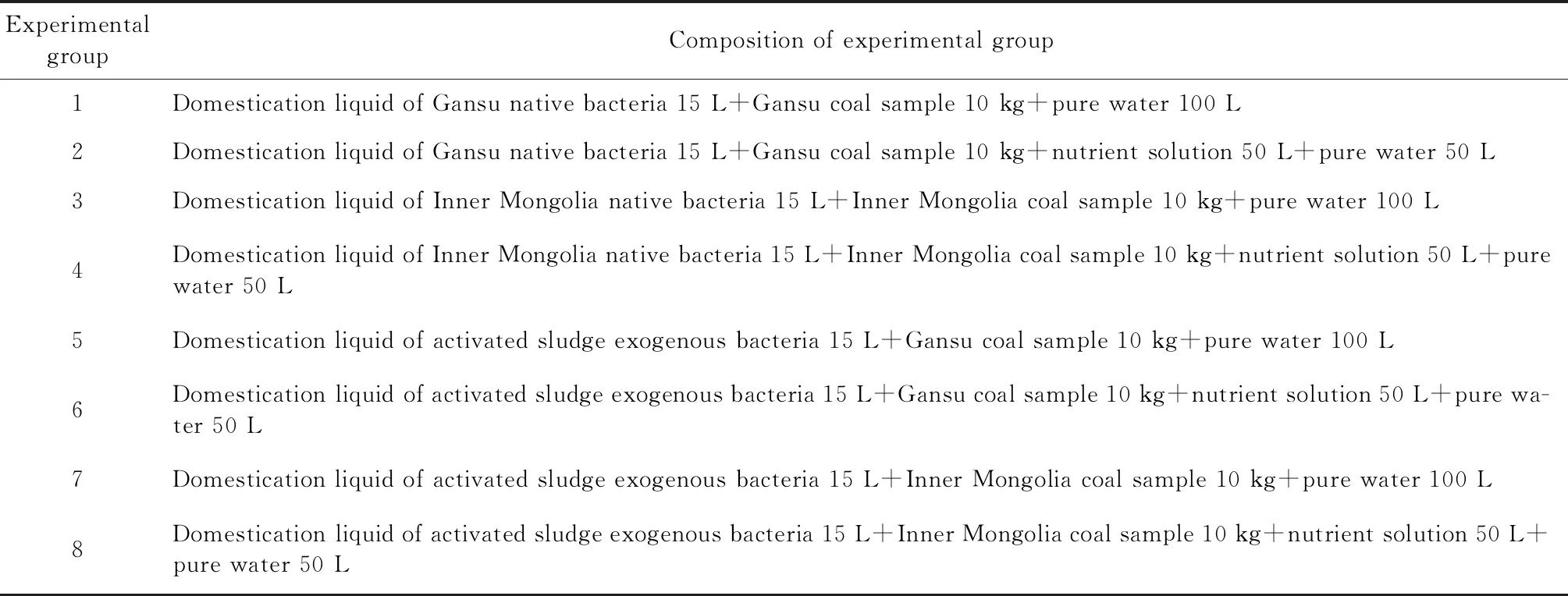
表2 本源菌和外源菌降解煤产气实验方案Table 2 Test schemes for methane production from degraded coal by native bacteria and exogenous bacteria
煤降解产生的气体中甲烷体积分数计算公式如下:

(4)
式中:ACH4(实际出峰)为甲烷实际出峰面积;φCH4(甲烷标准气体)为甲烷标准气体中甲烷的体积分数,%;ACH4(平均峰)为甲烷平均峰面积;甲烷标准气体组分为:CH420%(体积分数,下同),H25%,CO220%,N2平衡。
2 结果与讨论
2.1 本源菌降解煤产气特性
2.1.1 本源菌降解甘肃煤的产气特性
图1所示为1号和2号实验组的发酵罐压力和甲烷体积分数以及产甲烷总量。由图1可以看出,两个实验组的煤降解产甲烷发酵过程均经过了产气量缓慢增长、显著增高和趋于减缓三个阶段。1号实验组最高产甲烷总量为8.97 L(实验中产甲烷总量均为各实验组稳定结束后的第50天),出现在发酵的第32天,发酵罐最高压力达45.80 kPa,最高甲烷体积分数为30.57%。2号实验组最高产甲烷总量为29.55 L,出现在发酵的第15天,发酵罐最高压力达121.00 kPa,最高甲烷体积分数为38.22%,使用式(1)~式(3)联合计算得出甲烷产率为2.95 mL/g。
由图1还可知,产甲烷过程中的缓慢增长阶段,2号实验组较1号实验组持续时间短,且产甲烷体积分数和发酵罐压力显著增长时间点2号实验组较1号实验组提前很多。原因可能为:发酵初期,加入到No.1和No.2实验组发酵罐(190 L)内的驯化液与驯化装置(50 L)中的驯化液比较,两个发酵罐内单位体积发酵液中,菌群数量均有所下降,都需经过菌群生长阶段,在发酵初期不会立即产生理想中的产气高峰;生物气是产甲烷菌等厌氧菌以煤中有机质为能量来源而发生新陈代谢的产物,产甲烷总量曲线直接反映出培养装置中产甲烷菌的数量和活性特征[23]。2号实验组加入了营养液,提供了菌群生长所需要的碳源和氮源等物质,菌群较1号实验组的菌群生长较快,发酵产物甲烷体积分数的提升和发酵罐压力的升高时间均比1号实验组提前,且2号实验组发酵产甲烷总量提高了很多。王艳婷等[24]研究表明,维生素和微量元素对煤降解产气存在促进作用。董春娟等[25]在厌氧发酵系统中加入微量金属元素(Fe,Co,Ni,Mo和Se)能够改变甲烷菌的优势菌种,提高乙酸利用率且传代时间短,微量金属元素能对毒性物质产生强烈的拮抗作用,是提高厌氧消化过程效率及发酵稳定性的重要途径。这些研究均说明了2号实验组中加入营养液可对菌群产生激活促进作用,利于降解煤,产生甲烷气体。
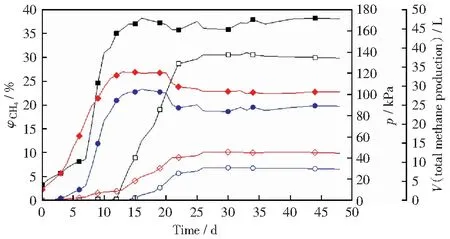
图1 1号和2号实验组的发酵罐压力和甲烷体积分数以及产甲烷总量Fig.1 Pressure of fermentation tank and volume fraction of methane and total methane production of No.1 and No.2 experimental group
2.1.2 本源菌降解内蒙古煤的产气特性
图2所示为3号和4号实验组的发酵罐压力和甲烷体积分数以及产甲烷总量。由图2可以看出,与上述1号和2号实验组的发酵体系相比,3号和4号实验组发酵体系同样经过了产气量缓慢增长、显著增高和趋于减缓三个阶段。3号实验组最高产甲烷总量为14.89 L,出现在发酵的第21天,发酵罐最高压力达70.56 kPa,最高甲烷体积分数为32.78%。4号实验组最高产甲烷量为36.10 L,出现在发酵的第14天,发酵罐最高压力达140.73 kPa,最高甲烷体积分数为40.02%,使用式(1)~式(3)联合计算得出甲烷产气率为3.61 mL/g。
3号和4号实验组在发酵罐压力、产甲烷体积分数、产甲烷总量最初产生时间、达到最高峰的时间,分别出现了与1号和2号相同的趋势。
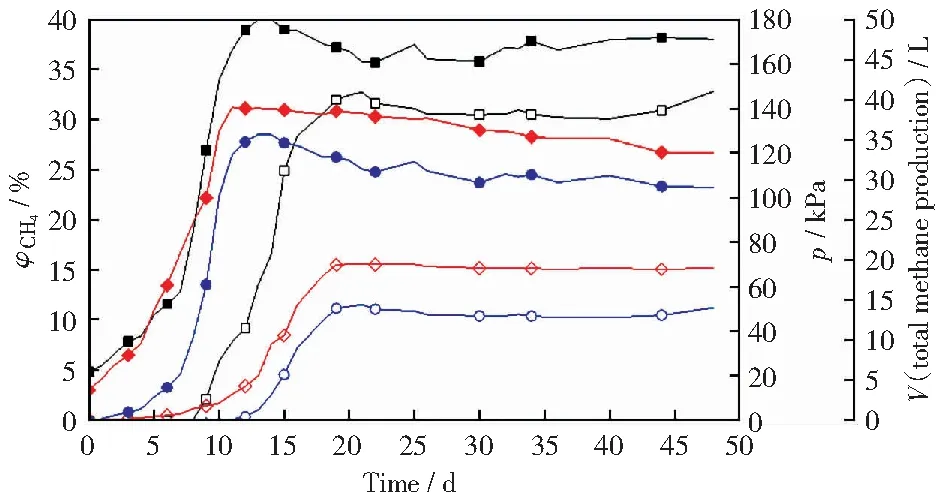
图2 3号和4号实验组的发酵罐体压力和甲烷体积分数以及产甲烷总量Fig.2 Pressure of fermentation tank and volume fraction of methane and total methane production of No.3 and No.4 experimental group
2.2 外源菌降解煤产气特性
图3所示为5号和6号实验组的发酵罐压力及产甲烷体积分数以及产甲烷总量。由图3可以看出,5号和6号实验组与上述甘肃地区本源菌发酵体系相比,同样经过了产气量缓慢增长、显著增高和趋于减缓三个阶段。5号罐最高产甲烷总量为41.29 L,出现在发酵的第13天,发酵罐最高压力达150.52 kPa,最高甲烷体积分数为42.62%。6号实验组的第一个产甲烷总量峰值为54.43 L,第二个产甲烷总量峰值为59.08 L,分别出现在发酵的第14天和第41天,发酵罐最高压力达183.58 kPa,最高甲烷体积分数为50.22%,使用式(1)~式(3)联合计算得出甲烷产率为5.91 mL/g。
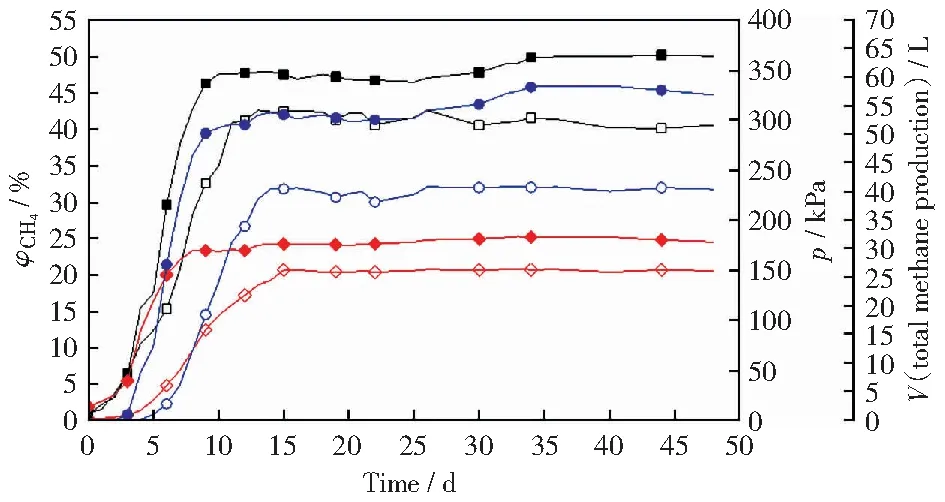
图3 5号和6号实验组的发酵罐压力和甲烷体积分数及产甲烷总量Fig.3 Pressure of fermentation tank and volume fraction of methane and total methane production No.3 and No.4 experimental group
5号实验组与1号和2号,6号实验组与3号和4号实验组的产甲烷趋势相比,产气速度快,经过驯化的外源产甲烷菌群对煤的降解效果比天然产甲烷菌群对煤的降解效果强且降解速度快[26],煤降解产生的中间产物能更快被发酵为产甲烷底物,最后被产甲烷菌利用产生甲烷。6号实验组外源菌出现了两次产甲烷峰值,根据产甲烷菌的产甲烷机理,生物成因煤层气分为氢气营养型(二氧化碳还原型)、乙酸营养型和甲基营养型[27]。在煤生物成气过程中,CO2体积分数的变化在一定程度上可以反映产甲烷的过程,因为CO2能在产甲烷菌作用下被氢还原生成甲烷[28-30]。图4所示为2号实验组和6号实验组的CO2和H2体积分数。由图4可以看出,在产甲烷前期,经驯化后的菌群可能在初期产生了大量的酸和二氧化碳,在氢分压很小的情况下,先利用乙酸发酵途径进行产甲烷作用。6号实验组所使用的外源菌与2号实验组所使用的本源菌相比,在煤降解发酵前中期产生了较多的CO2,在发酵后期,H2的存在使得CO2被还原为甲烷,因此出现氢气体积分数下降的现象,故而出现了第二次产甲烷峰值。
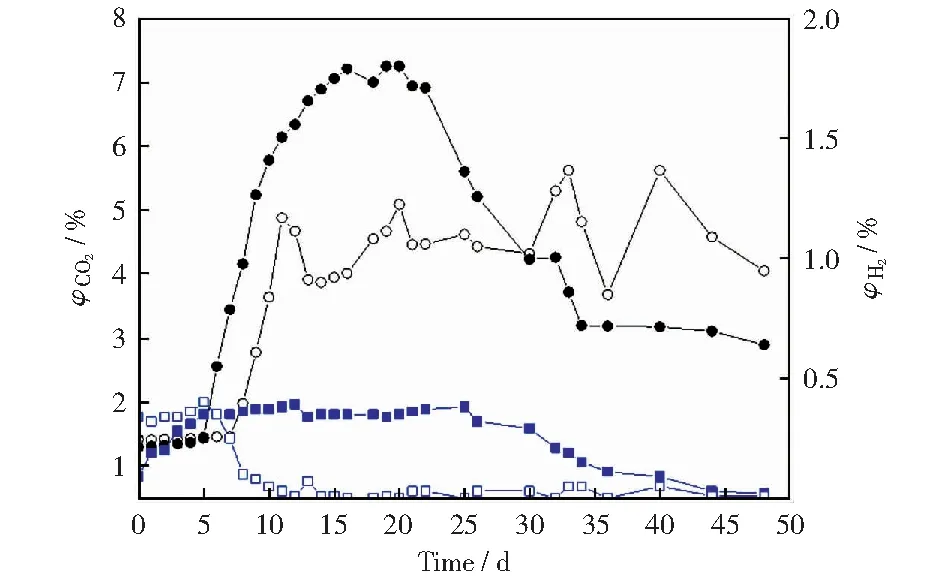
图4 2号和6号实验组的CO2及H2体积分数Fig.4 Volume fraction of CO2 and H2 of No.2 and No.6 experimental group
7号和8号实验组产甲烷总量分别为40.59 L和59.00 L,8号实验组的产甲烷率为5.90 mL/g,产气趋势基本与5号和6号实验组相同,此处不再列出。
2.3 本源菌和外源菌降解煤产甲烷总量
2.3.1 本源菌降解甘肃煤和内蒙古煤的产甲烷总量
图5所示为1号~8号实验组的产甲烷总量。由图5可以看出,1号~4号实验组,加入营养液的实验组均比未添加营养液实验组的产甲烷总量要高,且内蒙古煤的实验组产甲烷总量均比甘肃煤实验组产甲烷总量高。

图5 1号~8号实验组的产甲烷总量Fig.5 Total methane production of No.1-No.8 experimental group
产甲烷菌为严格厌氧菌,具有生长缓慢、可利用底物少、世代时间长等特点,由于产甲烷菌主导的产甲烷过程是煤向甲烷生物转化的关键步骤,这就要求产甲烷菌的生活环境中有适合的营养来源确保其生活和正常代谢[31]。首先营养液中的有机质可以被菌群作为碳源和能源利用,其次营养液中的微量元素可以激活产甲烷菌的活性,是有效的酶促反应激活剂[32]。图6所示为1号~4号实验组驯化液菌群显微观察照片。由图6可以看出,2号和4号实验组发酵罐内的产甲烷菌及其相关菌群在营养液的作用下大量、快速生长,菌群数量分别较1号和3号实验组的菌群数量高,造成了添加营养液的实验组均比未添加营养液的实验组产甲烷总量高的结果。
在实验前,对采取的水样进行了水质分析,其中甘肃地区的水质分析报告显示,硫酸盐含量高达1 404 mg/L,矿化度较高。文献[33]研究表明,硫酸盐还原菌和产甲烷菌竞争同一种电子供体,在硫酸盐缺乏或耗尽的生态系统中,硫酸盐的体积分数通常很低,主要是产甲烷菌在利用氢和乙酸盐上占优势;在富含硫酸盐的情况下,硫酸盐还原菌占优势,产甲烷菌受到抑制,因为硫酸盐还原菌对底物氢和乙酸盐的亲和力要大于产甲烷菌对底物氢和乙醇盐的亲和力。在此实验组发酵体系中,推测硫酸盐还原菌同产甲烷菌竞争氢、乙酸和乳酸等基质,菌群中的硫酸盐还原菌生长成为优势菌种,并对产甲烷菌产生了抑制作用,因此会产生内蒙古煤的实验组产甲烷总量均比甘肃煤实验组产甲烷总量要高的现象。

图6 1号~4号实验组驯化液菌群显微观察照片Fig.6 Microobservation photos of domestication liquid flora of No.1-No.4 experimental groupsa—No.1;b—No.2;c—No.3;d—No.4
2.3.2 外源菌降解甘肃煤和内蒙古煤的产甲烷总量
由图5还可以看出,活性污泥驯化后的外源菌对甘肃煤和内蒙古煤作用后产生的甲烷总量要比本源菌驯化后对本地区煤作用产生的甲烷总量多。罗永涛等[34]研究表明,本源菌群和外源菌群微生物主要由细菌和古菌构成,其中细菌占比较大而古菌只占整个菌群的很小一部分,产甲烷古菌是产甲烷生物链上的最后一个环节,煤中的大分子物质经过菌群作用分解为小分子物质后再被产甲烷菌属利用,最终生成甲烷。结合此实验产甲烷总量可以看出,实验组中外源菌产甲烷效率较本源菌产甲烷效率有明显的优势。
此实验中最高甲烷产率为6号实验组(活性污泥外源菌驯化液15 L+甘肃煤样10 kg+50 L营养液+50 L纯水)的5.91 mL/g,与赵娜等[35-36]在小型厌氧瓶中进行的煤粉生物产气实验的产甲烷率相比要低。发酵罐中煤用量增加,虽然理论上微生物能够更多地利用煤作为底物产生甲烷气体,但煤块较煤粉比表面积下降,块煤的裂隙体积仅占总体积很小一部分,使得块煤暴露在外的表面积减少,微生物与煤相互作用的接触面积减少,使得甲烷产量下降,但在同级别的发酵装置中,与陈林勇等[37]进行的外源菌千克级煤产气实验结果为0.17 mL/g相比要高。
5号和7号实验组与6号和8号实验组利用的是相同的活性污泥驯化菌群,在二者工业分析理化性质不相同的情况下,产生的甲烷总量基本相同,这说明煤炭生物降解产甲烷实验在190 L发酵罐放大后,并不能简单地说煤质对微生物降解煤产甲烷作用产生主导作用,更多应考虑的是发酵系统中菌群活性、数量、代谢产物的抑制作用、菌群中各种菌间的相互作用以及煤样预处理对煤中可被菌群利用有机质的释放。
3 结 论
1) 经驯化后的甘肃地区和内蒙古地区本源菌,在190 L中型发酵罐中对本地区的煤进行生物降解产甲烷实验,加入营养液后的产甲烷率分别为2.95 mL/g和3.61 mL/g。活性污泥中的外源菌经驯化后对甘肃地区煤和内蒙古地区煤生物降解产甲烷效果较本源菌更佳,产甲烷率分别可达5.91 mL/g和5.90 mL/g。
2) 驯化后的活性污泥外源菌较本源菌,在降解煤产甲烷的过程中,存在产气速率高、产甲烷总量高的现象,且外源菌在煤生物降解产甲烷后期,利用CO2还原产甲烷途径较为明显。
3) 驯化后的甘肃地区本源菌对本地区煤生物降解产甲烷能力较差,原因可能为本源菌液中硫酸盐含量较高,硫酸盐还原菌生长成为优势菌种,并对产甲烷菌产生了抑制作用,不利于煤中有机质被利用产生甲烷。