蓝舌病病毒NS3蛋白抑制细胞Ⅰ型干扰素的产生
2022-07-14信爱国云南省畜牧兽医科学院云南省热带亚热带动物病毒病重点实验室云南昆明650224
朱 沛,肖 雷,吴 梅,李 珂,信爱国 (云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室,云南 昆明 650224)
蓝舌病(bluetongue,BT)是由蓝舌病病毒(BTV)引起的能感染多种家养及野生反刍动物的非接触性虫媒病毒传染病,发病动物主要表现为发热、口唇充血肿胀及糜烂、鼻腔及胃肠黏膜严重卡他性炎症[1-3],伴随舌头发绀,动物感染蓝舌病的平均病死率为30%,绵羊高达80%。由于蓝舌病对世界经济的影响,世界动物卫生组织(OIE)将蓝舌病列为A类疫病,中国将其列为一类动物疫病。
BTV为呼肠孤病毒科(Reovirid)环状病毒属(Orbivirus)成员,基因组由10个节段的双链RNA(dsRNA)组成[4-5],可编码7种结构蛋白(VP1~VP7)和5种非结构蛋白(NS1~NS3、NS3a、NS-4)[6-8],其中S10基因编码BTV非结构蛋白NS3。
BTV在体内和体外试验感染多种宿主(绵羊、黄牛、小鼠和人类)或不同组织后都能诱导强的Ⅰ型IFN(IFN-Ⅰ)反应[9]。有研究表明BTV诱导IFN-Ⅰ产生的信号通路中,病毒入侵宿主细胞后,分别被RIG-Ⅰ(视黄酸诱导基蛋白Ⅰ)和MDA5(黑色素瘤分化相关基因5)识别,随后MAVS激活下游TRAF3、TBK1和IKK-i对IRF3/IRF7进行磷酸化活化修饰,活化的IRF3/IRF7转移至细胞核,启动IFN-Ⅰ的产生[10-12]。但目前,BTV复制与诱导细胞产生IFN-Ⅰ的关系尚不清楚,BTV不同毒株和不同血清型对诱导IFN-Ⅰ反应的影响也未明确。
干扰素(interferon,IFN)是在特定的诱生剂刺激下由细胞产生的一类具有高度生物活性的糖蛋白,是能干扰病毒复制的细胞因子。根据IFN蛋白的氨基酸序列、细胞来源以及它们所结合受体的不同,分为IFN-Ⅰ和Ⅱ,IFN-β是IFN-Ⅰ的亚型,主要由成纤维细胞产生。有研究表明BTV非结构蛋白NS3对IFN-β的生成有强烈抑制作用,但BTV NS3蛋白如何影响IFN-β合成、BTV NS3蛋白在IFN-β产生的信号通路中有何作用、在拮抗宿主先天性免疫反应中发挥何种作用尚未明确。
本研究选用BTV-1和BTV-16感染人非小细胞肺癌细胞(A549)和犊牛原代肾细胞(MDBK)探索不同血清型、不同病毒载量、不同作用时间的BTV对细胞IFN-Ⅰ产生的影响,以明确BTV不同毒株和不同血清型对诱导IFN-Ⅰ产生的影响;通过构建BTV NS3真核表达质粒,用qPCR、双荧光素酶报告基因和ELISA方法探索在细胞中过表达BTV NS3蛋白对IFN-Ⅰ转录及表达水平的调控和影响,验证NS3对IFN-β的抑制作用。其结果有助于了解BTV的致病机理和对宿主天然免疫的拮抗机制,同时揭示了BTV NS3蛋白在抑制IFN-Ⅰ产生中的作用,对BTV疫苗研发及抗病毒治疗具有科学意义。
1 材料与方法
1.1 细胞与病毒BTV-1、BTV-16标准病毒株由动物卫生组织(OIE)参考实验室Onderstepoort Veterinary Institute(South Africa)馈赠;BHK-21细胞、牛肾传代细胞(MDBK)和人非小细胞肺癌细胞(A549)由云南省畜牧兽医科学院热带亚热带动物病毒病重点实验室保存提供。
1.2 主要试剂MagMAXTM-96 Viral Isolation Kit购自ABI公司;MEM培养基、胎牛血清购自GIBCO公司;Real Time qRT-PCR试剂盒、One Step TB Green®PrimeScriptTMPLUS RT-PCR Kit、DNA胶回收试剂盒、E.coliDH5α感受态细胞、T4DNA连接酶购自大连宝生物公司;pEGFP-N2载体购自Clotech公司;Peasy-Blunt Cloning Vector载体、T-ransIntroTMEL购自北京全式金生物技术有限公司;限制性内切酶NheⅠ、BamⅠ购自Thermo Fisher公司;Bovine&Human IFN-β ELISA Kit购自USA TSZ biological Trade Co.Ltd.;Dual-Luciferase Reporter Assay System购自Promega公司。
1.3 引物根据GenBank中登录的人和牛IFN-β序列设计特异性引物,以β-actin作为内参,根据GenBank中公布的BTV毒株序列设计BTV NS3(Seg-10)引物序列,引物设计使用Oligo 7.0和Primer 5.0软件进行,引物由上海捷瑞生物公司合成,纯度为HPLC级,用DEPC水稀释至终浓度为10 μmol/L。引物序列见表1。
1.4 BTV-1和BTV-16的培养与TCID50测定取500 μL BTV-1和BTV-16毒株病毒液接种于长成70%~80%单层的BHK-21细胞瓶(25 cm2)中,置于37℃、5%CO2培养箱中吸附1 h,取出倒掉细胞瓶中液体,加入10 mL MEM维持液,每日观察细胞病变情况,当细胞病变效应(CPE)达到“+++”(75%)时收获病毒,3 500 r/min离心15 min,取上清液,细胞沉淀冻存于-80℃冰箱保存备用。离心后的病毒上清液用1×MEM培养液将病毒按10倍倍比稀释,取长满单层BHK-21细胞的96孔板,弃去培养液,将稀释好的病毒液接种于96孔细胞培养板,从第1列开始加入,每个稀释度重复8个孔,每孔加入100 μL稀释好的病毒稀释液,空白对照加100 μL 1×MEM培养液,37℃吸附1 h后,每孔加入100 μL细胞维持液,37℃、5%CO2培养,逐日观察,7 d后终判,用Karber方法计算病毒效价(TC-ID50)。
1.5 BTV-1和BTV-16诱导细胞产生IFN-β为探索BTV不同血清型、不同病毒载量及不同感染时间对上皮细胞产生IFN-β的影响。本研究选用BTV-1和BTV-16作用于A549和MDBK,设置不同的病毒感染组(MOI分别为1.00,0.10和0.01组)。将上述细胞铺于6孔细胞培养板中,待细胞长至80%时计数,接种病毒后,37℃、5%CO2培养。试验设置 BTV-1感染组、BTV-16感染组以及正常细胞对照组,每组设0,12,24,36,48,72,96 h共7个感染时间点,每组重复4个复孔。细胞培养上清用BTV Seg-10群特异性引物进行qRT-PCR扩增以检测不同时间点BTV RNA,验证不同MOI的BTV-1及BTV-16在A549和MDBK细胞上的增殖规律;同时用Human IFN-β ELISA Kit 和Bovine IFN-β ELISA Kit检测试剂盒测定当MOI=0.10时,BTV-1和BTV-16感染后不同时间点诱导细胞产生IFN-β的量。方法如下:分别在BTV-1和BTV-16感染细胞后的0,12,24,36,48,72,96 h 收集病毒培养液,3 500 r/min离心20 min收集上清液,在酶标包被板的孔中加入40 μL样品稀释液,然后加入待检样品10 μL,按照ELISA Kit试剂盒使用说明操作,在波长450 nm处测定各孔的D值。
1.6 BTV NS3真核表达质粒构建与鉴定提取BTV-1的总mRNA,反转录成cDNA,反转录程序如下:30℃ 10 min,42℃ 60 min,70℃ 10 min。以合成的cDNA为模板、以BTV NS3 NheⅠ-BamⅠ为引物,扩增BTV-1的NS3片段。扩增程序:98℃ 2 min;98℃ 10 s,56℃ 10 s,72℃ 10 s,30个循环;72℃延伸5 min。PCR产物用1.0%的琼脂糖凝胶检测,目的片段进行胶回收纯化后连接于Peasy-Blunt Cloning Vector载体,将连接产物转化E.coliDH5α感受态细胞,对正确克隆的NS3基因和荧光质粒PEGFP-N2分别用限制性内切酶NheⅠ、BamⅠ进行双酶切,37℃反应15 min,酶切产物通过1%凝胶电泳检测。将符合预期大小的NS3基因与荧光质粒PEGFP-N2用T4连接酶连接,连接产物转化E.coliDH5α感受态细胞,在涂有Kan+的LB平板上过夜培养,挑取单个菌落进行菌落PCR鉴定。将阳性的菌落扩大培养后,提取质粒进行测序。
1.7 qPCR方法检测过表达NS3后NS3和IFN-β mRNA的表达情况按照TransIntroTMEL转染试剂盒说明书转染800 ng NS3重组质粒,分别在转染后0,24,48,72 h这4个时间点收集A549和MDBK细胞培养液,细胞培养液在-20℃与4℃下反复冻融3次,使细胞完全裂解后,3 500 r/min离心15 min,离心后的上清液用qPCR方法检测不同转染时间A549和MDBK中NS3和IFN-β的mRNA,其中NS3 mRNA的检测用BTV Seg-10群特异性引物进行qRT-PCR扩增,反应条件:42℃ 5 min;95℃ 10 s;(94℃ 10 s,60℃ 30 s)×45个循环。A549和MDBK中IFN-β mRNA分别用人和牛的IFN-β特异性引物进行qRT-PCR扩增,以β-actin 作为内参,反应条件:42℃ 5 min;95℃ 10 s;(94℃ 5 s,60℃ 34 s)×45个循环。Add Dissociation Protocol:95℃ 15 s;60℃ 1 min;95℃ 15 s。
1.8 双荧光素酶报告基因检测IFN-β启动子表达分别构建含待检测基因IFN-β启动子的重组质粒,其中含有人源IFN-β启动子的报告质粒命名为H-IFN-β-Luc,含有牛源IFN-β启动子的报告质粒命名为C-IFN-β-Luc;分别用不同剂量的PEGFP-N2-NS3重组质粒和H-IFN-β-Luc报告质粒共转染A549细胞,转染 24 h后感染BTV-1,16 h后收取样品进行双荧光素酶检测,同时设置对照组,分别用不同剂量的PEGFP-N2空质粒和H-IFN-β-Luc报告质粒共转染A549细胞,转染 24 h后感染BTV-1,16 h后收取样品测定荧光素酶活性。具体方法如下:将A549细胞接种于24孔板,待细胞密度为60%~70%时,将不同剂量的 PEGFP-N2-NS3重组质粒转入A549细胞,同时转染100 ng H-IFN-β-Luc,每个试验设3个平行孔。转染24 h后,加入BTV-1,16 h后去除培养基,用1×PBS清洗培养细胞后,每孔加入100 μL 1×PLB,在室温下轻轻晃动培养板15 min以裂解细胞。向1支干净的EP管中加入100 μL LARⅡ,加入20 μL上一步中经PLB裂解的细胞液,用枪头吹打2~3次(切勿涡旋混匀),检测萤火虫荧光素酶的活性;在10 s内读取完萤火虫荧光素酶发光数值后,加入100 μL Stop&Glo试剂,检测海肾荧光素酶的活性;读取完海肾荧光素酶发光数值后,计算相对荧光素酶活性(以诱导倍数表示)=[每个样品的萤火虫荧光素酶荧光强度(FL-Luc)/海肾荧光素酶荧光强度(RL-Luc)]/(对照FL-Luc/RL-Luc),同理分别用不同剂量的PEGFP-N2-NS3重组质粒和C-IFN-β-Luc共转染MDBK细胞,操作方法及结果判定同上。
2 结果
2.1 BTV-1和BTV-16的培养与TCID50测定将BTV-1和BTV-16毒株病毒液分别接种于单层的BHK-21,盲传到第3代时,细胞出现明显CPE,主要表现为细胞皱缩、崩解、脱落,根据1.4中方法测定病毒效价,用Karber方法计算TCID50,其中BTV-1毒株的TCID50为10-5.25/0.1 mL,BTV-16毒株的TCID50为10-6.17/0.1 mL。
2.2 BTV-1和BTV-16能诱导A549和MDBK产生IFN-β按照1.5中的方法,分别检测MOI为1.00,0.10和0.01的BTV-1和BTV-16感染A549和MDBK细胞后0,12,24,36,48,72,96 h培养液中BTV RNA的含量,同时用ELISA方法检测MOI=0.10时,BTV-1和BTV-16诱导A549和MDBK细胞产生IFN-β的情况。结果表明:BTV-1和BTV-16都能感染A549和MDBK细胞并在其中增殖;且BTV RNA的量与MOI呈正相关,接种后的0~72 h BTV RNA不断增长,到72 h抵达峰值,72~96 h又不断下降;研究还发现相同血清型的BTV在MDBK中的增长量要高于A549,说明MDBK可能比A549更适合BTV-1和BTV-16增殖;ELISA结果显示MOI=0.10的BTV-1和BTV-16都能诱导A549和MDBK细胞产生IFN-β,感染A549时,IFN-β从感染后24 h开始被检测到,96 h抵达峰值,同等条件下感染MDBK,IFN-β从感染后12 h开始被检测到,72 h抵达峰值,72~96 h IFN-β逐渐降低,且相同血清型的BTV感染MDBK诱导产生的IFN-β高于A549(图1~3)。

图1 不同MOI的BTV-1(A)和BTV-16(B)在A549和MDBK细胞中的增殖情况
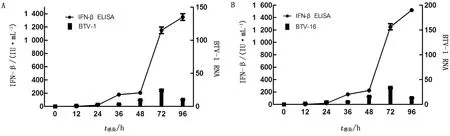
图2 MOI=0.10时BTV-1(A)和BTV-16(B)诱导A549产生IFN-β的量
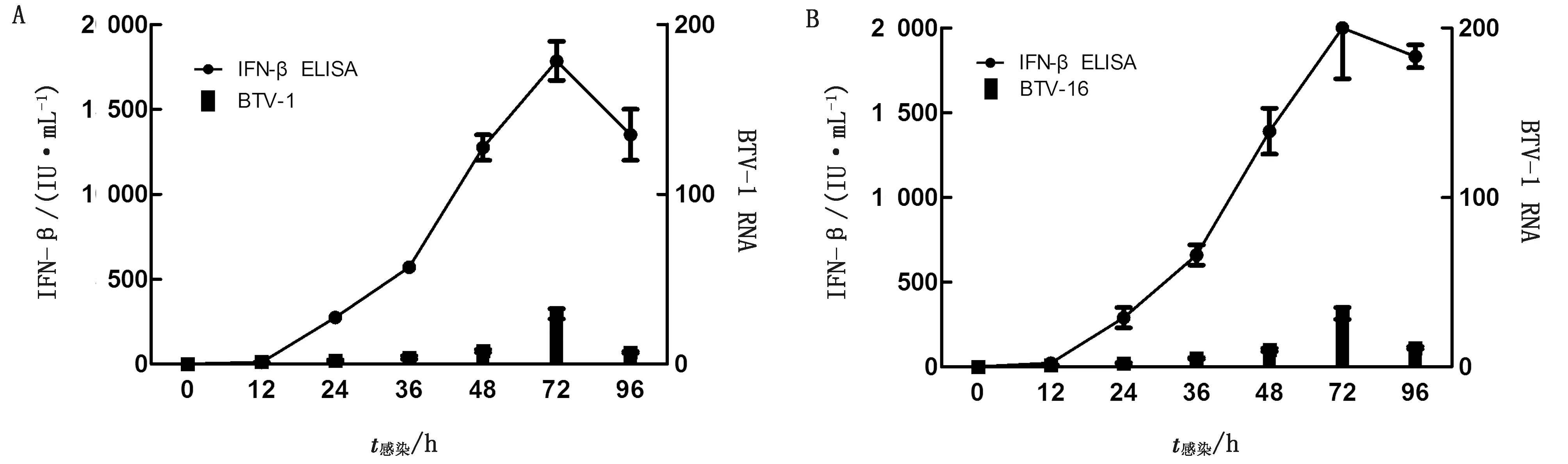
图3 MOI=0.10时BTV-1(A)和BTV-16(B)诱导MDBK产生IFN-β的量
2.3 BTV NS3真核表达质粒构建与鉴定按照1.6中的方法克隆BTV NS3基因,然后与荧光质粒PEGFP-N2分别酶切后连接,连接产物转化感受态细胞,在Kan+的LB平板上过夜,挑取单个菌落进行菌落PCR鉴定,阳性的菌落扩大培养后提取质粒进行测序,将测序结果正确的重组质粒命名为PEGFP-N2-NS3(图4)。

A.BTV-1 NS3片段RT-PCR(M.DL2000 DNA Marker;1.BTV-1 NS3;2.PC);B.PEGFP-N2-NS3菌落PCR (M.DL2000 DNA Marker;1.NC;2~4.PEGFP-N2-NS3菌落PCR 结果)图4 NS3基因克隆及NS3真核表达质粒鉴定
2.4 qPCR方法检测过表达NS3后NS3和IFN-β mRNA的表达情况按照TransIntroTMEL转染试剂盒说明书转染重组质粒PEGFP-N2-NS3,分别在转染后0,24,48,72 h这4个时间点收集细胞培养液,qPCR方法检测上清液中NS3和IFN-β mRNA情况,结果表明:在A549和MDBK细胞中成功转染NS3,并且NS3 mRNA在0~72 h不断增加,同时对细胞产生IFN-β mRNA有一定的诱导作用,但作用甚微,特别是A549中的IFN-β mRNA几乎没有增长(图5)。
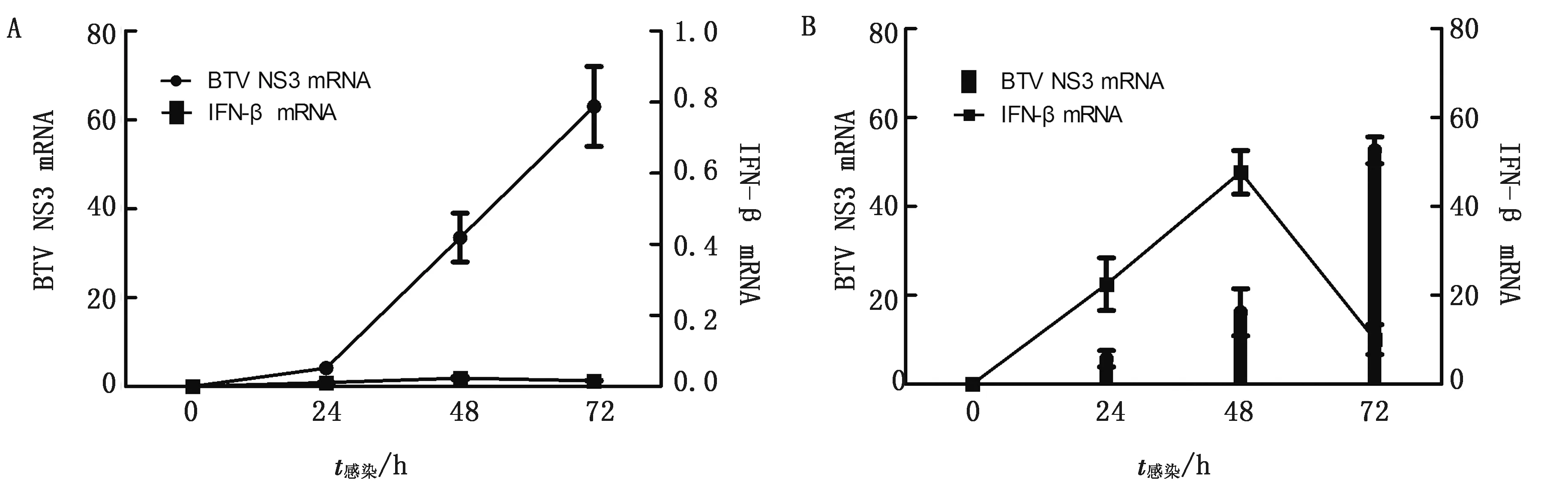
A.A549过表达NS3后NS3 mRNA和IFN-β mRNA的量;B.MDBK过表达NS3后NS3 mRNA和IFN-β mRNA的量图5 过表达NS3后细胞中的NS3 mRNA和IFN-β mRNA表达水平
2.5 双荧光素酶报告基因检测PEGFP-N2-NS3转染细胞后IFN-β启动子表达按照1.8中的方法,分别用H-IFN-β-Luc和C-IFN-β-Luc与用不同剂量的PEGFP-N2-NS3共转染A549及MDBK细胞,同时设置对照组,用不同剂量的PEGFP-N2空质粒和H-IFN-β-Luc和C-IFN-β-Luc共转染,转染24 h后感染BTV-1,16 h后收取样品进行双荧光素酶检测,根据Dual-Luciferase Reporter Assay System操作说明测定荧光素酶活性。结果表明:BTV 非结构蛋白NS3能够抑制BTV诱导的IFN-β启动子活性,且表达量越高,抑制作用越强,而PEGFP-N2本身对BTV诱导的IFN-β启动子活性没有抑制作用(图6)。
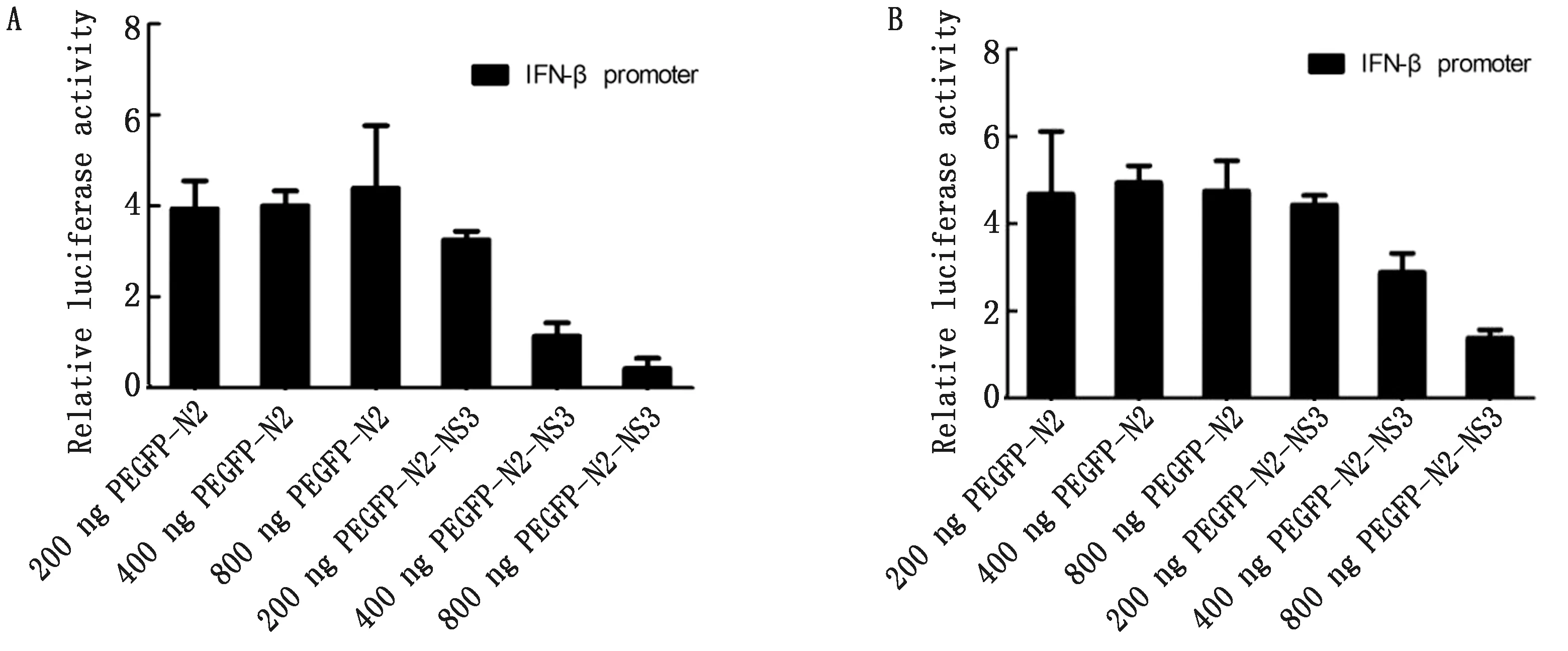
A.A549 IFN-β启动子相对荧光素酶活性;B.MDBK IFN-β启动子相对荧光素酶活性图6 细胞IFN-β启动子相对荧光素酶活性测定结果
3 讨论
BTV目前全球发现的血清型共27个(BTV-1~27),我国于1979年首次在云南发现绵羊蓝舌病[13],随后在29个省检出BTV血清阳性的家畜,全国范围已鉴定出7个血清型的BTV(BTV-1、-2、-3、-4、-12、-15、-16),其中BTV-1和BTV-16为我国的优势血清型[14-15],因此本研究选用BTV-1和BTV-16感染犊牛原代肾细胞(MDBK)和人非小细胞肺癌细胞(A549),它们分别代表了BTV宿主上皮细胞和哺乳动物上皮细胞。本研究通过qPCR方法检测BTV感染细胞后0~96 h病毒RNA的变化,验证了BTV-1和BTV-16均能在MDBK和A549上增殖,且BTV RNA的量与病毒MOI呈正相关,接种72 h后BTV RNA抵达峰值;而CHAUVEAU等[16]研究中发现用不同MOI(MOI分别为0.01,0.05,0.10组)的BTV-8接种A549,48 h后病毒RNA就抵达峰值,可能是由于BTV血清型以及细胞来源的不同导致的。研究还发现相同血清型的BTV在MDBK中的增长量要高于A549,说明MDBK比A549更适合BTV-1和BTV-16的增殖。
本研究选用MOI=0.10的BTV-1和BTV-16感染细胞,用ELISA方法检测感染后0~96 h细胞产生IFN-β的量,验证了BTV-1和BTV-16均能诱导MDBK和A549产生IFN-Ⅰ;选择病毒复数MOI=0.10是因为低病毒量诱导产生的IFN-β量过低,而高病毒量则影响细胞状态导致试验组间不平行。研究结果显示当BTV-1和BTV-16感染A549时,IFN-β从感染后24 h开始被检测到,96 h抵达峰值;当感染MDBK时,IFN-β从感染后12 h开始被检测到,72 h抵达峰值,72~96 h IFN-β逐渐降低,而且相同血清型的BTV感染MDBK诱导产生的IFN-β高于A549。可能的原因是MDBK来源于BTV的宿主牛,当感染相同血清型相同病毒量的BTV时,MDBK产生的IFN-Ⅰ效应要强于其他来源的上皮细胞,且RIG-I 基因是Ⅰ型 IFN诱导型基因,有研究表明RIG-I基因的启动子在正常细胞中较在恶变细胞中更活跃,且RIG-I mRNA表达水平在正常细胞中较在癌细胞中更高[17]。A549细胞是人非小细胞肺癌细胞,所以BTV诱导A549产生的IFN-Ⅰ效应要晚于MDBK,IFN-β分泌量也要低于MDBK。
RIG-I样受体识别病毒复制产生的双链RNA和5′三磷酸基团的单链RNA后,通过激活IFN-Ⅰ来引发抗病毒免疫反应,在机体抵抗病毒感染的过程中发挥重要作用。有研究表明BTV的非结构蛋白NS3对IFN-β的生成有强烈抑制作用,它通过抑制RLR信号通路干扰机体免疫反应,从而导致干扰素表达量下降。CHAUVEAU等[16]研究发现在BTV-8型感染293T细胞的试验中,BTV非结构蛋白NS3能够抑制IFN-β启动子活性,这种抑制作用是通过NS3蛋白降低与RIG-I结合而下调IFN-β mRNA转录水平,在基因水平上影响IFN-β转录,从而达到干扰IFN-β合成的效果[16,18]。本研究成功构建BTV NS3的真核表达质粒PEGFP-N2-NS3,在转染A549和MDBK细胞后的24 h,用双荧光素酶报告基因测定IFN-β启动子的表达情况,结果显示在细胞中过表达NS3蛋白对IFN-β启动子有明显下调作用,但qPCR检测结果显示在A549中过表达NS3后,IFN-β mRNA从24 h开始被检测到,24~48 h逐渐升高,48~72 h逐渐降低,在MDBK中也同样,这与双荧光素酶报告基因测定结果相悖;这说明了BTV NS3蛋白对IFN-β的抑制作用必须在BTV刺激时才能协同发挥,过表达BTV NS3蛋白能够抑制BTV诱导的IFN-β启动子活性,而且表达量越高,抑制作用越强,而仅过表达NS3蛋白反而能刺激细胞合成IFN-β mRNA,说明NS3蛋白只对BTV诱导的IFN-β有抑制作用,而NS3蛋白本身作为外源蛋白能刺激细胞产生IFN-β。
CHAUVEAU等[16]研究表明BTV NS3 蛋白作用于维甲酸诱导基因-线粒体抗病毒信号传送蛋白通路(RIG-I-MAVS pathway),进而抑制IFN-Ⅰ的合成[16],达到拮抗IFN-Ⅰ的抗病毒功能[19]。但本研究发现仅过表达NS3蛋白反而能刺激细胞合成IFN-β mRNA;有研究发现BTV-8通过降解JAK1和Tyk2以及降低 STAT1磷酸化和核转移水平来实现对IFN-Ⅰ抗病毒作用的抑制,但单一的BTV-8并不能独立完成此过程[20],说明BTV拮抗干扰素的抗病毒过程是复杂的,相关信号传导通路还有待进一步的研究。
综上,BTV-1和BTV-16能感染A549和MDBK并诱发强烈的IFN-β效应,BTV NS3能诱导细胞合成IFN-β mRNA,同时对BTV诱导的IFN-β启动子活性具有抑制作用,且表达量与抑制作用呈正相关。本研究揭示了BTV增殖与细胞产生IFN-Ⅰ的关系,阐明了BTV NS3蛋白对IFN-β转录和表达水平的影响,其结果有助于了解BTV的致病机理及其干扰宿主的天然免疫应答机制,对BTV疫苗研发及抗病毒治疗具有科学意义。
