麸皮红曲发酵工艺研究
2022-07-13马美荣张坤李洪媛李博艺周林艳王小伟
马美荣,张坤,李洪媛,李博艺,周林艳,王小伟
(北京红星股份有限公司,北京 101400)
红曲霉是腐生真菌,属真菌门、子囊菌纲、真子囊菌亚纲、曲霉目、曲霉科、红曲霉属[1]。红曲霉在麦芽汁琼脂培养基上生长良好,菌落起初为白色,老熟后变成淡粉色、紫色或灰黑色,多形成红色[2]。由其制作的红曲可用于酿酒[3-4]、制醋[5-6]、作豆腐乳的着色剂和调味剂[7-8]。在酶制剂工业中也可用其生产糖化酶制剂[9-10]。近年来,随着国内外学者对红曲的深入研究,发现红曲中有洛伐他汀类化合物、γ-氨基丁酸、麦角固醇、亚油酸、异黄酮、葡萄糖胺等有益的代谢产物,这些活性物质具有降脂、抗炎、抗氧化、抗肿瘤、抗糖尿病、抗抑郁、预防骨质疏松等多种功效[11-13]。
麸皮为小麦最外层的表皮,小麦加工面粉后剩下的皮称为麸皮。麸皮含有可提供曲霉生长的一切维生素、微量矿质元素及其他生长因子,是制作黑曲霉、根霉、毛霉、梨头霉、拟内孢霉、固体酵母的主要原料[14]。近年来,一些研究者进行了利用麸皮生产红曲的研究。张立强等采用麸皮培养红曲,以酯化力为标准确定麸皮红曲的最佳制作条件,并将麸皮红曲应用于黄水的酯化以提高己酸乙酯和乳酸乙酯的含量[15]。庄桂采用黑曲霉将麸皮糖化后,进而利用糖化麸皮代替糯米进行红曲培养以制备红曲色素,提高了麸皮的附加值[16]。程伟等采用大米、麸皮混合料制备的酯化红曲明显优于大米或麸皮等单独作为原料制备的酯化红曲[17]。
北京红星股份有限公司的红曲生产是以小米或大米为原料,生产成本较高。因为麸皮比小米或大米便宜,以麸皮代替小米或大米来培养红曲,应该可以降低生产成本。由于QB/T 5188-2017《酿造红曲》是以糖化力作为红曲的评价指标[18],且红星公司生产的红曲主要是利用其糖化性能和产香性能参与酿酒发酵,因此在研究中以糖化力指标作为麸皮红曲质量的评价标准。本研究通过影响麸皮红曲糖化力的单因素试验研究及正交试验研究,确定合适的发酵工艺条件;分析麸皮红曲与大米红曲的风味物质含量并进行比较;对两种红曲的成本进行分析,评价麸皮红曲生产的经济可行性。
1 材料与方法
1.1 材料
红糖、大米、玉米面:市售;麸皮、酒糟、酒尾:北京红星股份有限公司酿造车间;红曲霉:北京红星股份有限公司。
1.2 主要试剂
乙醇:分析纯,北京化工厂;乙酸、无水乙酸钠:均为分析纯,天津市大茂化学试剂厂。
1.3 主要仪器与设备
HY-60S恒温摇床 武汉汇诚科技有限公司;HPS-250生化培养箱 哈尔滨市东联电子技术开发有限公司;HH.S21-Ni6水浴锅 北京长安永利科学仪器有限公司;GTR16-2离心机 北京时代北利离心机有限公司;GC-2010 plus气相色谱仪 日本岛津公司。
1.4 方法
1.4.1 酒糟水的制备
取100 g酒糟置于1 L水中,加热至沸,保持10 min,过滤,滤液加水补足至1 L。
1.4.2 红糖酒糟水培养基的制备
上述制备的酒糟水1 L,加入50 g红糖,溶解,灭菌备用。
1.4.3 红曲霉液体种子培养
将红曲霉斜面接种于红糖酒糟水培养基中,30 ℃、120 r/min摇床培养2 d。
1.4.4 麸皮红曲培养
每500 mL三角瓶中加入30 g麸皮,并加入30 mL水,拌匀,121 ℃高压灭菌30 min。降温冷却至30 ℃左右时,以20%的接种量接入培养好的红曲霉种子,在30 ℃培养,培养成熟后得到麸皮红曲。
1.4.5 大米红曲培养
大米室温下浸泡4~6 h,在500 mL三角瓶内装入50 g浸泡后的大米,121 ℃灭菌30 min。冷却后接入10%的液体种子,30 ℃培养8 d。
1.4.6 红曲糖化力测定
称取5 g红曲样品,加入90 mL水和10 mL醋酸-醋酸钠缓冲溶液,搅匀。35 ℃水浴1 h,用脱脂棉过滤,弃去最初5 mL,接收其余澄清滤液进行淀粉酶解糖测定,测定方法参照斐林定糖法[19]。

式中:V0表示加空白溶液后消耗标准葡萄糖溶液的体积(mL);V表示加麸曲糖化液后消耗标准葡萄糖溶液的体积(mL);C表示标准葡萄糖溶液的浓度(g/mL)。
1.4.7 不同培养条件对麸皮红曲糖化力的影响
以1.4.4为基础,进行不同培养基、初始加水量、培养温度及发酵时间等参数试验,探究其对红曲糖化力的影响。
1.4.7.1 不同培养基的影响
麸皮培养基:麸皮∶水为100∶100;麸皮酒尾培养基:麸皮∶水∶酒尾为100∶100∶20;麸皮玉米面培养基:麸皮∶水∶玉米面为80∶100∶20。其他条件为培养温度30 ℃、培养时间7 d。
以选择的培养基进行1.4.7.2~1.4.7.6及1.4.8试验。
1.4.7.2 不同装料量的影响
在500 mL三角瓶中分别装入10,30,50 g麸皮,其他条件为料水比1∶1、培养温度 30 ℃、培养时间7 d。
1.4.7.3 不同培养时间的影响
在500 mL三角瓶中分别装入30 g麸皮,料水比为1∶1,培养温度为30 ℃,分别在培养时间6,7,8,9 d取样分析。
1.4.7.4 不同初始加水量的影响
在500 mL三角瓶中分别装入30 g麸皮,料水比分别为0.8∶1、1∶1、1.2∶1、1.4∶1,培养温度为 30 ℃,培养时间为7 d。
1.4.7.5 不同接种量的影响
在500 mL三角瓶中分别装入30 g麸皮,接种量分别为10%、15%、20%、25%、30%,其他条件为料水比1∶1、培养温度30 ℃、培养时间7 d。
1.4.7.6 不同培养温度的影响
在500 mL三角瓶中分别装入30 g麸皮,料水比为1∶1,分别在25,30,35,40 ℃培养,培养时间7 d。
1.4.8 正交试验设计
通过单因素试验对红曲糖化力影响较大的装料量、初始料水比、接种量、温度进行三水平正交试验设计,优化红曲培养条件[20-21]。
1.4.9 红曲风味物质分析
以干重计称取5 g红曲,置于250 mL磨口三角瓶中,加入100 mL 70%乙醇室温下浸泡2 d,提取液置于50 mL离心管中,3000 r/min,10 min,取上清液进行风味物质分析。
风味物质的测定:采用气相色谱法检测风味物质的含量。色谱条件参照杨强等[22]的方法并略作修改:LZP-930石英毛细管色谱柱(50 m×0.32 mm×1.00 μm);氢火焰离子化检测器(flame ionization detector,FID),检测器温度230 ℃;进样口温度250 ℃;升温程序:50 ℃保持3 min,以6 ℃/min升至130 ℃,再以20 ℃/min升至180 ℃,保持1 min;载气为氮气(N2);吹扫流量为3 mL/min;分流比为1∶30。根据保留时间定性[23],采用内标法定量,内标物为乙酸正戊酯(质量浓度0.117 g/L)。
1.5 数据处理
采用Excel分析软件进行数据处理及作图分析。
2 结果与讨论
2.1 不同培养条件对麸皮红曲糖化力的影响
2.1.1 不同培养基对糖化力的影响
培养基是微生物生长、代谢目的产物的物质基础。不同的培养基组成会极大影响代谢产物的合成。从几种培养基的培养来看,不同培养基的生长速度差别较大,麸皮玉米面培养基生长最快,麸皮酒尾培养基生长最慢。这可能是因为培养基加玉米面后营养更丰富,有利于红曲霉生长,而酒尾中含有乙醇、有机酸等物质,培养初期可能会对红曲霉的生长有一定的抑制作用。

图1 不同培养基对糖化力的影响Fig.1 Effect of different media on saccharifying power
由图1可知,几种培养基中,采用麸皮酒尾培养基的糖化力最高,后续试验采用麸皮酒尾培养基进行工艺优化培养试验。
2.1.2 不同发酵时间对糖化力的影响
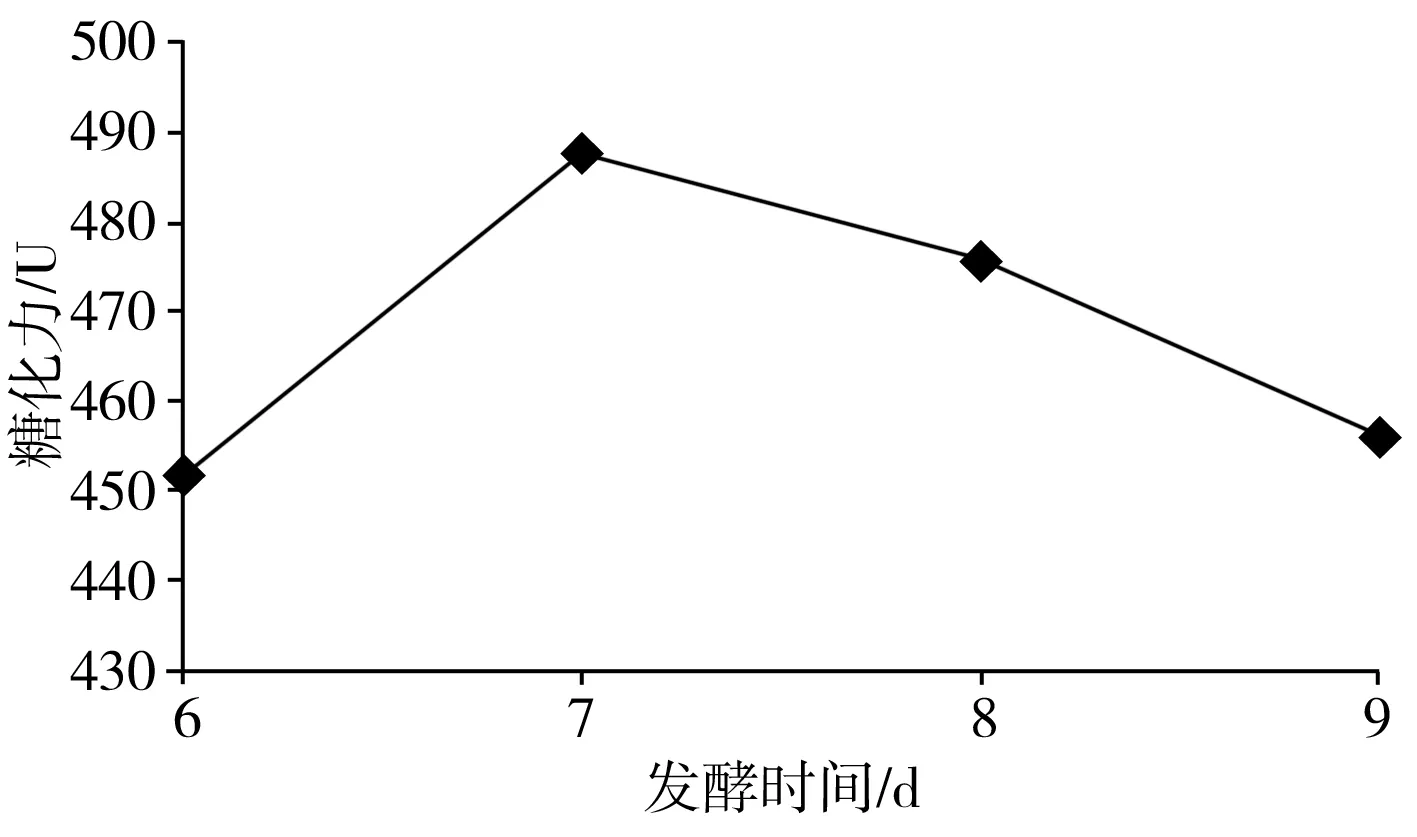
图2 不同发酵时间对糖化力的影响Fig.2 Effect of different fermentation time on saccharifying power
发酵时间短,发酵不完全,发酵时间过长,发酵指标不一定增加较多,甚至可能降低,从发酵指标、设备利用率等方面考虑,确定合理的发酵时间非常必要。由图2可知,麸皮红曲的糖化力随着发酵时间的延长出现先上升后下降的趋势,发酵7 d 时效果最好,发酵时间长,红曲糖化力反而下降,后续试验采用7 d发酵。
2.1.3 不同装料量对糖化力的影响
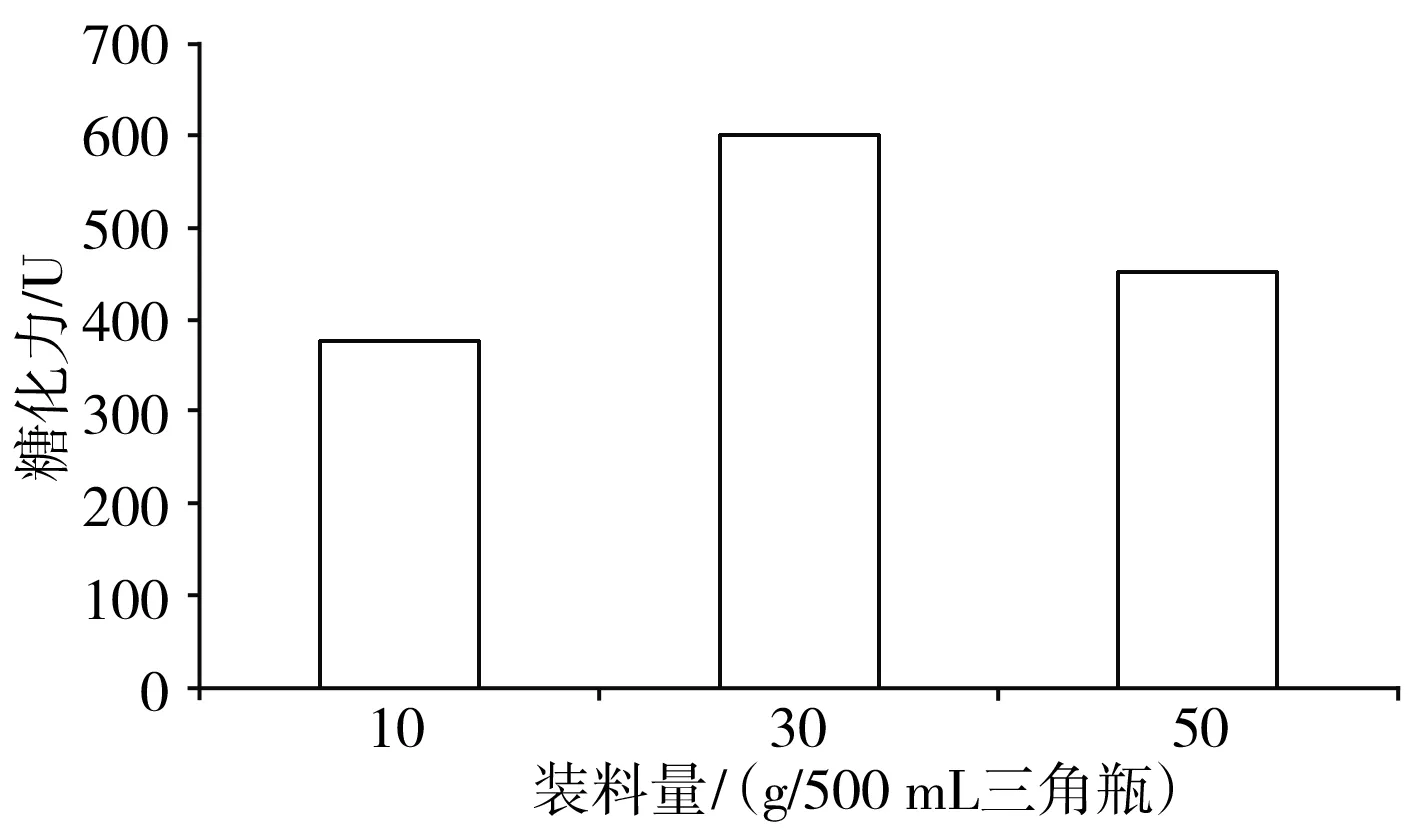
图3 不同装料量对糖化力的影响Fig.3 Effect of loading volume on saccharifying power
装料量不同,导致微生物的生长环境不同,进而影响微生物的代谢产物代谢流程。由图3可知,从500 mL三角瓶装料量发酵结果来看,装料30 g的糖化力最高,装料量少,保湿效果差,物料容易发干,影响培养;装料量多,溶氧效果差,也影响培养效果。在本试验条件下,装料量以30 g效果最好。
2.1.4 不同接种量对糖化力的影响

图4 不同接种量对糖化力的影响Fig.4 Effect of inoculation amount on saccharifying power
接种量也是影响微生物发酵的重要因素之一。接种量小,发酵代谢缓慢,也容易感染杂菌;接种量过大,发酵速度过快,也会影响微生物代谢产物合成。由图4可知,20%接种量效果最好,接种量过大,红曲糖化力反而下降。
2.1.5 初始加水量对糖化力的影响

图5 不同初始加水量对糖化力的影响Fig.5 Effect of initial water additive amount on saccharifying power
微生物的生长、代谢离不开水,不同微生物的生长代谢对水分的要求也不同。由图5可知,初始加水量影响发酵效果,随着初始加水量的增加,麸皮红曲的糖化力也出现先增加后下降的趋势,在本试验条件下,初始加水量为120%时效果最好。
2.1.6 不同培养温度对糖化力的影响

图6 不同温度对糖化力的影响Fig.6 Effect of different temperatures on saccharifying power
微生物的生长和代谢产物的合成是在各种酶的催化活动下进行的,而酶的催化活动受温度的影响。由图6可知,随着温度升高,红曲的糖化力先上升后下降,以30 ℃的糖化力最高。
2.2 正交试验
依据上述单因素试验结果,重新选定各因素较为适宜的试验水平范围进行正交试验(见表1),试验选定A(装料量)、B(接种量)、C(初始加水量)、D(温度)设计四因素三水平正交试验确定最佳组合。

表1 麸皮红曲制作正交试验因素水平表Table 1 The factors and levels of orthogonal experiment of bran red koji

表2 麸皮红曲试验正交水平表Table 2 The orthogonal level table of bran red koji experiment
由表2可知,对麸皮红曲糖化力的影响因素为A>C>D>B,最佳培养条件为A(装料量)30 g/500 mL三角瓶、B(接种量)20%、C(初始加水量)120%、D(温度)30 ℃。
2.3 麸皮红曲与小米红曲风味物质分析
以气相色谱分析麸皮红曲、大米红曲风味物质的差异,同时对原料麸皮、大米的风味物质进行分析,见表3。

表3 红曲及制曲原料风味物质分析Table 3 Analysis of flavor substances of red koji and koji-making raw materials mg/kg
在采用色谱条件下,从红曲及制曲原料中共检测到9种风味物质,醛类2种、酯类5种、醇类2种。在两种红曲及麸皮、大米中,都是醛类物质含量最高,其次酯类物质含量较高。在两种红曲中,麸皮红曲的醛类物质、酯类物质含量高于大米红曲,分别高53.34%、3.82%,但醇类物质含量低于大米红曲,约低9.08%。两种红曲风味物质含量的差别可能与制曲原料有关。麸皮红曲与原料麸皮的风味物质含量相比,麸皮红曲的酯类物质含量高于麸皮,约高18.68%,但醛类物质、醇类物质含量低于麸皮,分别约低6.36%、6.51%。大米红曲与原料大米的风味物质含量相比,大米红曲的酯类物质含量高于大米,约高58.63%,但醛类物质、醇类物质含量低于大米,分别约低64.02%、3.88%。
2.4 麸皮红曲与大米红曲成本分析

表4 麸皮红曲与大米红曲成本分析Table 4 The cost analysis of bran red koji and rice red koji
以麸皮2元/kg、大米4元/kg计,根据它们的出曲率计算吨曲原料直接成本。由表4可知,大米红曲的出曲率低,但价格高于麸皮,麸皮红曲吨成本远低于大米红曲吨成本,约为大米红曲成本的37%左右。从原料直接成本上来看,麸皮红曲具有取代大米红曲的经济可行性。
3 结论
经过单因素试验及正交试验,确定了最佳的麸皮红曲发酵工艺条件:装料量30 g/500 mL三角瓶、接种量20%、初始加水量120%、温度30 ℃。
两种红曲及制曲原料经过风味物质分析,主要含有醛类、醇类、酯类物质,醛类物质含量最高,其次为酯类物质,两种红曲的风味物质含量无显著差异。两种红曲风味物质含量的差别可能与制曲原料有关。
麸皮红曲的出曲率要高于大米红曲的出曲率,且麸皮价格远低于大米价格,麸皮红曲直接原料成本要远远低于大米红曲,因此其具有取代大米红曲的经济可行性。
麸皮红曲能否在生产上应用,首先要考察其对原酒品质的影响,所生产原酒能否满足作为基酒或调味酒的使用要求,其次由于红曲霉在麸皮上生长缓慢,需要实现麸皮红曲的规模化生产,以满足生产应用要求。
