高效液相色谱法测定普洱熟茶中鞣花酸含量
2022-07-13许芮菁刘敏杨锐高林瑞丁章贵陈丹丹
许芮菁,刘敏,杨锐,高林瑞,丁章贵,3,4*,陈丹丹*
(1.云南大益微生物技术有限公司,云南昆明 650217;2.云南省普洱茶发酵工程研究中心,云南昆明 650217;3.云南大学生命科学学院云南省微生物研究所,云南昆明 650091;4.云南大学西南微生物多样性教育部重点实验室,云南昆明 650091)
鞣花酸(Ellagic acid,EA)是一种具有生物活性的酚类化合物,广泛存在于水果、坚果等植物组织中[1],其结构如图1 所示,是一种没食子酸的二聚衍生物。 在自然界中, 鞣花酸主要以缩合形式(如鞣花单宁等)存在[2]。鞣花酸基本无毒性[3],对化学物质诱导的癌变及其它多种癌变具有明显的抑制作用,如结肠癌[4-5]、肝癌[6]、肺癌[7]、前列腺癌[8-9]、乳腺癌[10]、淋巴癌[11]等。此外,鞣花酸还具有抗氧化[12]、抗炎症[13]、抑菌[14]、抑制黑色素生成[15]、改善白血病[16]等功效。 由于其优异的生物活性,鞣花酸被广泛应用于保健食品[17-18]、医疗[19-20]、医药[21-22]、化妆品[23-25]等领域。
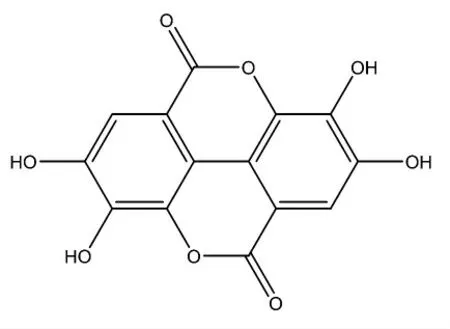
图1 鞣花酸分子结构式Fig.1 The molecular structures of EA
有研究表明, 茶叶是鞣花单宁和鞣花酸的重要膳食来源,鞣花单宁通过人体肠道微生物转化,会转化为鞣花酸等代谢产物[26]。普洱熟茶作为云南名茶, 是由云南大叶种晒青毛茶制成的一种独特微生物发酵茶[27]。普洱熟茶“固态发酵”的实质主要是湿热作用、酶作用以及微生物作用[28]。 大叶种晒青毛茶发酵过程中,微生物代谢释放大量热量,其分泌的酶与茶叶内含物发生激烈的酶促反应,二者均能促进具有热不稳定性的鞣花单宁(如木麻黄素)[29]分解形成鞣花酸。 建立普洱熟茶中鞣花酸含量的检测方法, 可满足普洱熟茶中特征活性成分的质量控制需求, 同时有助于普洱茶发酵过程中特征性物质的变化趋势及微生物的代谢规律研究,为普洱茶的工业化可控发酵提供方法依据。
1 材料与方法
1.1 仪器与设备
Waters e2695 高效液相色谱仪(美国,Waters公司);Waters 2995 PDA (光电二极管列阵检测器,美国,Waters 公司);WD-9415B 超声仪(北京六一仪器厂);H1850R 低温离心机(湘仪离心机仪器有限公司);VORTEX 3 旋涡混匀器(德国,IKA公司);分析天平(精度0.0001 g,美国,OHAUS 公司);Agilent ZORBAX SB-C18 色谱柱 (250 mm×4.6 mm,5 μm,美国,Agilent 公司)。
1.2 材料与试剂
针式过滤器(0.45 μm,尼龙66,天津津腾实验设备有限公司); 乙腈、 甲醇均为色谱纯 (德国MERCK 公司);水为超纯水;磷酸为分析纯;鞣花酸对照品(纯度≥98%,上海源叶生物科技有限公司)。
1.3 色谱条件
Agilent ZORBAX SB-C18 色谱柱 (250 mm×4.6 mm,5 μm);0~20 min,0.2%磷酸∶乙腈(85∶15,体积比),等度洗脱;流速:1 mL/min;进样量为10 μL,柱温35 ℃;光电二极管阵列检测器;检测波长245 nm。
1.4 标准溶液的配制
称取一定量的鞣花酸对照品, 用甲醇溶解配制成质量浓度为60 mg/L 的标准储备液, 于-4 ℃避光保存。使用前,准确移取适量鞣花酸标准储备液, 用甲醇配置成质量浓度分别为1~30 mg/L 的标准系列工作液,于-4 ℃避光保存[10]。
1.5 样品处理
称取适量(精确至0.0001 g)均匀研磨的熟茶样品于50 mL 离心管中,加入适量提取溶剂(水、25%甲醇、50%甲醇、75%甲醇、纯甲醇),使料液比为1∶10、1∶20、1∶30、1∶40 和1∶50,超声一定时间(30 min、45 min、60 min),5000 r/min 下离心10 min,取上清液于100 mL 容量瓶中,重复数次(重复0次、1 次、2 次和3 次, 即提取1 次、2 次、3 次和4次),合并上清液,用纯水定容至100 mL,摇匀,过0.45 μm 水相滤膜后,待测。
2 结果与分析
2.1 高效液相色谱条件优化
使用水-甲醇、水-乙腈、磷酸水溶液-甲醇和磷酸水溶液-乙腈(磷酸浓度为0.2%、0.3%、1%)为流动相,等度洗脱,考察不同流动相种类、比例及pH 对普洱熟茶中鞣花酸分离效果的影响。 从目标峰的峰形、与干扰峰的分离度等方面进行评价。
结果表明,流动相为水-有机相体系时,鞣花酸的色谱峰展宽、拖尾严重,识别困难。 在洗脱体系中加入不同浓度的磷酸进行峰形优化, 鞣花酸色谱峰的峰宽变窄,峰形对称略有拖尾。但不同浓度的磷酸,对峰形变化影响不明显,因此洗脱体系选用0.2%磷酸的浓度。 分别使用甲醇和乙腈有机相洗脱鞣花酸对照品, 发现乙腈洗脱体系鞣花酸的保留时间更短, 且水溶液-乙腈体积比为85∶15时样品中鞣花酸目标峰前后杂质峰较少, 利于定性和定量,能显著提高检测效率。 因此,确定普洱熟茶中鞣花酸定量检测的流动相为0.2%磷酸水溶液-乙腈 (体积比为85∶15), 保留时间为16.0 min(±0.5 min),如图2 所示。

图2 鞣花酸对照品和普洱熟茶样品色谱图Fig.2 The chromatogram of EA in reference substance and in Pu-erh ripe tea sample
2.2 样品前处理优化
分别研究不同料液比、不同提取液种类、不同提取时间和不同提取次数对鞣花酸提取率的影响。 在相同检测条件下对比鞣花酸色谱峰和杂质色谱峰(咖啡因等)的峰高或含量,从而确定最优的前处理方法。
如图3 所示,1∶30、1∶40、1∶50 提取组鞣花酸含量显著低于1∶20 提取组,鞣花酸含量随料液比降低而显著降低,而1∶10、1∶20 提取组间鞣花酸含量无显著差异,当料液比为1∶10 时,咖啡因峰高超过2.0 AU,没食子酸峰高达1.8 AU,考虑到过大响应值可能对检测器造成损耗,因此,1∶20 为最适料液比。
选择水、 甲醇以及不同比例甲醇水为提取溶剂, 评价普洱熟茶中鞣花酸的提取率。 如图4 所示,与水提取组相比,纯甲醇、75%甲醇组鞣花酸提取率显著低于水提取组,50%甲醇、25%甲醇组鞣花酸提取率低于水组,但无显著差异,综合考虑实验成本及环境污染等因素,选择水为最适提取液。
考虑不同提取时间对普洱熟茶中鞣花酸提取率的影响。如图5 所示,鞣花酸含量随着提取时间的增加而增加, 但提取30 min 与提取45 min 相比无显著差异,为提高检测效率,确定提取时间为30 min。
考虑不同提取次数对普洱熟茶中鞣花酸提取率的影响,根据已确定的料液比(1∶20)、提取液(水)和提取时间(30 min),分别超声提取1 次、2次、3 次和4 次。 如图6 所示,鞣花酸含量随着提取次数的增加而增加, 提取3 次与提取1 次和2次相比有显著差异, 且与提取4 次相比有差异但不显著,考虑到检测时长和检测效率,最终采用3次提取。
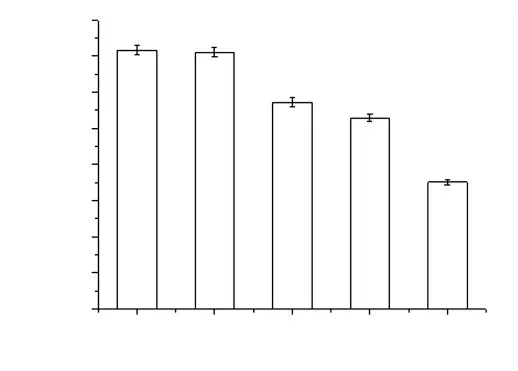
图3 不同料液比对鞣花酸含量的影响Fig.3 Effect of different ratio of material to liquid on content of EA
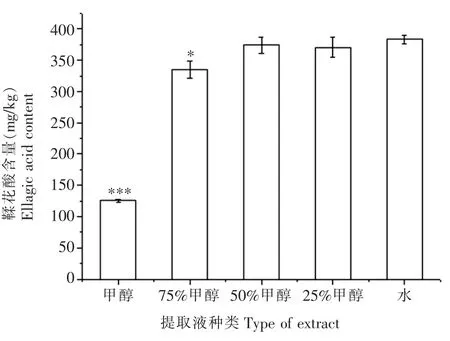
图4 不同提取液对鞣花酸含量的影响Fig.4 Effect of different extracts on content of EA
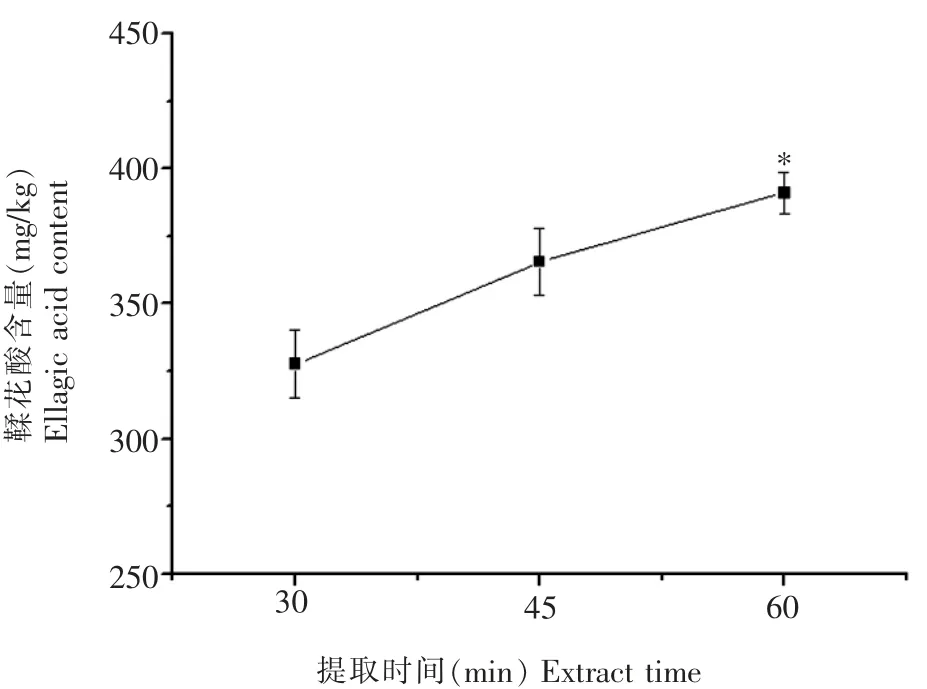
图5 不同提取时间对鞣花酸含量的影响Fig.5 Effect of different extraction time on content of EA
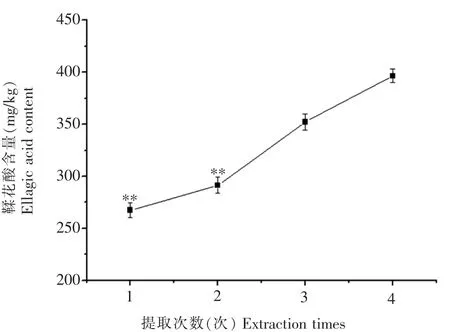
图6 不同提取次数对鞣花酸峰含量的影响Fig.6 Effect of different extraction times on peak area of EA
2.3 方法线性范围与相关系数
采用上述所确定的方法检测鞣花酸对照品,外标法定量,以其峰面积为纵坐标(y 轴),其浓度为横坐标(x 轴)做标准曲线,线性方程、相关系数见表1。 在0.6~60 mg/L 范围内鞣花酸的线性良好。 鞣花酸的检出限(LOD)[30]为13.5 mg/kg,定量限(LOQ)[31]为检出限的3.33 倍,即45.0 mg/kg。
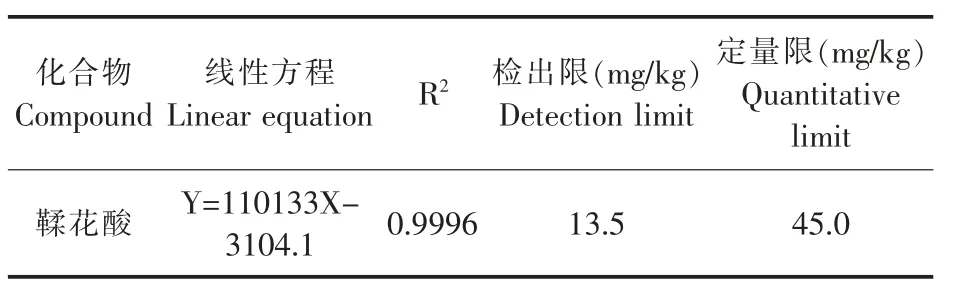
表1 鞣花酸的线性方程、相关系数、检出限和定量限Table 1 The Linear equation,correlation coefficient,detection and quantitative limit of EA
2.4 仪器精密度、方法重现性
取上述同一鞣花酸标准溶液,重复进样6 次,进样量10 μL,以鞣花酸峰面积,计算其相对标准偏差(RSD)为0.28%(n=6)。
根据“1.5”所述,按照最终确定的前处理方法进行同一样品平行实验,每个平行样品进样1 次,进样量10 μL,以各样品的鞣花酸含量,计算其相对标准偏差(RSD)为3.7%(n=6),表明该方法重复性较好。
2.5 普洱熟茶中鞣花酸的含量
对18 个市售普洱熟茶中鞣花酸的含量进行测定, 结果见表2。 样品中鞣花酸含量范围为176.6~398.1 mg/kg。
3 讨论
不同普洱熟茶中鞣花素含量差异明显。 普洱熟茶中的鞣花酸可能由茶叶中的鞣花单宁类物质转化而来,不同等级、不同地区的原料鞣花单宁类物质含量不同, 且发酵程度不同也会影响普洱熟茶中鞣花酸的含量, 具体的影响因素及影响程度有待进一步研究。
目前, 利用高效液相色谱法测定鞣花酸含量的文献中,检测对象多为水果和药用植物,涉及普洱茶中鞣花酸含量的检测方法鲜有报道。 部分文献[32-33]中所述方法提取过程漫长、提取溶液种类复杂且环境危害较大。或因仪器条件配适度较差,目标物与杂质峰未有效分离,导致定量结果不准确。
文章所述方法不仅可用于普洱熟茶中鞣花酸的含量测定,也适用于普洱熟茶深加工产品,且为普洱熟茶发酵过程中鞣花酸变化趋势的研究提供方法基础。 现行大部分检测方法使用的提取溶剂为有机试剂, 前处理包括长时间浸泡或水浴回流及浓缩、蒸干等步骤,相较于这些方法,本方法仅使用纯水超声提取,方法便捷、成本低廉、环境危害小、可批量前处理。 且方法检测周期较短,样品前处理2 h,比其他需要有机试剂预先浸泡数小时再提取的方法更高效。 本方法目标峰前后杂质峰少且较小,分离度较文献方法高,可有效定量目标峰。
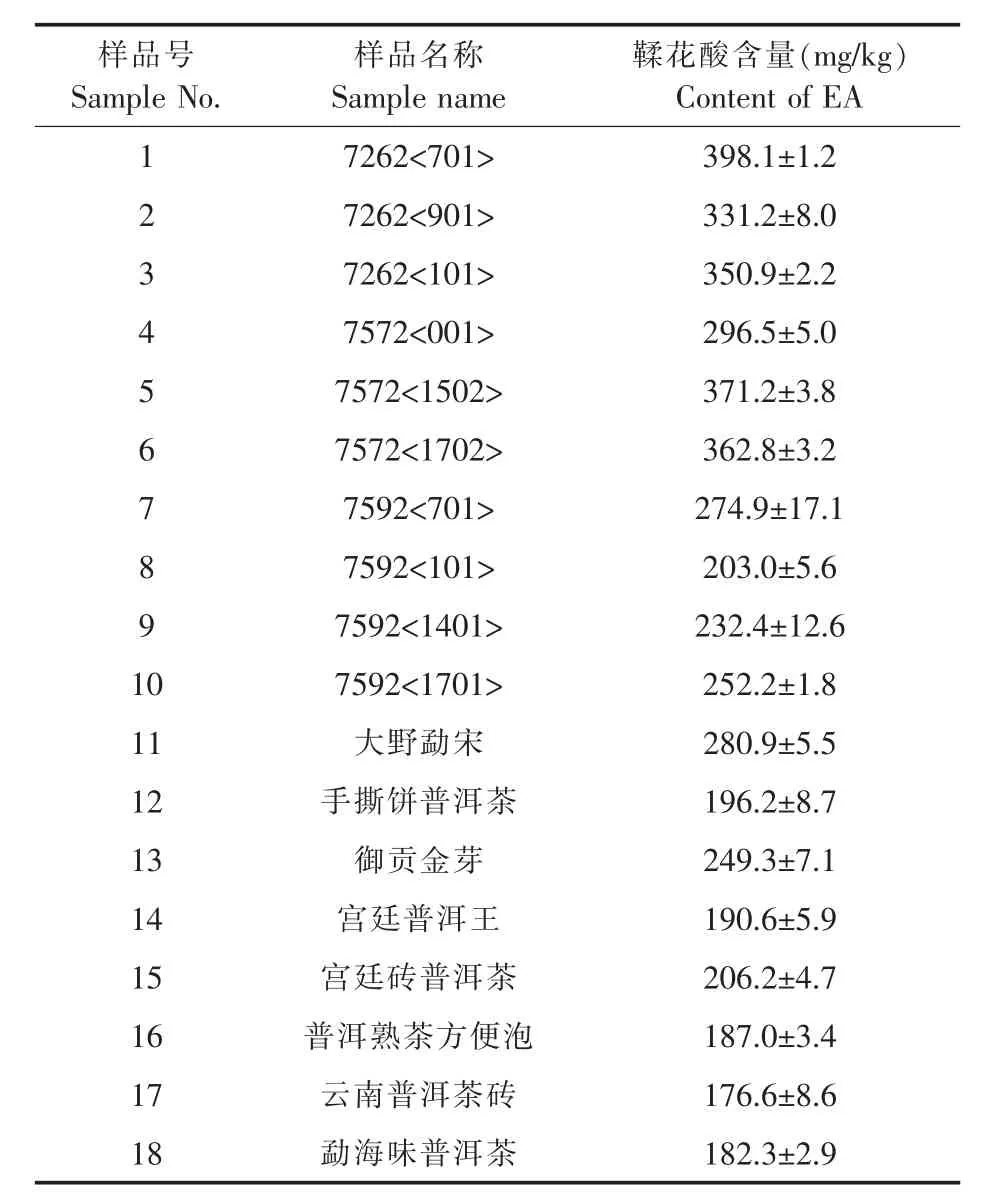
表2 18 个市售普洱熟茶中鞣花酸含量(n=3)Table 2 Contents of ellagic acid in 18 commercially available Pu-erh ripe teas(n=3)
