达格列净通过丝氨酸/苏氨酸蛋白激酶/内皮型一氧化氮合酶途径调节高糖环境下的内皮祖细胞功能
2022-07-13解丹丹巫婷婷赵晓彤许慕蓉陈明卫
解丹丹,巫婷婷,赵晓彤,许慕蓉,陈明卫
研究[1]表明,高血糖可损害血管内皮细胞功能,从而启动糖尿病大血管病变。有学者[2]认为上述病变过程可能与高糖环境下内皮祖细胞(endothelial progenitor cells,EPCs)数量减少和功能异常有内在关系。Meta分析显示EPCs水平降低预示糖尿病患者具有较高的心血管事件、心血管死亡和全因病死率[3]。
作为一种新型的降糖药物,达格列净(dapagliflozin,DAPA)已广泛应用于临床。来自DAPA-HF的III期临床试验[4]结果表明,与安慰剂相比,DAPA可显著降低受试者心血管死亡或心力衰竭恶化的风险。最近有研究[5]表明接受DAPA治疗的2型糖尿病(T2DM)患者外周血中EPCs的数量明显增加。目前有关DAPA对EPCs的作用效应以及机制尚不清楚。因此,该研究旨在通过体外实验探讨DAPA对高糖干预下的EPCs功能影响及其机制。
1 材料与方法
1.1 材料8周龄健康SPF级雄性SD大鼠5只,体质量(213.5±12.4)g(中国科学院上海实验动物中心);FITC标记的荆豆凝集素(FITC-Ulex europaeus agglutinin,FITC-UEA-I)(美国Sigma公司);Dil标记的乙酰化低密度脂蛋白(Dil-acetylated low density lipoprotein, Dil-acLDL)(美国Invitrogen公司);4′, 6-二脒基-2-苯基吲哚(4′, 6-diamidino-2-phenylindole,DAPI)(美国Sigma公司);MTT细胞增殖检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒(上海贝博生物公司);甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)、丝氨酸/苏氨酸蛋白激酶(serine-threonine kinase, AKT)、磷酸化丝氨酸/苏氨酸蛋白激酶(phosphorylated serine-threonine kinase, p-AKT)、内皮型一氧化氮(endothelial nitric oxide, eNOS)、磷酸化内皮型一氧化氮 (phosphorylated endothelial nitric oxide, p-eNOS)抗体及相应二抗、磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase, PI3K)/AKT信号通路抑制剂(LY294002)(上海碧云天生物技术有限公司);DAPA(英国AstraZeneca公司);光学显微镜(BX53M,日本Olympus公司);荧光显微镜(IX73,日本Olympus公司)。
1.2 EPCs的分离该研究获安徽医科大学动物伦理委员会批准(批准文号:LLSC20192304)。参考文献[6]报道,EPCs的分离方法简述如下:5只健康SPF级雄性SD大鼠,正常饮食适应性喂养1周,室温和湿度分别控制在22 ℃和50%。1周后以3%戊巴比妥钠(50 mg/kg)进行腹腔注射麻醉,颈椎脱位处死。用PBS冲洗骨髓腔,直至冲洗液无色透明。随后将骨髓腔灌洗液收集到15 ml离心管中并离心。去除上清液和脂肪,用5 ml PBS重新悬浮细胞。将5 ml淋巴细胞分离液和制备的细胞悬浮液添加到新的15 ml离心管中。通过密度梯度离心法获得单个核细胞,并将其接种到涂有纤维连接蛋白的6孔板中。细胞在含有20% FBS、20 ng/ml VEGF、5 ng/ml bFGF、1%青-链霉素的M199培养基中生长。
1.3 EPCs的鉴定采用FITC-UEA-I和Dil-acLDL双荧光染色法鉴定EPCs。在光学显微镜下连续观察细胞培养3、5和10 d后的形态学变化。至10 d时,培养的EPCs融合率达70%。用培养基将Dil-acLDL稀释至30 μg/ml后添加到细胞中,并在37 ℃培养箱中避光孵育1 h,PBS洗涤细胞2次,加入4%多聚甲醛固定10 min,PBS重复洗涤2次,加入10 μg/ml的FITC-UEA-I 300 μl后避光孵育1 h,PBS洗涤2次,最后加入1 μg/ml DAPI避光孵育5 min,PBS洗涤2次,制作玻片。应用荧光显微镜观察DAPI染色结果,并进行Merge分析。
1.4 细胞分组参照先前的研究[7]结果,该研究中选择DAPA的干预浓度为1 μmol/L。为观察DAPA对高糖干预下EPCs功能以及AKT/eNOS信号通路的影响,将细胞分为4组:对照组(CG组,D-葡萄糖5 mmol/L+25 mmol/L甘露糖醇)、高糖组(HG组,D-葡萄糖30 mmol/L)、高糖+DAPA 组(GD组,用1 μmol/L DAPA预处理24 h,然后用30 mmol/L D-葡萄糖培养24 h)、高糖+DAPA+LY294002组(GDL组,分别用1 μmol/L DAPA和50 μmol/L LY294002预处理24 h和1 h,然后用30 mmol/L D-葡萄糖培养24 h)。每组设4个复孔。
1.5 细胞活力测定将体外培养至第10天的EPCs以每孔5×104个接种于96孔板中,按分组条件干预48 h后,每孔加入50 μl无血清培养基和50 μl MTT试剂,置于培养箱中孵育3 h。吸弃上清液后加入二甲基亚砜振荡10 min。酶标仪于490 nm 处测定各孔吸光度值(OD)。实验重复3次。
1.6 细胞凋亡检测将体外培养至第10天的EPCs以每孔2×106个接种在6孔板中,每孔2 ml DMEM-F12培养基,按分组条件下干预48 h后,收集细胞后800 r/min离心5 min,PBS清洗2次,细胞重悬于400 μl结合液,5 μl Annexin V-FITC混匀,4 ℃避光孵育15 min,再加入10 μl PI 4 ℃避光孵育5 min,立即用流式细胞仪检测,实验重复3次。采用Flowjo V7软件分析结果。
1.7 小管形成实验将预先冷却的Matrigel与无血清培养基混合形成混合物,涂覆于24孔板中,置于37 ℃培养箱中30 min,以固化基质凝胶。将分组条件下处理过的各组细胞以每孔2×104个接种在上述24孔板中,并培养24 h。在倒置显微镜下观察小管形成实验的结果。每孔随机选取5个视野计算小管形成长度,并取平均值。实验重复3次。
1.8 Western blot实验将体外培养至第10天的EPCs以每孔2×106个接种在6孔板中,按分组条件干预,培养48 h后收集细胞并提取总蛋白,BCA法测定蛋白浓度。加入25 μl蛋白上样缓冲液(×5)。按实验分组依次将蛋白上样,电泳1 h分离,200 mA稳流2 h转移至NC膜上。5%封闭液封闭1~2 h,TBST缓冲液洗膜3次,加入GAPDH(1 ∶2 000)、AKT(1 ∶1 000)、p-AKT(1 ∶1 000)、eNOS(1 ∶1 000)、p-eNOS(1 ∶500),4 ℃孵育一抗过夜,洗膜3次,5%封闭液加入二抗1 μl(1 ∶8 000),摇床上低速室温孵育二抗1 h,再次洗膜3次后滴加显影液显影。Quantity One凝胶成像软件分析相对灰度值。

2 结果
2.1 骨髓来源的EPCs鉴定EPCs培养3 d后呈圆形或椭圆形,培养5 d后呈梭形或圆形,培养10 d后呈鹅卵石状。见图1。Dil-ac-LDL和FITC-UEA-1阳性表达的细胞被鉴定为分化的EPCs,见图2。

图1 EPCs形态特征 ×200A: 第3天;B: 第5天;C: 第10天
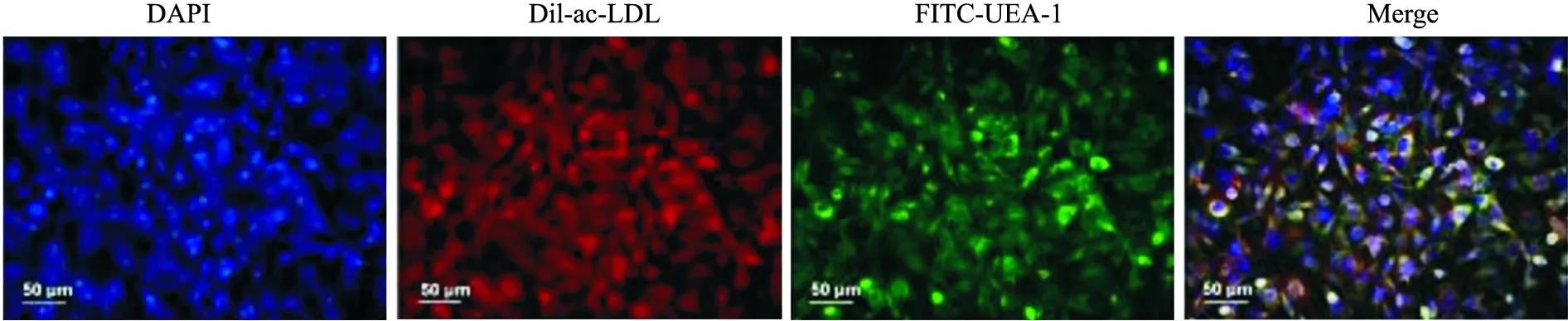
图2 EPCs荧光染色 ×200
2.2 DAPA对EPCs细胞活力的影响与CG组比较,HG组OD值降低;与HG组比较,GD组OD值增加;与GD组比较,GDL组OD值降低,差异均有统计学意义(F=38.25,P<0.05),见图3。
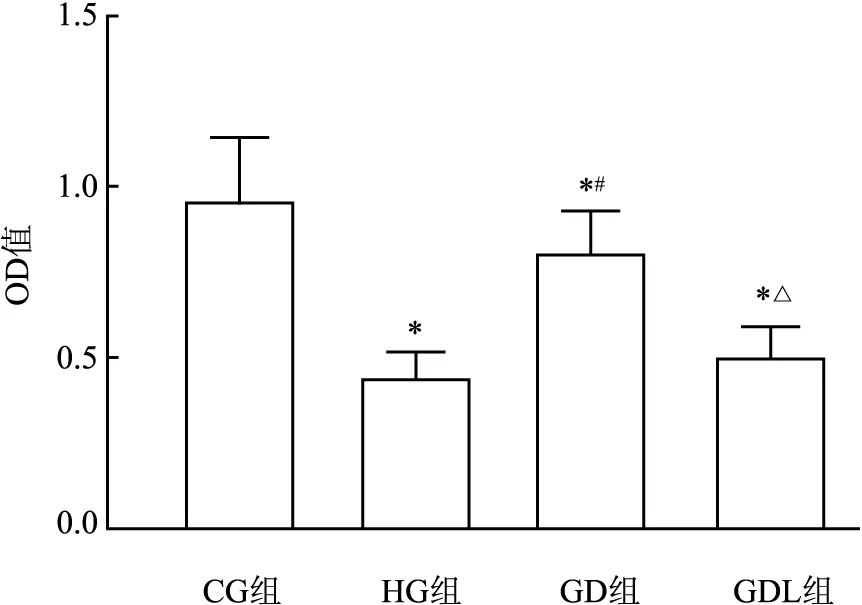
图3 DAPA对EPCs细胞活力的影响
2.3 DAPA对EPCs凋亡的影响HG组、GD组、GDL组EPCs凋亡率分别为 (35.95±4.18) % 、(15.92±1.24) %、(22.27±3.98) %,与CG组(5.9±0.24) % 比较均增加,差异有统计学意义(F=41.54,P<0.05);与HG组比较,GD组EPCs凋亡率降低;与GD组比较,GDL组EPCs凋亡率增加,差异均有统计学意义(F=41.54,P<0.05),见图4。
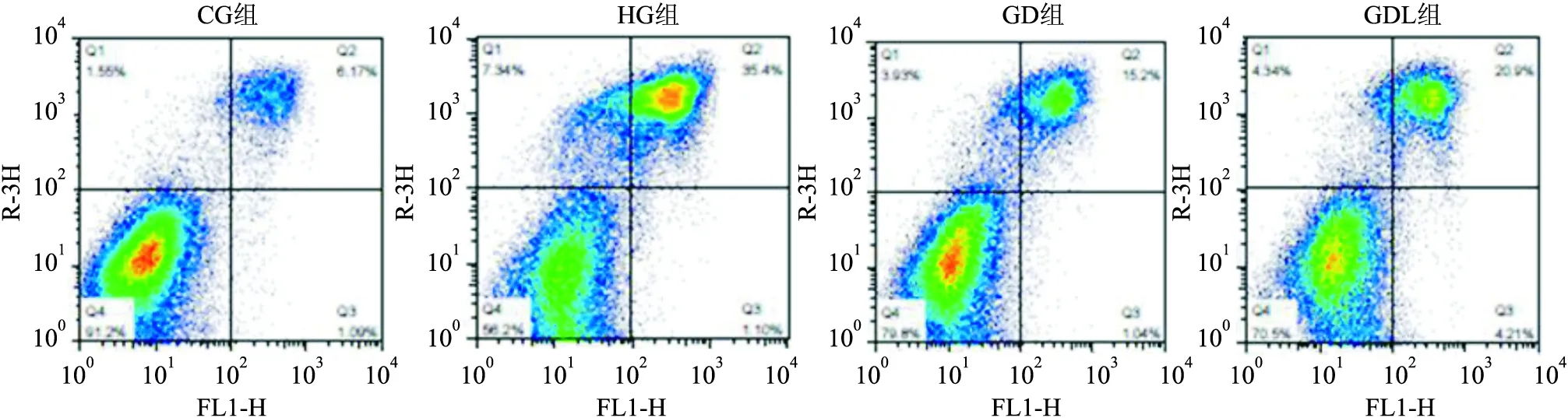
图4 流式细胞仪检测EPCs凋亡
2.4 DAPA对EPCs形成小管能力的影响CG组、HG组、GD组、GDL组EPCs小管形成度分别为(0.61±0.11)mm/mm2、(0.39±0.06)mm/mm2、(1.23±0.16) mm/mm2、(0.46±0.08) mm/mm2。与 CG组比较,HG组小管形成度降低,GD组小管形成度增加;与HG组比较,GD组小管形成度增加;与GD组比较,GDL组小管形成度降低,差异均有统计学意义(F=39.15,P<0.05)。见图5。
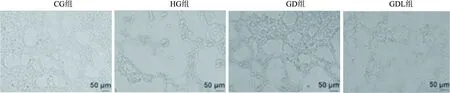
图5 DAPA对EPCs形成小管能力的影响
2.5 DAPA对高糖环境中AKT/eNOS信号通路相关蛋白表达水平的影响与CG组比较,HG组AKT和eNOS的蛋白表达差异均无统计学意义(P>0.05),而p-AKT和p-eNOS的蛋白表达以及p-AKT/AKT和p-eNOS/eNOS比值均降低,差异有统计学意义(F=57.97,P<0.05);与HG组比较,GD组p-AKT和p-eNOS的蛋白表达以及p-AKT/AKT和p-eNOS/eNOS比值均升高,差异有统计学意义 (F=57.97,P<0.05);与GD组比较,GDL组AKT和eNOS的蛋白表达差异均无统计学意义(P>0.05),而p-AKT和p-eNOS的蛋白表达以及p-AKT/AKT和p-eNOS/eNOS比值均降低, 差异有统计学意义(F=57.97,P<0.05)。见图6。
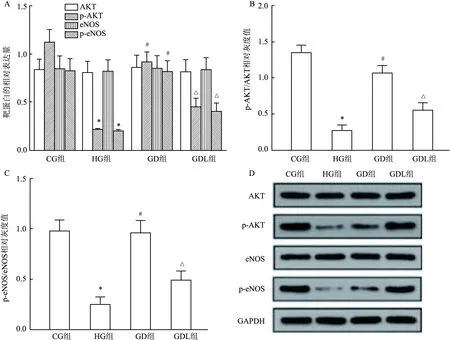
图6 各组不同靶蛋白表达水平比较
3 讨论
大鼠EPCs一般来源于外周血、骨髓和脾脏。考虑到骨髓中EPCs数量最多,该研究从SD大鼠股骨和胫骨骨髓腔分离培养干细胞。培养10 d后,观察到细胞呈鹅卵石样形态,并用Dil-ac-LDL和FITC-UEA-I双重荧光染色鉴定了EPCs,这与先前的实验[8]结果一致。
该研究显示,在高糖环境下,EPCs的增殖活力明显降低,凋亡率明显增加,血管生成特性显著受损。Huang et al[9]研究表明,高血糖可增加EPCs中活性氧自由基的积累,导致氧化应激损伤,从而带来EPCs功能异常。
临床研究[10-11]表明,包括二甲双胍、胰岛素、二肽基肽酶-4抑制剂等在内的一系列降糖药物,在降低糖尿病患者血糖的同时,均可不同程度增加外周血EPCs的数量。近期一项研究[5]显示,在为期12周的小样本随机双盲安慰剂对照研究期间,接受DAPA 10 mg/d、恩格列净10 mg/d治疗的T2DM患者外周血干细胞/祖细胞的数量并无明显改变;而在随后进行的长达1.5年延长期的观察研究中却发现,尽管DAPA治疗组与安慰剂对照组在血糖水平控制上无显著差异,但两组中治疗前后的外周血干细胞/祖细胞的数量改变却明显不同,前者显著增加,而后者却无显著变化,提示DAPA可对抗长期高血糖对EPCs生物学功能的不良影响。为进一步验证此假设,该实验设计此项体外研究,结果显示DAPA可逆转高糖对EPCs的不利影响,增加EPCs的增殖活力以及小管形成能力,降低其凋亡。近期发表的一项随机对照研究[12]表明,100 mg/d的坎格列净持续16周治疗,可改善T2DM患者外周血CD34+EPCs功能。此外,与CG组比较,GD组小管形成度显著增加,提示DAPA可能具有独立于抗高血糖之外的改善EPCs功能效应。
eNOS是调节NO生成的关键酶,也是AKT/eNOS信号通路的重要靶点。研究[13]表明,高糖能显著降低eNOS的磷酸化水平和NO的生物利用度。VEGF可通过AKT依赖的eNOS磷酸化途径激活eNOS,从而增加循环EPCs的数量[14]。此外,AKT/eNOS通路的激活促进了EPCs的增殖、转移和血管修复能力[15]。该实验结果显示,DAPA可恢复EPCs中高糖所带来的p-AKT/AKT和p-eNOS/eNOS比值的降低。因此,DAPA可能通过AKT/eNOS途径在高糖处理的EPCs中发挥调节作用。为了验证这一假设,应用PI3K抑制剂LY294002抑制PI3K/AKT信号通路。与预期一致,LY294002在AKT/eNOS通路相关蛋白表达、细胞增殖活力以及小管形成能力方面,阻碍了DAPA对高糖处理的EPCs的功能恢复,提示DAPA通过AKT/eNOS通路减轻高糖对EPCs的不利影响。
综上所述,DAPA通过恢复AKT/eNOS信号通路,改善了高糖环境中EPCs的功能紊乱。该研究为治疗糖尿病及其并发症提供了潜在的新策略,也为揭示SGLT2类药物的心血管保护机制提供了新依据。
