基于高通量测序技术分析肠道菌群在酒精性肝损伤小鼠中的变化
2022-07-13王惠惠王晓宇胡纯秋
孙 玉,王惠惠,王晓宇,胡纯秋
世界范围内,每年因饮酒造成的死亡人数超过300万,造成全球超过5%的疾病负担[1]。长期饮酒造成肝脏损伤,可发展为酒精性肝病(alcoholic liver disease, ALD)。ALD在所有的肝脏疾病中发病率及病死率最高[2]。越来越多证据表明,肠道菌群在肝脏疾病的发病过程中发挥重要作用。肝脏和肠道由门静脉相连,一旦肠道菌群发生紊乱,肠道稳态被破坏, 过量肠道抗原进入肝脏, 会导致肝脏免疫耐受失衡, 造成肝脏病变和损伤[3]。已有研究[4]表明ALD小鼠体内Firmicutes丰度下降,Bacteroidetes丰度上升;但另有实验[5]表明酒精暴露造成小鼠肠道Firmicutes丰度增加,Bacteroidetes相对丰度下降。尽管已有研究[6]表明肠道菌群与ALD发病密切相关,但肠道菌群多样性以及构成的具体变化尚存争议,仍需更多实验补充验证。该研究以慢性酒精喂养加急性酒精灌胃(Gao-Binge模型)建立酒精性肝损伤小鼠模型,通过检测血清生化指标、肝脏炎性因子mRNA水平、肝脏和肠道病理形态学改变及肠道菌群测序分析确定酒精暴露对肠道菌群的影响,揭示肠道菌群在酒精性肝病发生中的作用,为酒精性肝损伤机制研究提供依据,以期为酒精性肝损伤患者的治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1实验动物 16只6周龄C57BL/6J雄性小鼠,体质量20~23 g,购自北京维通利华实验动物技术有限公司。SPF级动物房温度20~25 ℃,湿度维持(50±5)%,光照周期为12 h/12 h昼夜交替。该实验方案经安徽医科大学实验动物伦理审查委员会审核通过。
1.1.2动物饲料 动物饲料均购自江苏南通特洛菲饲料科技有限公司。Ctrl组小鼠喂养Lieber-DeCarli酒精液体对照饲料(TP4030C)。能量构成比为:碳水化合物47%、脂肪35%、蛋白质18%。EtOH组小鼠喂养Lieber-DeCarli酒精液体饲料(TP4030D),饲料能量构成比为:碳水化合物19%、脂肪35%、蛋白质18%和酒精28%。
1.1.3主要仪器 罗氏公司RL7600D全自动生化分析仪、石蜡切片机、全自动组织脱水机、组织包埋机、冷冻切片机均购自德国徕卡公司;OLYMPUS显微镜购自日本奥林巴斯公司。
1.2 方法
1.2.1动物分组与处理 16只6周龄小鼠适应性喂养1周后,随机分配到对照组(Ctrl组)和酒精组(EtOH组),每组8只;造模过程包括5 d液体饲料适应期,6 d酒精液体饲料过渡期(酒精液体饲料与对照液体饲料混合的比例分别为(1 ∶2、1 ∶1、2 ∶1),10 d酒精饲料造模期和单次5 g/kg酒精灌胃(Ctrl组灌胃9 mg/kg麦芽糖糊精溶液)。灌胃9 h后麻醉小鼠取材,收集血清和组织进行后续检测。
1.2.2血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)、三酰甘油(triglyceride, TG)检测 取血后于常温静置2 h,离心3 500 r/min,15 min,分离血清后,使用全自动生化分析仪测定血清ALT、AST以及TG含量。
1.2.3HE染色 取新鲜组织,迅速置于4 %多聚甲醛内固定,制作石蜡包埋。 制备4 nm切片,进行苏木精和伊红染色,封片,光学显微镜下观察(×200)。肠道病理评分参考DIELEMAN评分标准[7]。
1.2.4实时荧光定量PCR实验(qRT-PCR) 根据TRIzol试剂盒说明书,提取肝脏组织总RNA,稀释后确定RNA纯度并定量至0.5 μg/μl,逆转录成cDNA后,用1 μl cDNA上机扩增,以18S为内参,以EtOH组与Ctrl组的比值来表示肿瘤坏死因子(tumor necrosis factor, TNF)-α、白细胞介素(interleukin, IL)-6、IL-8、IL-1β mRNA水平(表1)。

表1 各基因的引物序列
1.2.516S rDNA测序 造模结束时,采取无菌方法收集粪便,从每组随机选取5~6个粪便样品进行检测。利用QIAamp DNA Stool Mini Kit试剂盒提取粪便总基因组DNA,取30 ng合格的DNA样品加引物,引物序列为515 F:GTGCCAGCMGCCGCGGTAA,806 R:GGACTACHVGGGTWTCTAAT,配置成PCR反应体系后对V3+V4区域进行扩增,扩增条件为95 ℃、3 min,循环30次(95 ℃ 、45 s,56 ℃、45 s,72 ℃、45 s),72 ℃、10 min,4 ℃静置,纯化后的扩增产物溶于Elution Buffer,贴上标志完成建库,以Hiseq2500测序系统的PE250模式上机测序,将原始数据存储于序列数据库,用于后续分析。
1.2.6肠道菌群测序结果分析 α多样性分析采用估计物种总数的Chao指数和综合评估群落丰富度及均匀度的Shannon指数;β多样性分析采用主坐标分析(principalco ordinatesanalysis, PCoA),使用相似性分析分别从门和属水平比较各组小鼠肠道菌群组成差异。采用组间群落差异分析 (LDA effect size, LEf Se)确定各组小鼠菌群样本之间有显著差异的类群。

2 结果
2.1 基本情况两组小鼠均无死亡现象,EtOH组小鼠最后1次灌胃后出现嗜睡、瘫倒等醉酒症状,7 h后逐渐恢复意识。Ctrl组小鼠情况良好、行动正常。
2.2 酒精对小鼠体质量的影响酒精对小鼠体质量的影响见图1。 EtOH组小鼠实验期间体质量呈下降趋势,且造模后期有较大幅度下降,由于Ctrl组遵循等热量喂养原则,Ctrl组小鼠体质量与EtOH组保持一致趋势,后期波动较为平稳。造模结束时,EtOH组相较于Ctrl组体质量降低(t=5.728,P<0.01)。表明摄入酒精对小鼠体质量有一定影响。
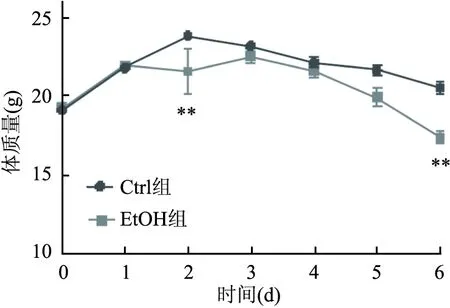
图1 酒精对小鼠体质量的影响与Ctrl组比较:**P<0.01
2.3 酒精对小鼠肝脏损伤的影响相较于Ctrl组,EtOH组肝脏指数无升高趋势(t=0.064,P=0.951)(图2A)。与Ctrl组ALT、AST相比,EtOH组血清ALT、AST活性升高(t=3.097,P=0.015;t=5.324,P=0.001)(图2B、C)。EtOH组TG相较于Ctrl组有升高趋势,但差异无统计学意义(t=1.571,P=0.209)(图2D)。HE染色后显示EtOH组小鼠肝小叶界限不清,肝索排列紊乱,可见清晰的脂肪空泡,同时观察到散在的细胞坏死以及炎性浸润(图2E)。Ctrl组小鼠肝小叶结构正常,肝索放射状排列,肝窦及肝细胞未见明显病理性损伤。
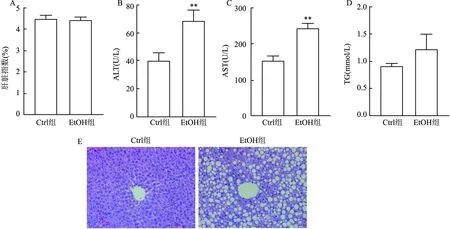
图2 酒精对小鼠肝脏损伤的影响A:肝脏指数;B:血清ALT水平;C:血清AST水平;D:血清TG水平;E:肝脏HE染色 ×200;与Ctrl组比较:**P<0.01
2.4 酒精对小鼠肝脏炎性因子基因表达的影响与Ctrl组相比,EtOH组小鼠肝脏TNF-α mRNA有升高趋势,但差异无统计学意义(t=2.737,P=0.069),IL-6、IL-8、IL-1β mRNA相对表达量均升高(t=3.858,P=0.008;t=10.237,P<0.01;t=11.960,P<0.01)(图3)。
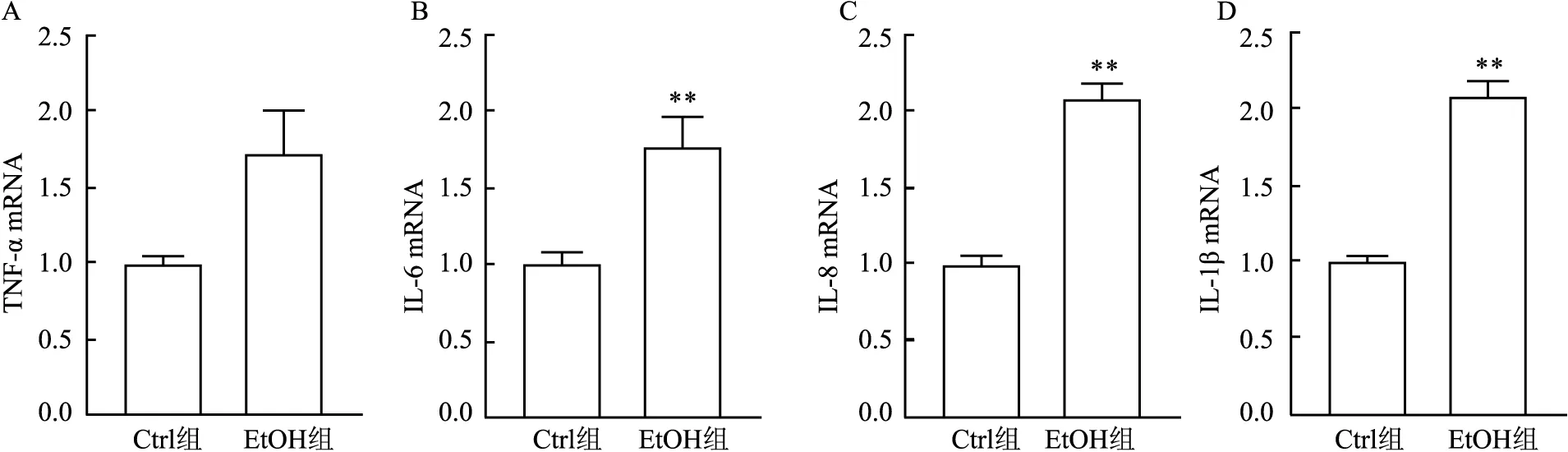
图3 酒精对小鼠肝脏炎性因子表达的影响
2.5 酒精对小鼠肠道病理改变的影响EtOH组小鼠结肠黏膜表面不光滑、结构欠清晰,腺体排列紊乱、萎缩,可见炎症浸润。Ctrl组小鼠结肠组织表面光滑,且腺体排列整齐,无明显充血或水肿现象。EtOH组与Ctrl组结肠病理学评分差异有统计学意义(t=7.155,P<0.01)。见图4。
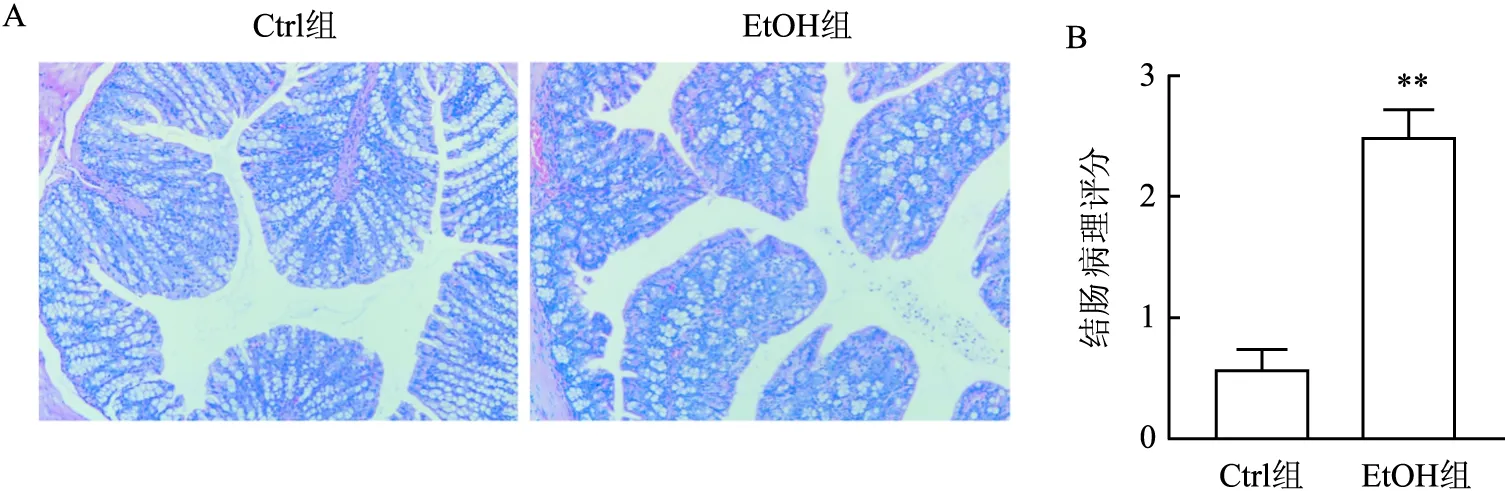
图4 小鼠结肠HE染色及病理评分A:结肠HE染色 ×100;B:结肠病理学评分;与Ctrl组比较:**P<0.01
2.6 酒精对小鼠肠道菌群的影响
2.6.1AlPha多样性分析 AlPha多样性分析是对单个样品中物种多样性的分析,图5中AlPha多样性相关指标Chao指数和Shannon指数显示,EtOH组与Ctrl组物种丰富度和均匀度差异无统计学意义(P>0.05)。
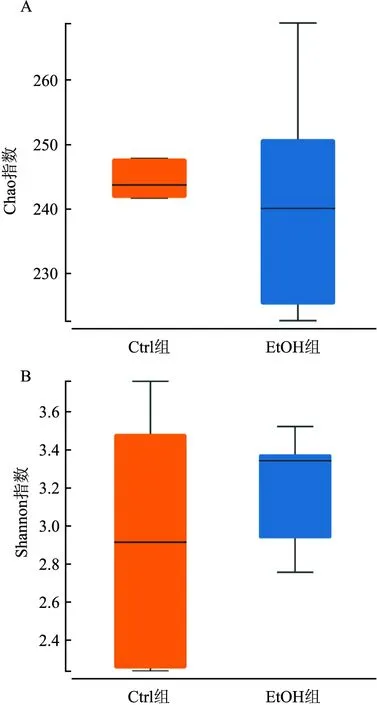
图5 AlPha多样性分析A:Chao指数;B:Shannon指数
2.6.2PCoA分析 PCoA分析即主坐标分析,可用来研究样本群落组成的相似性或相异性。样本的物种丰度和构成越接近,则在PCoA图中距离越近。PCoA1作为第1主坐标对肠道菌群的代表性为28.63%、 PCoA2为第2主坐标,代表性为20.03%。PCoA2轴上可见EtOH组与Ctrl组距离相差较大且差异有统计学意义(R2=0.176,P=0.032),见图6。表明两组小鼠肠道菌群的物种的丰度和构成存在差异。
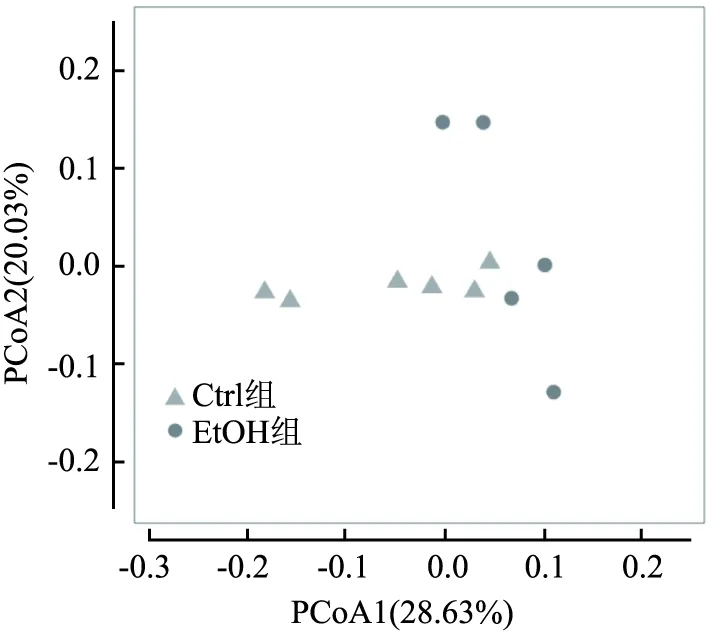
图6 PCoA分析
2.6.3肠道菌群门水平丰度分析 两组小鼠肠道菌群主要由6个菌门构成,且两组均以Bacteroidetes和Firmicutes为主要菌门,其他菌门丰度较低。与Ctrl组相比,EtOH组Bacteroidetes差异无统计学意义(P>0.05),而Firmicutes相对丰度升高(t=1.265,P=0.036)。进一步比较Firmicutes/Bacteroidetes,差异无统计学意义(P>0.05)。见图7。
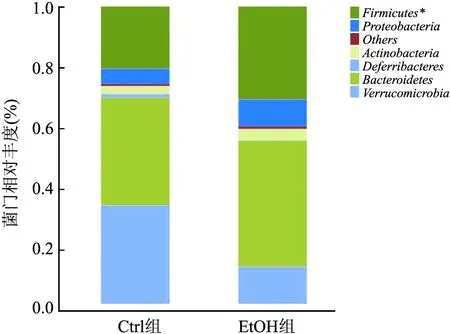
图7 肠道菌群门水平丰度分析与Ctrl组比较:*P<0.05
2.6.4肠道菌群属水平丰度分析 Ctrl组和EtOH组中由11个菌属构成,且可知的优势菌属均为Akkermansia,且EtOH组丰度有下降趋势,但差异无统计学意义(t=1.384,P=0.053)。与Ctrl组相比,EtOH组Parasutterella相对丰度降低(t=3.201,P=0.016)。见图8。
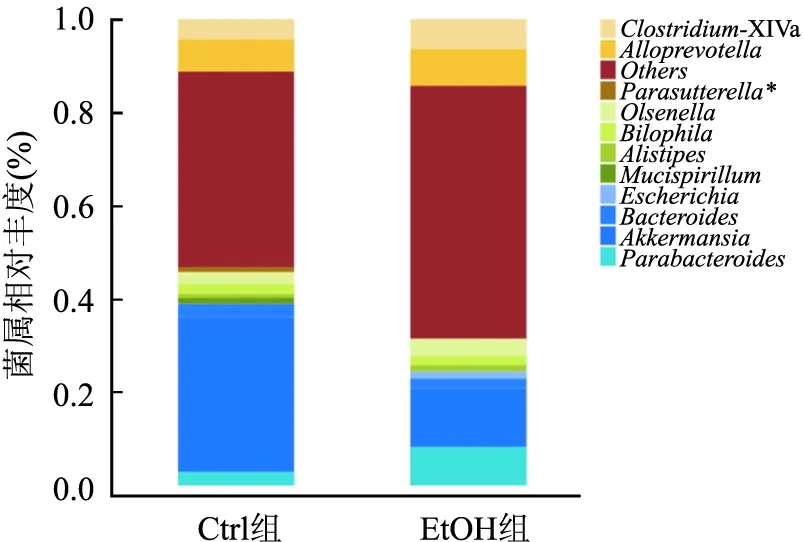
图8 肠道菌群属水平丰度分析与Ctrl组比较:*P<0.05
2.6.5LEf Se差异分析结果 采用LEf Se筛选Ctrl组和EtOH组之间有差异的物种。当LDA值超过设定值(默认设定值为2)则认为该物种是构成Ctrl组与EtOH组肠道菌群差异的生物标志物。Clostridium-XVIII(P=0.035)在Ctrl组中富集,Clostridiaceae和Clostridium-sensu-stricto(P=0.015、0.015)在EtOH组中丰度较低。见图9。
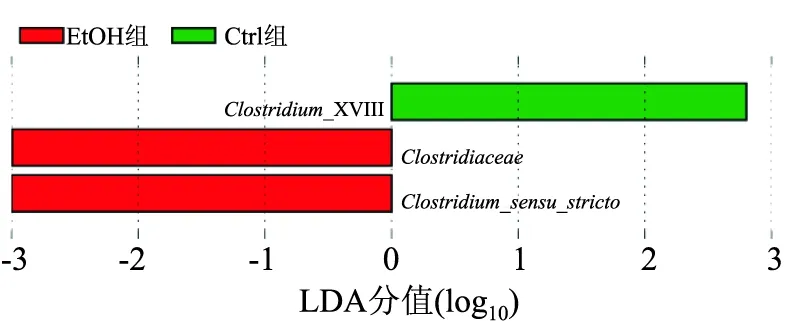
图9 LEf Se差异分析
3 讨论
酒精性肝病作为全球重大公共卫生问题,建立完善、可靠的酒精性肝损伤模型是研究其发病机制和探索其防治方法的重要前提。目前常用的酒精肝损伤动物模型主要包括慢性酒精喂养模型、胃内灌注酒精模型、急性酒精灌胃模型以及慢性酒精喂养加一次急性灌胃的Gao-Binge模型。该研究采用Gao-Binge模型,不仅缓解了慢性酒精喂养时间过长导致的病死率较高问题,又避免了急性酒精灌胃模型病理改变效果微弱的缺点,同时高度还原人类饮酒方式,短期内可造成更严重的肝脏损伤[8]。
血清ALT、AST升高被广泛认为是酒精性肝损伤的显著性标志。过量酒精刺激肝脏时,乙醇代谢产生自由基侵袭肝细胞膜以及线粒体膜,引起膜通透性增大,释放ALT、AST入血。脂质代谢异常引起的肝脂质堆积是ALD最早的表现形式[9]。该研究结果显示,与Ctrl组相比,EtOH组小鼠血清ALT、AST大幅升高,TG有升高趋势,但差异无统计学意义。该研究中酒精暴露并没有引起小鼠肝指数的变化。白云峰 等[10]利用BALB/c、C57和C3H 3种不同品系小鼠建立酒精性肝动物模型,比较各项肝损伤指标后表明,C57品系小鼠肝指数虽无明显变化,但由于其对酒精厌恶性更低,血清ALT、AST、TG升高更显著,HE染色呈现病理改变更严重,仍是最理想的实验动物品系。该研究中EtOH组小鼠肝脏病理切片也有不同程度的脂肪空泡、炎性浸润,与血清结果变化基本一致。以上结果说明该研究成功建立酒精性肝损伤模型。
肠道菌群失调导致的肠道屏障功能障碍、细菌位移、内毒素血症是ALD发生的中心环节[11]。长期大量酒精暴露造成肠道菌群失调,肠道屏障破坏,内毒素进入肠腔与Toll样受体及NOD样受体结合,激活NF-κB通路,释放大量包括TNF-α、IL-1β在内的炎性因子,同时可以与IL-6、IL-8等相互作用发生炎性级联效应,从而促进肝脏损伤[12]。Park et al[13]研究表明,酒精喂养小鼠的肠道上皮细胞结构丢失、肠绒毛及隐窝变形。该研究同样表明,酒精暴露可致小鼠结肠结构欠清晰、腺体萎缩,出现炎症浸润。同时发现EtOH组小鼠肝脏IL-1β、IL-6、IL-8等炎性因子水平升高。Engen et al[4]研究表明ALD小鼠体内Firmicutes下降,Bacteroidetes和Verrucomicrobia数量上升,而Lin et al[5]同样利用酒精喂养小鼠发现Firmicutes丰度增加,Bacteroidetes相对丰度下降。该研究表明,酒精暴露虽然对小鼠肠道菌群多样性无较大影响,但在改变菌群构成方面有很大作用。在菌门水平上,EtOH组小鼠肠道Bacteroidetes无明显变化,而Firmicutes丰度增加。进一步比较Firmicutes/Bacteroidetes,差异无统计学意义。在菌属水平上,EtOH组肠道Parasutterella丰度下降。Firmicutes是一种常见的革兰阳性菌,能够通过加重脂质沉积导致肝脏损伤[14]。Parasutterella作为肠道健康粪便核心微生物之一,与炎症性肠病、脂肪肝等疾病发生密切相关[15]。进一步LEf Se差异分析显示,与Ctrl组相比,EtOH组以Clostridiaceae和Clostridium-sensu-stricto为其重要菌种,Clostridium-XVIII则为Ctrl组中的重要菌种。而许文琦 等[16]利用酒精喂养建立大鼠酒精肝模型,发现毛螺菌科和瘤胃球菌属-1为酒精作用下肠道发挥作用的重要菌属,原因可能是不同动物品种的肠道菌群结构和丰度本就存在一定差异,因此,在酒精作用下发挥作用的菌群也有所不同。由此可知,酒精暴露未影响肠道菌群多样性,但改变了肠道菌群结构,并可能通过上调小鼠肠道Firmicutes丰度、减少Parasutterella相对丰度,且以Clostridiaceae和Clostridium-sensu-stricto为重要菌属,影响肠道健康,改变肠道屏障功能。
综上所述,酒精暴露造成的肝脏损伤小鼠,其肠道菌群发生变化,该变化可能与肝病的发生相关。该研究从肠道菌群变化入手,揭示其在酒精暴露致小鼠肝损伤中的作用,为探索酒精性肝病的预防和治疗方法提供新思路。
