高糖环境下肾小管上皮细胞来源外泌体诱导巨噬细胞向肌成纤维细胞转化
2022-07-13吴永贵齐向明
王 东,吴永贵,齐向明
糖尿病肾病(diabetic nephropathy,DN)是一种严重的糖尿病微血管并发症,肾脏纤维化是DN进展为终末期肾病最重要的病理生理变化。研究DN纤维化的机制进而阻断甚至扭转肾脏纤维化的发生发展一直是需要努力的重点。研究[1]表明,DN是一种炎症性疾病,巨噬细胞的浸润则是DN发病机制中的关键步骤。研究[2]表明,在DN中,巨噬细胞发生了向肌成纤维细胞的转化,即巨噬细胞-肌成纤维细胞转化(macrophage-to-myofibroblast transformation, MMT),进而引发肾脏纤维化。而DN中的肌成纤维细胞50%来源于浸润的巨噬细胞[3]。然而,MMT在DN中究竟是如何引发的,目前鲜有报道,因而被作为该研究的重点。外泌体是由膜衍生而来的纳米级囊泡,常常是各细胞间交流并传递信息的重要载体。研究[4]表明,抑制肾小球上皮细胞来源的外泌体可以抑制DN纤维化的发生。另有研究[5]表明,高糖环境下肾小球内皮细胞分泌的外泌体,能够激活系膜细胞,进而引发肾脏纤维化。因此,该研究着眼于外泌体,试图将MMT与DN纤维化联系起来。在DN中肾小管的损伤常常发生较早,而血糖水平的高低与其损伤程度直接相关。因此,该研究将探讨高糖环境下人肾小管上皮细胞(human renal tubular epithelial cells,HK2)产生的外泌体能否以及如何促使巨噬细胞向肌成纤维细胞转化,为DN纤维化的机制研究提供新的思路,从而为DN的治疗奠定新的基础。
1 材料与方法
1.1 试剂与仪器人HK2细胞株由孟晓明教授(安徽医科大学)惠赠,THP-1细胞株由孙国平教授(安徽医科大学)惠赠,胎牛血清(加拿大Wisent公司),青-链霉素双抗溶液、D-葡萄糖和MINI67-1KT(美国Sigma公司),胰蛋白酶和BCA蛋白浓度试剂盒(上海碧云天生物技术有限公司),无外泌体血清(美国System Biosciences公司),ELISA试剂盒(上海Excell Bio公司),反转录试剂盒和qRT-PCR试剂盒(南京诺唯赞公司),引物(上海生工公司),CD63抗体(上海Bioscience公司),TSG101抗体(美国Abcam公司),TRIzol试剂(美国Life Technology公司),FITC Mouse Anti-CD206和IgG1 Isotype Control(美国BD公司),PE Rabbit Anti-iNOS和IgG Isotype Control(北京博奥森公司),兔抗CD206、兔抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、兔抗Col-IV、兔抗FN、兔抗TGF-β1抗体、小鼠抗β-action单克隆抗体、辣根过氧化物酶标记的羊抗兔IgG (武汉三鹰公司),Calnexin抗体、兔抗Smad3和兔抗p-Smad3抗体(美国CST公司),ECL增强化学发光试剂盒(美国Thermo Scientific公司)。
1.2 方法
1.2.1获取、标记及鉴定外泌体 ① HK2细胞株用无外泌体的FBS培养,待细胞融合达70%~80%,换无血清培养基继续培养24 h同步化。将HK2分为正常组(5.5 mmol/L)和高糖组(30 mmol/L),培养48 h,分别收集两组上清液,离心获取沉淀(即外泌体),以适量PBS重悬,-80 ℃保存;② 将获得的外泌体冰上自然解冻,醋酸双氧铀室温下负染1~2 min,PBS反复冲洗晾干,电镜观察;③ 将获得的外泌体依次加入稀释液C和PKH67后反复离心,得到PKH67标记外泌体,加入PBS重悬,避光4 ℃保存,用于后续实验。
1.2.2激光共聚焦 ① 标记的外泌体与THP-1巨噬细胞共培养24 h,将细胞固定、破膜、封闭、染核,激光共聚焦显微镜观察THP-1巨噬细胞能否吞噬外泌体;② 将外泌体刺激的THP-1巨噬细胞接种孔板中,4%多聚甲醛固定10 min,PBS清洗,5%驴血清封闭2 h,分别加入抗CD206、抗α-SMA、抗Col-IV、抗FN一抗(1 ∶200),4 ℃孵育过夜,PBS洗3次后,加入FITC、PE标记的二抗(1 ∶200)室温孵育2 h,DAPI染细胞核,封片后采集图像。
1.2.3流式细胞术 各组THP-1巨噬细胞取样加入流式管,4 ℃下1 000 r/min离心5 min,弃上清液后PBS重悬,加入受体阻断抗体,室温放置20 min后洗涤。 4 ℃下1 000 r/min离心10 min,加PBS重悬,分别加入同型IgG、FITC-CD206、PE-iNOS,室温孵育30 min。避光洗涤离心,弃上清液再次加入PBS重悬,流式细胞仪检测。
1.2.4Western blot实验 处理后的细胞经冰上裂解,提取总蛋白,采用BCA试剂盒测定蛋白浓度。取蛋白上样,经凝胶电泳、恒流转膜后,脱脂牛奶封闭2 h,抗α-SMA、抗CD206、抗iNOS、抗Col-IV、抗FN、抗TGF-β1、抗Smad3、抗p-Smad3一抗孵育过夜,TBST洗膜,加入辣根过氧化物酶标记的二抗,孵育45 min,洗膜,ECL显色,曝光显影定影后,以β-actin为内参,计算各蛋白的相对表达量。
1.2.5实时荧光定量PCR 将THP-1巨噬细胞分为空白组、正常糖外泌体刺激组和高糖外泌体刺激组,收集处理后的细胞,用TRIzol、三氯甲烷、异丙醇提取细胞总RNA,根据试剂盒操作说明将RNA反转录成cDNA,SYBR Green法进行反应,检测TGF-β1、IL-6、IL-10的mRNA表达。引物序列见表1。采用2-△△Ct法分析相对表达量。

表1 引物序列
1.2.6ELISA实验 收集处理后各组培养上清液,用试剂盒检测样品在特定波长处的吸光度,依照标准曲线计算上清液中TGF-β1、IL-6、IL-10浓度。

2 结果
2.1 HK2来源外泌体鉴定从正常糖组、高糖组HK2细胞的培养上清液中提取到的囊泡,在电镜下观察,可见典型双层膜结构,且直径分布于30~100 nm之间。将各组囊泡的重悬液采用Western blot进行检测,结果提示外泌体的标志蛋白CD63和TSG101有着阳性表达,而内质网分子伴侣蛋白Calnexin却未见表达,表明所获取的外泌体纯度较高。见图1。

图1 外泌体电镜下形态及标志蛋白的表达
2.2 THP-1巨噬细胞与外泌体共培养① DAPI染核,PKH67标记外泌体,用激光共聚焦显微镜观察THP-1巨噬细胞中是否有PKH67的绿色荧光表达,结果提示外泌体能够被THP-1巨噬细胞所吞噬,见图2。② 通过Western blot检测细胞α-SMA蛋白表达,得出各组外泌体的最佳刺激浓度为40 mg/L、最佳刺激时间为96 h,见图3。 ③ 通过流式细胞术检测iNOS和CD206,提示高糖外泌体刺激后,THP-1巨噬细胞会分化为M1和M2型。与刺激48 h比较,刺激24 h时M1型巨噬细胞比例明显居高;与刺激84 h比较,刺激96 h时M2型巨噬细胞比例则明显居高,THP-1巨噬细胞经高糖外泌体刺激24 h以M1型巨噬细胞为主,刺激96 h则以M2型巨噬细胞为主,见图4。④ Western blot显示不同刺激时间下iNOS和CD206的蛋白表达,见图5。
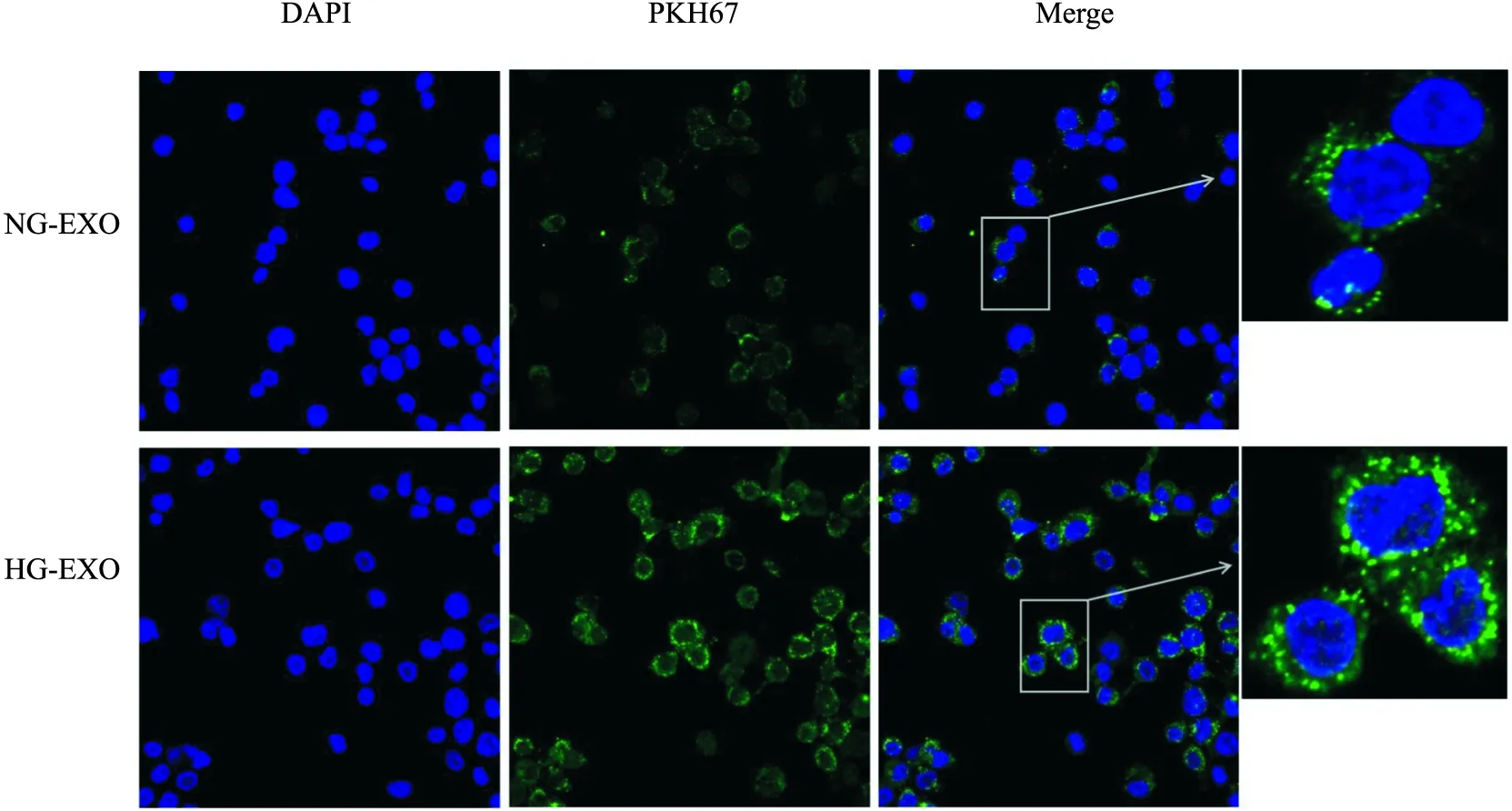
图2 THP-1巨噬细胞吞噬外泌体 ×400

图3 外泌体刺激的最佳浓度和时间NG-EXO:正常糖外泌体刺激;HG-EXO:高糖外泌体刺激;与空白组比较:*P<0.05;与NG-EXO组比较:#P<0.05

图4 iNOS阳性细胞百分比和CD206阳性细胞百分比随着外泌体刺激时长而改变与12 h组比较:*P<0.05;与84 h组比较:#P<0.05
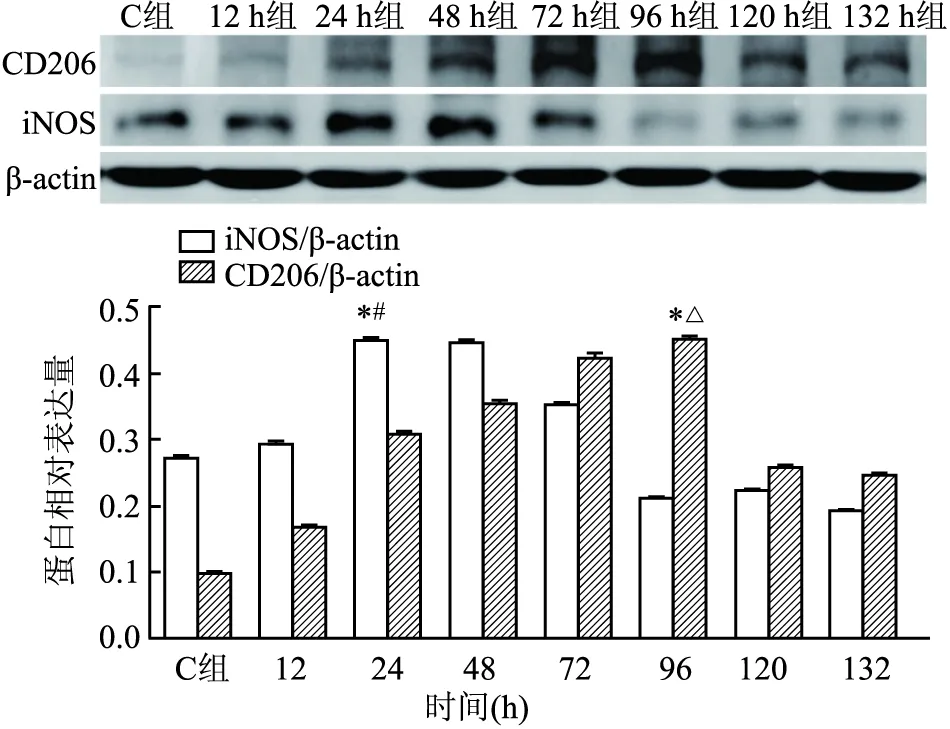
图5 iNOS、CD206蛋白表达量随着外泌体刺激时长而变化
2.3 THP-1巨噬细胞经外泌体刺激后的分泌功能改变分别用正常糖组外泌体(EXO-NG)和高糖组外泌体(EXO-HG)刺激THP-1巨噬细胞。① 激光共聚焦结果显示:与正常组(C组)相比,高糖组THP-1巨噬细胞CD206和α-SMA、Col-IV、FN共表达的荧光强度显著增强。见图6~8。② Western blot结果显示:高糖组THP-1巨噬细胞中α-SMA、Col-IV和FN蛋白表达量均显著增加(F=1 340.34,P<0.05;F=173.81,P<0.05;F=303.14,P<0.05)。见图9。③ qRT-PCR结果显示:与正常组相比,高糖组THP-1巨噬细胞TGF-β1、IL-10的mRNA表达水平均明显上调(F=582.39,P<0.05;F=463.48,P<0.05;F=333.45,P<0.05),IL-6的mRNA表达水平则明显下调(P<0.05)。④ ELISA结果显示:与正常组相比,高糖组THP-1巨噬细胞上清液中TGF-β1、IL-10分泌量明显上调(F=361.71,P<0.05;F=50.69,P<0.05),而IL-6分泌量则明显下调(F=49.33,P<0.05)。见图10。

图6 CD206和α-SMA共表达 ×400

图7 CD206和Col-IV共表达 ×400
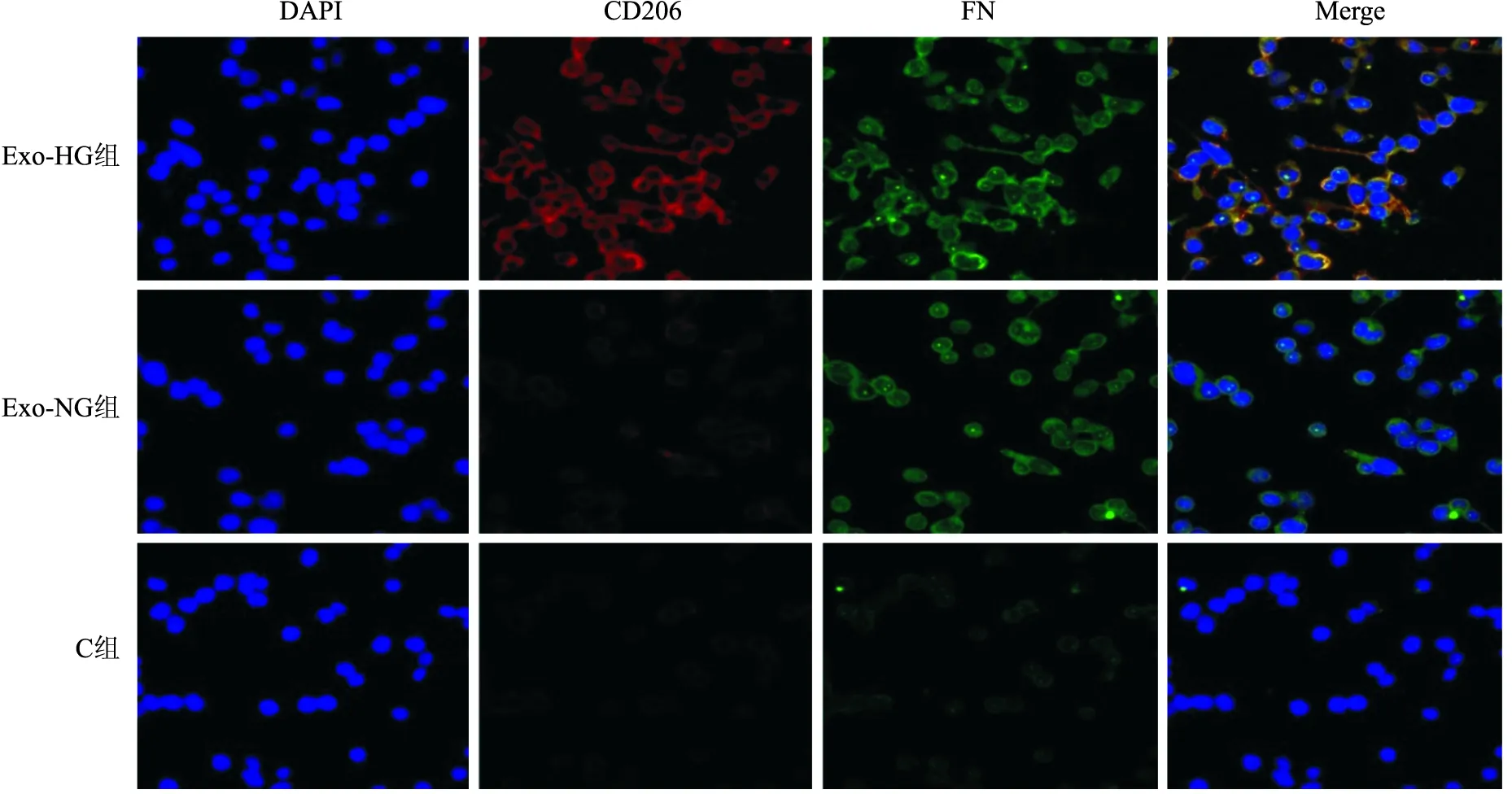
图8 CD206和FN共表达 ×400
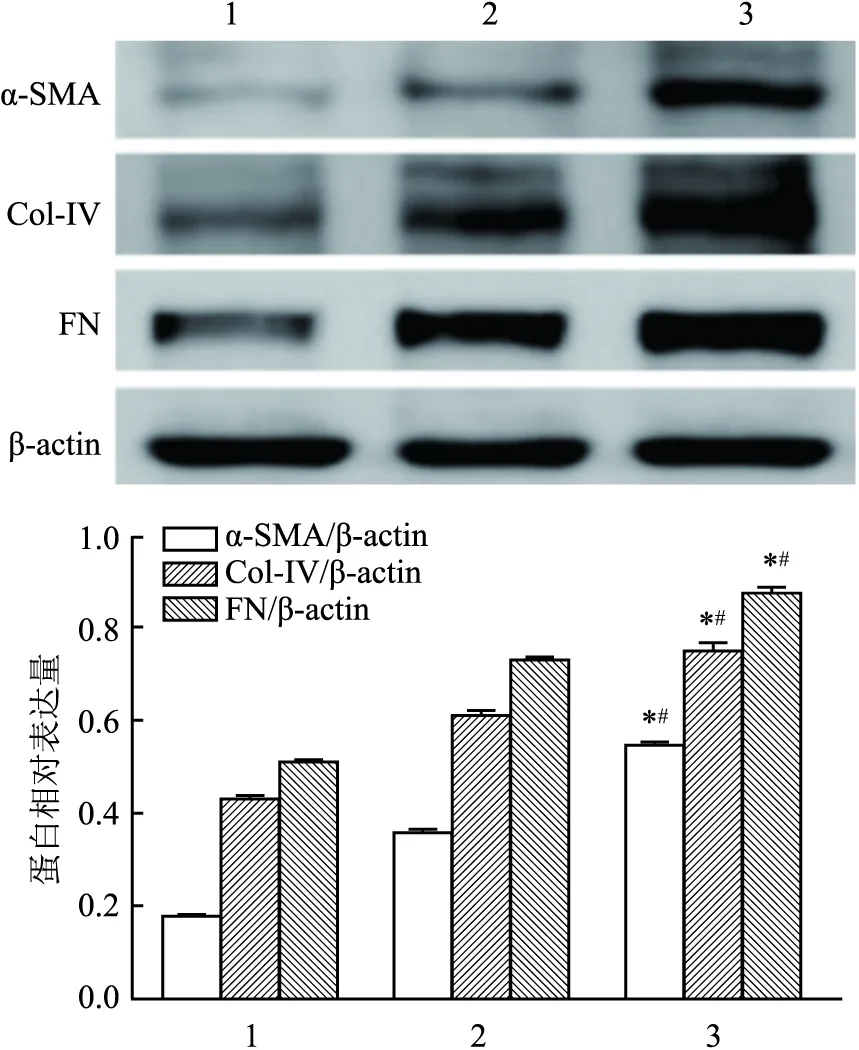
图9 高糖外泌体刺激对α-SMA、Col-IV、FN蛋白表达的影响

图10 高糖外泌体刺激对TGF-β1、IL-10、IL-6表达的影响
2.4 THP-1巨噬细胞经外泌体刺激后通路蛋白的表达Western blot结果显示,与正常组相比,高糖组THP-1巨噬细胞TGF-β1、p-Smad3蛋白表达均明显升高(F=994.23,P<0.05;F=259.96,P<0.05)。见图11。

图11 各组细胞TGF-β1/Smad3信号通路蛋白表达变化
3 讨论
肌成纤维细胞、纤维细胞和免疫细胞等被认为与DN的发展密切相关,其稳态失调可导致进行性纤维化和活肾单位的损失。肾脏巨噬细胞浸润是人类慢性肾病的共同特征,浸润程度与损伤严重程度相关。募集到受损肾脏后巨噬细胞主要分为2种不同的亚型:经典激活(M1)和选择性激活(M2)。M1型能释放IL-1、IL-6和TNF-α,被认为有促炎作用,而M2型表达精氨酸酶、甘露糖受体和IL-10,具有抗炎功能[6]。越来越多研究[6-7]提示,在肾脏纤维化进展中发挥关键作用的是M2型巨噬细胞而非M1型。先前的研究[8]表明,高糖环境下HK2来源的外泌体能在早期活化巨噬细胞,使其分化为M1型,进而引发炎症因子释放增加。而在该实验中,随着高糖外泌体刺激时间的延长,THP-1巨噬细胞CD206的荧光表达强度也逐渐增强。CD206即甘露醇受体(mannose receptor,MR)是高度可信的M2型巨噬细胞标志物,提示THP-1巨噬细胞在高糖外泌体长时间作用下可极化为M2型巨噬细胞。M2型巨噬细胞常被视为促纤维化型,在肾脏的纤维化中发挥着重要作用[6]。但M2型巨噬细胞诱导肾脏修复和再生的机制仍存在争议。
研究[2-3]证实,巨噬细胞是通过向肌成纤维细胞转化而引发肾脏纤维化的发生。近期研究[3]表明MMT的转化细胞同时表达M2型巨噬细胞的标记蛋白CD206,提示M2型巨噬细胞是发生转化的主要细胞。上述所得的M2型巨噬细胞是否发生了向肌成纤维细胞的转化。肌成纤维细胞是一种多起源的异质性细胞,是组织纤维化过程中产生过量细胞外基质(ECM)的主要来源细胞,它们表达α-SMA,分泌胶原蛋白(Col-I)和FN等ECM促进组织纤维化[9]。α-SMA是广泛认可的纤维化标志物,在DN的肾脏纤维化中有显著的表达[10]。Col-IV和FN则是肌成纤维细胞分泌的经典细胞外基质[5]。
该研究表明,经高糖外泌体作用后极化为M2型的巨噬细胞,其α-SMA、Col-IV和FN蛋白表达显著增加,证实了MMT的发生。提示外泌体可作为MMT与DN间的枢纽,为后续研究DN纤维化的阻断甚至逆转打下基础。
为初步探究该研究中外泌体在DN中诱发MMT的具体机制,该研究检测了由巨噬细胞转化而来的肌成纤维细胞中TGF-β1/Smad3通路蛋白的表达。TGF-β1是纤维化疾病的中枢调节因子,是DN肾脏纤维化的关键调节器[11]。研究[12]表明,高糖刺激巨噬细胞产生的外泌体可促使肾脏纤维化的发生,其机制可能与TGF-β1/Smad3通路相关。Smad3是TGF-β1信号经典的下游通路之一,TGF-β1/Smad3通过直接调控细胞外基质的产生和释放来促使纤维化的发生[13]。该研究向肌成纤维细胞转化后的巨噬细胞表达大量的TGF-β1,其p-Smad3/Smad3蛋白表达也明显升高。提示DN中MMT的发生可能与TGF-β1/Smad3通路的激活相关。同时该实验检测了其炎症因子的分泌,结果显示IL-10分泌量增加而IL-6降低。IL-10的代偿性表达提示机体发挥着抗炎作用,而IL-6则是经典的促炎因子,其分泌量增加常常引发炎症细胞浸润的增多[14]。研究[15]表明TGF-β1信号不仅能促进肾脏纤维化,并且能通过抑制炎症而发挥对肾脏的保护作用。
