miR-30c-2过表达联合阿霉素对甲状腺乳头状癌细胞增殖及迁移能力的影响
2022-07-13刘赫迪杨美宇于建渤
刘赫迪,杨美宇,商 杨,孙 蕾,矫 健,于建渤
(牡丹江医学院 1.病理教研室;2.附属红旗医院超声科,黑龙江 牡丹江 157011)
甲状腺癌(thyroid cancer,TC)的检出率在全世界范围内持续上升,其中乳头状甲状腺癌(papillary thyroid cancer,PTC)是最常见的亚型,总体预后较好,常见颈部淋巴结转移转移[1]。目前,由于甲状腺癌表现出广泛的临床行为,选择何种治疗手段仍是治疗甲状腺癌面临的主要问题[2]。因此,选择合适药物或掌握PTC的迁移或侵袭过程的潜在分子机制对于降低患者的肿瘤发病率及改善预后是十分重要的。阿霉素,又称多柔比星(adriamycin;doxorubicin,ADR)是一种DNA拓扑异构酶Ⅱ抑制剂,属于蒽环类抗癌药物家族,广泛用于多种肿瘤的治疗,通过阻止肿瘤细胞有丝分裂的DNA损伤抑制DNA复制和转录[3]。然而,在癌症晚期由于长期使用引起的ADR耐药,常常导致预后不良[4]。
microRNA(miRNAs)是长度约为22个核苷酸长度的短非编码RNA,已经在人类中发现了超过2500个miRNAs的生物标志物,参与肿瘤基因表达的转录后调控,许多miRNA在癌症发展和耐药性中起到关键作用[5]。miR-30家族包含五个成员和六个不同的成熟miRNA(miR-30a、-30b、-30c-1、-30c-2、30d、30e),主要发挥肿瘤抑制作用,通过对肿瘤基因和致癌途径的负性调节,引起肿瘤抑制、细胞凋亡和细胞周期阻滞[6]。在化疗和化疗耐药方面发现,上调miR-30c表达可显著降低细胞骨架基因TWF1及其下游细胞因子IL-11的表达,从而导致乳腺癌细胞对阿霉素治疗重新敏感[7]。因此,本研究选择PTC细胞TPC-1为研究对象,旨在探讨miR-30c-2联合阿霉素对TPC-1细胞增殖及迁移能力的影响,以期为PTC治疗提供新的分子靶点和思路。
1 材料和方法
1.1 细胞株和主要试剂PTC细胞TPC-1购自武汉普诺赛生命科技有限公司;RPMI 1640培养基和胎牛血清购自GIBCO公司; RNA提取试剂盒(E.Z.N.A.TM HP Total RNA Kit)购于美国Omega Bio-Tek公司;逆转录试剂盒(Transcriptor First Strand cDNA)购于美国赛默飞世尔科技公司;miRNA提取试剂盒;miR-30c-2,GAPDH引物由上海生工设计完成;CCK-8试剂盒购于上海尚宝生物科技有限公司;miR-30c-2 mimic,NC mimic及转染试剂购自广州市锐博生物科技有限公司;阿霉素购于北京索莱宝生物科技有限公司。
1.2 方法
1.2.1 细胞培养与细胞转染 将TPC-1细胞培养在RPMI 1640完全培养基(RPMI 1640培养基和胎牛血清按9∶1比例配置RPMI 1640完全培养基,另加入1×105U/L 青霉素和100 mg/L 链霉素)中,在37 ℃、5% CO2条件下培养。取对数期的TPC-1细胞分为三组,即Control组(未进行转染处理)、miR-30c-2过表达组(加入20 nM miR-30c-2 mimic转染试剂)、过表达对照组(加入20 nM NC mimic转染试剂)。在转染前1 d,对细胞株进行传代,且更换为无双抗培养基,进行细胞计数后均匀接种于6孔板中培养,待细胞汇合度约70%时,再行细胞转染。按照转染说明书进行转染,Control组细胞未转染。将6孔板置于37 ℃、体积分数5% CO2培养箱中,24 h后收集细胞进行后续实验。
1.2.2 qRT-PCR检测 使用RNA提取试剂盒从上述分组细胞中分离总RNA,测定RNA的浓度及纯度后,根据制造商的说明使用逆转录试剂盒逆转录成cDNA。利用Fast SYBRgreen PCR master mix(Roche)通过引物序列进行扩增。反应条件如下:总反应体系20 μL,95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火1 min,72 ℃延伸10 min,进行40个循环。使用7500实时荧光定量PCR系统进行定量PCR(qPCR)检测。使用Δ阈值循环(ΔΔCt)方法计算各组miR-30c-2,GAPDH的相对表达水平,以检验转染效果。用于PCR扩增的引物序列如下:miR-30c-2上游5′-CGCTGGGAGAAGGCTGTT-3′,下游5′-AGTGCAGGGTCCGAGGTATT-3′;GAPDH上游5′-TGACAAGTGTGAATCCCGTGAAG-3′,下游5′-AACCATTTCATCCGTTGTTACGAAG-3′。
1.2.3 CCK-8检测细胞增殖能力 取对数生长期的TPC-1细胞分成4组,即Control组(不加药物及转染试剂)、阿霉素组(加入0.5 nM阿霉素)、过表达组(加入20 nM miR-30c-2 mimic转染试剂)、阿霉素+miR-30c-2 mimic共处理组(加入0.5 nM阿霉素及20 nM miR-30c-2 mimic转染试剂),用胰蛋白酶消化后接种于96孔板上,于37 ℃、5% CO2培养箱中孵育,分别培养24 h、48 h后每孔加入10 μL CCK-8溶液,设置空白对照孔,放回恒温培养箱中继续培养,2 h后用酶标仪检测各孔吸光度(OD)值。
1.2.4 细胞划痕实验检测细胞迁移能力 在12孔板中培养TPC-1细胞,分别为Control组、阿霉素组、miR-30c-2 mimic组、阿霉素+miR-30c-2 mimic组,每孔种5×105个细胞,将培养板放入恒温培养箱中过夜;待细胞贴壁后,用10 μL移液器枪头对每孔划两条直线,并用PBS缓冲液冲洗两次,将细胞放入恒温培养箱中培养;于培养0 h、24 h处对每孔细胞进行拍照;利用Image J分析划痕宽度变化,划痕愈合%=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%。
1.3 统计学分析应用GraphPad Prism 8.0统计软件,计量资料以“均数±标准差”表示,采用单因素方差分析,有统计学意义再采用t检验进行两组间差异性比较,P<0.05为差异具有统计学意义。
2 结果
2.1 miR-30c-2 mimic转染后TPC-1细胞中miR-30c-2表达增高通过qRT-PCR检测,结果显示瞬时转染miR-30c-2 mimic后,miR-30c-2表达水平相比过表达对照组表达增高(P<0.001)(见表1),提示转染成功。
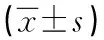
表1 转染处理后,TPC-1细胞中的miR-30c-2的mRNA表达
2.2 阿霉素、miR-30c-2 mimic及阿霉素+miR-30c-2 mimic共处理后TPC-1细胞增殖活性降低CCK-8实验于24 h及48 h结果显示,阿霉素+miR-30c-2 mimic共处理组与单独阿霉素组以及单独过表达组相比TPC-1细胞的增殖活性明显降低(均P<0.05)(见表2)。表明在TPC-1细胞中,过表达miR-30c-2可以联合阿霉素进一步抑制细胞的增殖能力。

表2 阿霉素、miR-30c-2 mimic、阿霉素+miR-30c-2 mimic共处理后细胞的存活率
2.3 阿霉素、miR-30c-2 mimic及阿霉素+miR-30c-2 mimic共处理后TPC-1细胞迁移能力降低利用细胞划痕实验检测阿霉素组、miR-30c-2 mimic组及阿霉素+miR-30c-2 mimic共处理组TPC-1细胞的迁移能力。处理24 h后进行统计分析,阿霉素+miR-30c-2 mimic共处理组与单独阿霉素组及miR-30c-2 mimic组相比,TPC-1细胞迁移能力受到进一步抑制,具有统计学意义(P<0.05)(见图3)。提示过表达miR-30c-2可以联合阿霉素进一步抑制TPC-1细胞的迁移能力。

图3 阿霉素、miR-30c-2 mimic、阿霉素+miR-30c-2 mimic共处理后细胞的迁移能力
3 讨论
甲状腺乳头状癌(PTC)是最常见的内分泌恶性肿瘤,占所有甲状腺癌的85%~90%,通常是一种惰性肿瘤,长期生存率>95%[8]。MicroRNA是一类小的非编码RNA,在调节包括癌症在内的许多生物过程和疾病中起着重要作用,可以作为癌基因或肿瘤抑制因子,被用作诊断、预后和预测性生物标志物,并开发联合miRNA的抗癌疗法,目的在于提高疗效和疾病治愈率[9]。越来越多研究表明,miRNA在PTC中发挥着重要的作用。例如,miR-625-3p通过增强AEG-1的表达并激活下游Wnt/β-catenin和JNK通路,促进甲状腺癌细胞的增殖、迁移和侵袭[10]。miR-30c-2已被证实在多种癌症中发挥肿瘤抑制作用,同时也在肿瘤耐药机制中发挥作用[11]。
化疗作为一种有效的肿瘤治疗方法,但是部分肿瘤由于多药耐药而无法得到有效治疗[12]。据文献统计,实体瘤的化疗失败率约85%,这是肿瘤复发、转移和患者临床预后差的主要原因[13]。各种分子和细胞过程,包括癌基因、肿瘤抑制物、凋亡和EMT过程与肿瘤细胞的化疗耐药性有关[14]。阿霉素是一种蒽环类药物,广泛用作各种肿瘤的抗癌剂,尽管具有广谱抗肿瘤活性,但由于长期使用带来的ADR耐药性及心脏毒性等负面作用,使得预期疗效不理想。假如能发现一种miRNA可以对阿霉素疗效有正向作用,将会为PTC的治疗提供新的思路。在乳腺癌中的研究发现,miR-30c过表达导致YWHAZ的下调,并通过p38MAPK途径产生更活跃的信号,这有助于逆转乳腺癌细胞对阿霉素的耐药性[16]。因此,在PTC中,miR-30c-2能否联合阿霉素进一步发挥对TPC-1细胞迁移和增殖的抑制作用将是重点。
本研究结果显示,通过qRT-PCR技术,将miR-30c-2 mimic转染至TPC-1细胞,观察到与Control组及NC mimic组相比,过表达miR-30c-2的mRNA表达水平明显增高(P<0.001),证明转染成功;利用CCK-8实验发现阿霉素+miR-30c-2 mimic共处理组相比Control组和单独阿霉素组细胞的增殖情况明显降低(P<0.01和P<0.05),具有统计学意义;细胞划痕实验进一步验证了阿霉素+miR-30c-2 mimic共处理组可以明显抑制细胞迁移能力(P<0.01和P<0.05)。这提示miR-30c-2可以联合阿霉素共同抑制TPC-1细胞增殖和迁移能力。
综上所述,过表达的miR-30c-2可以联合阿霉素共同抑制甲状腺乳头状癌TPC-1细胞的增殖和迁移能力,提示miR-30c-2与阿霉素的联合应用可以为PTC患者预后和治疗提供新的理论基础。
