NaOH 溶液预处理马铃薯淀粉对其微观结构影响
2022-07-13闵燕谭琼陈利维张金伟陈慧
闵燕,谭琼,陈利维,张金伟,陈慧*
(1.四川大学轻工科学与工程学院,四川成都 610065;2.四川大学制革清洁技术国家工程实验室,四川 成都 610065)
引言
淀粉以其来源广泛、价格低廉、可再生性、环境友好等优点,一直是食品、纺织、粘合剂等领域的研究热点[1-3]。淀粉是一种多聚糖天然高分子,大量的分子间和分子内氢键形成含有致密结晶的聚集态结构,导致其低温溶解度极低,进行化学改性需要在糊化后才能完成,如氧化、酯化、醚化[4-6]。
通常,多数水基化学改性需要均相溶液。因此要求进行淀粉预处理破坏淀粉分子内外的键合及聚集态结构[7-8]。均相化方法有能量辐射法[9-10]、化学溶解法[11]及水热糊化法[12]。其中,水热糊化法操作简单,是目前最常用的预处理方法[13]。但水热糊化(≥80 ℃)的淀粉降温后易出现回生,此外水热糊化过程需要能耗,还限定了高温环境,也难免出现溶解过程的副反应。因此,寻找一种低耗、高效及稳定性好的改性淀粉前驱体是淀粉改性的重要的途径。1989 年,Wootton M 等人[14]用NaOH 溶液糊化小麦淀粉来提升其黏度;近年来,本实验小组用NaOH 溶液预处理玉米淀粉,成功制备了高吸水性树脂[15]。NaOH 预处理的过程中,随着溶液NaOH 浓度、预处理时间和温度等因素变化,伴随一些不确定现象出现,包括分子链降解[16-17]。本实验利用NaOH溶液对马铃薯淀粉进行预处理,并将NaOH 预处理淀粉(STn,n代表淀粉预处理的时间分别为5、10、20、30、40 min)与水热直接糊化淀粉(HST)和马铃薯淀粉进行结晶结构、微观形貌和相对分子质量对比,以期为淀粉的改性前驱体制备提供理论指导。
1 实验部分
1.1 试剂与仪器
原淀粉(马铃薯淀粉),AR,国民淀粉化学(广东)有限公司;氢氧化钠(NaOH)、无水乙醇(质量分数≥99.7%),AR,成都金山化学试剂有限公司;盐酸(HCl,质量分数36.0%~38.0%)、二甲基亚砜(DMSO),AR,成都市科隆化学品有限公司;碘,AR,西陇化工股份有限公司。
BS124S 分析天平,德国Sartorius 公司;TD-420低速离心机,四川蜀科仪器有限公司;D8X-射线衍射仪,美国Burker 公司;Nova Nano SEM450 扫描电子显微镜,美国FEI 公司;CTO-20A 高效液相色谱仪器、RID-20 折射率检测器,日本Shimadzu 公司;W201D 恒温水浴锅、S212 恒速搅拌器,无锡申科仪器有限公司;DMLP1 偏光显微镜,德国Leica microsystem 公司;DSC214 Polyma 差示扫描量热仪,德国NETZSCH-Gerätebau GmbH 公司。
1.2 实验方法
1.2.1 淀粉预处理
用蒸馏水配制质量分数为2% NaOH 溶液,待NaOH 溶液冷却后,转移至装有机械搅拌器的三颈烧瓶中。在快速机械搅拌速度为300 r/min 下加入马铃薯淀粉,获得质量分数为10%的淀粉和NaOH 的混合溶液,并在室温下持续搅拌540 min,得到透明、均相的流动性液体。随后用1 mol/L 的HCl 溶液中和至pH7.0,用70%的乙醇溶液水提醇沉,反复洗涤至无氯离子,在45 ℃下真空干燥,获得STn。用蒸馏水代替2%NaOH 溶液,获得质量分数为10%的淀粉溶液,于80 ℃水浴锅中处理10 min,冷却至室温,用70%的乙醇溶液水提醇沉,在45 ℃下真空干燥得水热糊化淀粉,记为HST。
1.2.2 偏光显微镜(POM)观察在上述马铃薯淀粉预处理过程中,用滴管吸取不同预处理时间的淀粉糊少许,滴在载玻片上,盖上盖玻片,用滤纸吸除溢出来的样品。用DMLP1 偏光显微镜(×100)观察淀粉的“马耳他”十字,并拍摄照片[18]。
1.2.3 X 射线衍射(XRD)测定
将原淀粉、HST、STn 粉末样品置于干燥器中平衡水分后,在样品架上均匀分散,压平,用Burker D8型X- 射线衍射仪进行XRD 分析,所用波长为0.1542 nm 的单色Cu-Kα 射线。测试条件:管压40 kV,管流20 mA,扫描速度2°/min,扫描区域5°~40°,连续扫描。
1.2.4 扫描电子显微镜(SEM)观察
将原淀粉、HST、STn样品置于105 ℃的烘箱中干燥4 h,在粘有导电胶的载物台上铺洒样品,在真空下进行喷金处理,测试电压为15 kV,使用Nova Nano SEM450 扫描电子显微镜(SEM)对样品颗粒进行形貌观察拍照。
1.2.5 相对相对分子质量测定
STn 相对分子质量的测定按照Ye 和Yang 的方法[19-20],采用凝胶渗透色谱法(GPC),并略做修改。分别将STn 样品粉末溶于含(0.5%)溴化锂(LiBr)的(99.5%)二甲基亚砜(DMSO)溶液中配制成5 g/L 的混合溶液,在70 ℃条件下持续搅拌2 h 至淀粉溶解后,冷却至室温。样品溶液通过0.45 m 的聚四氟乙烯(PTFE)膜过滤,然后注入配备有RID-20 折射率(RI) 检测器的Shimadzu CTO-20A 高效液相色谱仪器中(色谱柱:WAT044205、WAT054494 色谱柱,两柱串联)。洗脱液由含有(0.5%)LiBr 的(99.5%)DMSO 溶液组成,流速0.6 mL/min,柱温维持在40℃。利用折射率(RI)检测样品的相对分子质量分布。并事先采用已知不同相对分子质量的普鲁兰和葡聚糖标准品进行校准,通过千谱hw2000(GPC 版)软件计算得到Mn、Mw及分散系数DM。
2 结果与讨论
2.1 POM 分析
用偏光显微镜观察不同用时的NaOH 预处理和水热糊化预处理过程中马铃薯淀粉晶体结构的变化,实验结果如图1 所示。

图1 不同预处理时间的POM 图(a)马铃薯淀粉、(b)ST5、(c)ST10、(d)HSTFig.1 POM images of different pretreatment time(a)Potato starch、(b)ST5、(c)ST10、(d)HST
由图1 可见,原马铃薯淀粉图1(a)的“马耳他”十字十分显著,十字较为对称。图1(b)和(c)中,用NaOH 预处理后,马铃薯淀粉的“马耳他”十字逐渐减弱,直至完全变暗。表明在NaOH 的作用下,粉颗粒结构逐渐被瓦解,当NaOH 预处理时间为10 min时,“马耳他”十字完全消失,说明淀粉溶液被均相化。而图1(d)中,80 ℃水热预处理10 min 后仍出现较为密集的“马耳他”十字,说明淀粉颗粒被破坏的不完全。由此表明,在本实验条件下,NaOH 溶液溶解马铃薯淀粉较水热糊化更有效。
2.2 XRD 分析
图2 为马铃薯淀粉(a)、HST(b)和STn(c)-(g)的XRD 谱图。原淀粉由尖峰衍射特征区域和弥散峰衍射区域组成,在衍射角2θ 为5.5°、17.2°、22.2°和23.9°处有明显的尖峰衍射特征峰,属于典型的“B”型结晶结构,表明原淀粉是由结晶区和非结晶区交替构成的半结晶结构[21]。HST 在衍射角2θ 为16.8°和19.6°处仍存在尖峰衍射特征峰,表明水热糊化法对淀粉的晶体结构破坏不完全。在STn的X射线衍射图谱中没有出现尖锐的衍射特征峰,证明利用NaOH 溶液预处理淀粉更能有效破坏淀粉内结晶结构。
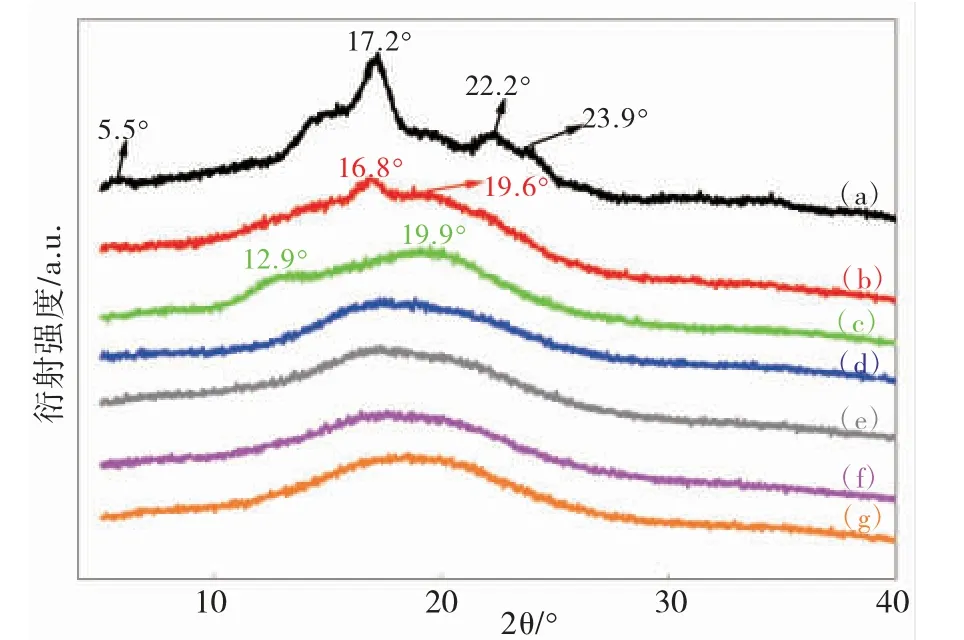
图2 不同预处理时间的XRD 图(a)马铃薯、(b)HST、(c)ST5、(d)ST10、(e)ST20、(f)ST30、(g)ST40Fig.2 XRD spectra of different pretreatment time(a)Potato starch、(b)HST、(c)ST5、(d)ST10、(e)ST20、(f)ST30、(g)ST40
ST5在衍射角2θ 为12.9°、19.9°处出现弥散特征峰,表明ST5呈现出类似的“V”型结构,原因可能是淀粉经过NaOH 溶液处理后双螺旋结构解离变成单螺旋[22],对淀粉的结晶结构破坏不够。ST10-40 的X- 射线衍射图中仅呈现出一个大的弥散特征峰,表明随着预处理时间的延长,NaOH对淀粉氢键和结晶结构破坏程度增大。在用乙醇沉淀淀粉的过程中,淀粉分子与乙醇形成了螺旋复合物(V 型复合物)[23],淀粉的结晶消失,结构趋于微观聚集态的无序化。
2.3 SEM 分析
图3 为马铃薯淀粉(a)、HST(b)和STn(c)-(g)的SEM 谱图。图3(a)中原淀粉颗粒表面光滑,呈圆形或椭圆形。图3(b)中HST 呈现出无定型块状结构,并相互粘结,原因可能是淀粉溶液干燥过程中自聚,淀粉中部分氢键重新形成并有序排列[24],出现结晶自修复(16.8°处)。

图3 不同预处理时间的SEM 图(a)马铃薯、(b)HST、(c)ST5、(d)ST10、(e)ST20、(f)ST30、(g)ST40Fig.3 SEM images of different pretreatment time(a)Potato starch、(b)HST、(c)ST5、(d)ST10、(e)ST20、(f)ST30、(g)ST40
图3(c)~(g)中马铃薯淀粉颗粒形态被破坏,形成更大尺寸的无规粘结体。表面出现大量孔洞凝胶化现象,这说明原淀粉在经过NaOH 溶液预处理过程中其分子间凝聚作用发生了显著的变化。并且随着预处理时间的延长,STn的胶化结构的现象越明显。原因是氢氧根离子(OH-)更容易被淀粉吸引,淀粉分子中羟基(-OH)的质子被OH-电离而带上负电荷,由于电荷之间的排斥作用,淀粉分子溶胀,原结构彻底崩塌,HCl 中和过程中产生分子间作用改变,聚集态重构趋于微观聚集态的无序化。
2.4 相对相对分子质量分析
利用GPC 测定NaOH 溶液预处理后淀粉的相对分子质量参数是证实淀粉在预处理过程中是否发生降解和降解程度的重要指标。STn的凝胶渗透色谱图如图4 所示,GPC 谱图中均含有一个肩峰(A峰)和两个宽峰(B 峰和C 峰)。这三个峰分别代表着不同的相对分子质量范围,A、B 和C 峰分别对应相对较高、中和较低的相对分子质量。由图4 可知,随着预处理时间的增加,A 峰值逐渐下降,且位置不断向右移动。此外,B 和C 的峰值呈现出增加趋势,表明较高相对分子质量的淀粉分子链被降解为较低相对分子质量[25]。
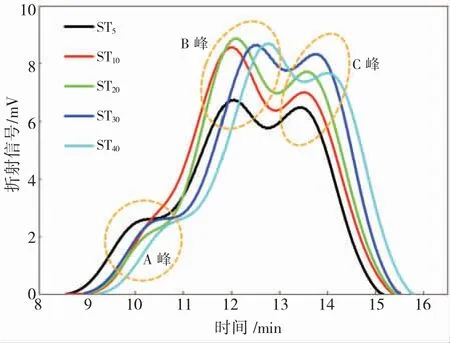
图4 不同预处理时间的CPC 图Fig. 4 GPC curves of different pretreatment time
STn的重均相对分子质量(Mw)、数均相对分子质量(Mn)和相对分子质量分布宽度(DM)列于表1中。马铃薯淀粉经过NaOH 处理后Mw从123.44×104(ST5)减少到96.68×104(ST40),Mn从14.64×104(ST5)减少到9.61×104(ST40),同时DM 值增加,而通过GPC 的测定知马铃薯淀粉的重均相对分子质量为129.48×104。表明NaOH 溶液对淀粉进行预处理的过程中,淀粉的形态和结晶结构在静电作用下被破坏的同时,也促进了淀粉分子微观结构和分子链的解聚和分散,导致了淀粉分子的降解。并且随着预处理时间的延长,低相对分子质量的淀粉链段增加,淀粉分子的降解程度增大,因此NaOH 溶液预处理的时间不宜过长。故为了增强预处理过程中淀粉的溶解度并控制淀粉分子的降解,最佳的预处理时间为10 min。
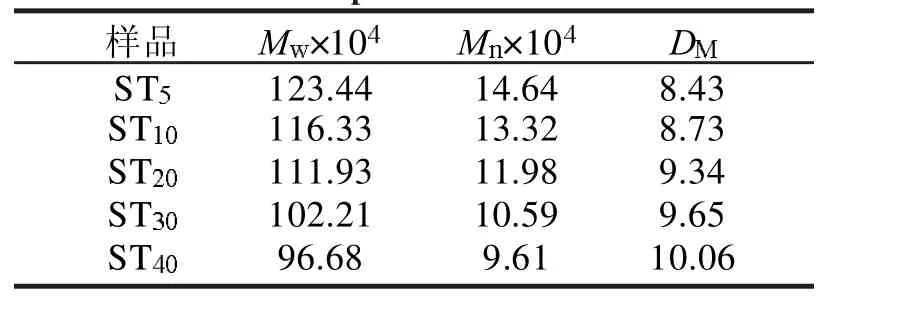
表1 不同预处理时间下淀粉的相对分子质量参数Tab. 1 Molecular weight parameters of STn obtained at different pretreatment time
综上,推测NaOH 溶液在淀粉预处理过程中的可能作用机理如图5 所示:NaOH 预处理过程中,当淀粉与高浓度的NaOH 接触时,OH-容易被淀粉吸引,淀粉分子中羟基的质子被电离而带上负电荷,在带负电荷淀粉分子的静电排斥作用下淀粉分子开始溶胀,当溶胀程度进一步增大时,淀粉分子间和分子内氢键被破坏,双螺旋结构断裂,半结晶结构崩塌,聚集态重构趋于微观聚集态的无序化,无法显示出结晶结构,淀粉表面呈现大量凹陷和孔洞使其溶解度增加[26-27]。
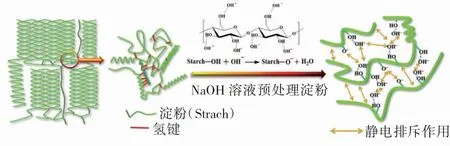
图5 NaOH 溶液预处理淀粉过程中的作用机理图Fig.5 Action mechanism of the NaOH pretreatment on starch
3 结论
通过POM 观察表明,当NaOH 预处理时间达10 min 后,“马耳他”十字完全消失,淀粉溶液被均相化,淀粉完全溶解;通过XRD、SEM 分析发现,经NaOH 溶液预处理过后,马铃薯淀粉的晶型结构和微观形貌发生较大改变:STn的结晶结构由“B”型结晶变为“V”型,马铃薯淀粉颗粒形态被破坏,表面出现大量孔洞凝胶化现象;GPC 结果显示,随着预处理时间的延长,原淀粉的Mw从原淀粉的129.48×104g/mol 减少到ST4的96.68×104g/mol,故预处理时间为10 min 时可达最佳效果,此时淀粉的微观结构被有效破坏,溶解度最大,降解程度较小。NaOH溶液对淀粉的预处理工艺可以弥补水热糊化预处理淀粉易回生的不足,改善变性淀粉制备过程中低效、耗能等缺点,降低变性淀粉的生产成本。该方法有望为淀粉的改性前驱体制备提供理论指导。
