乳酸脱氢酶对晚期食管鳞状细胞癌免疫治疗的预后价值研究
2022-07-12李艳王昆仑杨晖赵二江李炳旭李胜磊董小滔袁翎
李艳,王昆仑,杨晖,赵二江,李炳旭,李胜磊,董小滔,袁翎*
食管癌(esophagual cancer,EC)是常见的癌症之一[1]。我国是EC高发地区,约90%的EC为食管鳞状细胞癌(esophageal squamous carcinoma,ESCC),且大多数ESCC患者会经历疾病复发或局部进展[2-3],由于本病早期症状多为非特异性,因此近一半的患者在确诊时已属于中晚期[4]。晚期ESCC患者通常采用疗效有限的化疗方案治疗,但患者的中位生存期<10个月[5-8],5年生存率<5%,预后较差[9]。因此晚期ESCC迫切需要更有效的治疗方案。近年来免疫治疗尤其是免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的应用已改变了晚期ESCC的治疗情况,目前程序性细胞死亡蛋白1(programmed death-1,PD-1)抑制剂在治疗晚期ESCC中取得了巨大突破,成为一种重要的晚期ESCC治疗药物。
晚期ESCC患者可从ICIs中获益。一项Ⅲ期临床试验结果显示,与化疗相比,PD-1抑制剂作为二线治疗为晚期ESCC患者提供了更具临床意义的总体生存益处[10]。然而并非所有患者均能从免疫治疗中获益,因此疗效预测很重要。而在ESCC中,预测PD-1抑制剂治疗疗效可靠的外周血生物标志物尚未确定。乳酸脱氢酶(lactic dehydrogenase,LDH)升高已被证实可预测多种恶性肿瘤的不良预后,如胰腺癌、小细胞肺癌、黑色素瘤等[11-13]。有研究证实较高的LDH水平在肿瘤的代谢、增殖、侵袭和转移中发挥着重要作用,且高LDH水平癌症患者的总生存率较低[14-17]。目前关于LDH对ICIs治疗晚期ESCC患者的预后作用却少见报道。本研究主要探讨接受PD-1抑制剂免疫治疗的晚期ESCC患者的基线LDH、治疗早期LDH的变化与患者近期疗效的关系及基线LDH与患者远期预后的关系,为临床提供帮助。
1 资料与方法
1.1 一般资料 选取2016年10月至2019年10月在河南省肿瘤医院经病理及影像学检查确诊为晚期ESCC的患者为研究对象。纳入标准:(1)病理检查证实为晚期ESCC;(2)临床分期为Ⅳ期;(3)以PD-1抑制剂作为二线治疗药物;(4)临床资料完整;(5)美国东部肿瘤协作组(ECOG)评分为0或1分。排除标准:(1)同时或既往被诊断患有其他器官恶性肿瘤;(2)全身性自身免疫性疾病;(3)既往使用PD-1抑制剂、程序性细胞死亡蛋白配体1(PD-L1)或PD-L2药物。本研究经河南省肿瘤医院伦理委员会批准,审批编号:2018085。
1.2 方法 从医院电子病历系统中回顾性收集患者的年龄、性别、病变部位、是否有吸烟史(吸烟5年及以上,每天至少3支,未戒烟或戒烟时间<1个月)、肿瘤分化程度、既往治疗方案(包括手术治疗和放射治疗)、转移累及器官数。
收集患者首次行免疫治疗前1周内的血液学检查结果,以获得LDH、血清白蛋白、血红蛋白、淋巴细胞计数、单核细胞计数水平。免疫治疗第8周进行第1次影像学评估,同时进行血液学检查,并收集免疫治疗第8周LDH水平。
1.3 观察指标 随访截至2021-08-31,记录随访结果。观察死亡情况、患者疾病缓解情况,并记录无进展生存期(progress-free survival,PFS)和总生存期(overall survival,OS)。
根据相关参考文献[18-19],将患者分为基线LDH低水平(基线LDH<200 U/L)、基线LDH高水平(基线LDH≥200 U/L),分析其疾病缓解情况。
治疗过程中LDH的变化定义为ΔLDH,ΔLDH=免疫治疗第8周LDH水平-基线LDH水平。
1.4 相关定义 采用电子计算机断层扫描(CT)等放射学方法评估疾病缓解情况。按照世界卫生组织(WHO)实体瘤反应评价标准1.1版(RECIST 1.1)进行疾病进展评估,分为完全缓解(complete response,CR):所有(非淋巴结的)靶病灶消失,全部病理淋巴结短轴缩小至<10 mm;部分缓解(partial response,PR):所有靶病灶的长径总和低于基线≥30%;病情稳定(stable disease,SD):肿瘤病灶缩小不超过50%并持续至少2个月;病情进展(progressive disease,PD):肿瘤垂直两直径的和较最低值增加20%,或出现新的肿瘤或可评价的疾病有明显的进展。客观缓解率(objective response rate,ORR)即CR+PR。
PFS定义从使用PD-1抑制剂免疫治疗初始日期到进展的时间或者发生任何原因死亡的时间。
OS定义为从使用PD-1抑制剂初始治疗日期到任何原因死亡的时间。
1.5 统计学方法 采用SPSS 25.0软件进行统计学分析。符合正态分布的计量资料以(±s)表示,两组间比较采用两独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示;计数资料以相对数表示,组间比较采用χ2检验;采用Kaplan-Meier法绘制不同基线LDH水平患者PFS、OS生存曲线以进行生存分析,生存曲线的比较采用Log-rank检验;晚期ESCC患者预后的影响因素分析采用单因素、多因素Cox比例风险回归分析。将单因素Cox比例风险回归分析时P<0.1的因素及临床上认为与之相关的其他重要因素均纳入多因素Cox比例风险回归分析中,其中血清白蛋白[20](40 g/L)、血红蛋白[21](130 g/L)、淋巴细胞计数[22](1.39×109/L)、单核细胞计数[23](0.39×109/L)参考相关研究进行二分类变量转化。双侧检验水准α=0.05。
2 结果
2.1 患者一般资料 76例晚期ESCC患者中,3例失访,29例免疫治疗第8周无血液检查结果,最终44例患者纳入研究。44例患者中基线LDH低水平者28例,基线LDH高水平者16例。总体患者及不同基线LDH水平患者基线资料详见表1。

表1 总体患者及不同基线LDH水平患者基线资料Table 1 Baseline characteristics analysis of ESCC participants after immunotherapy on the whole and by baseline LDH level
2.2 基线LDH低水平与基线LDH高水平患者预后情况比较 基线LDH低水平的患者ORR高于基线LDH高水平患者,差异有统计学意义(χ2=8.522,P=0.013),见表2。

表2 基线LDH低水平与基线LDH高水平患者预后情况〔n(%)〕Table 2 Prognosis of ESCC patients with low and high baseline LDH levels
2.3 PD患者和无PD患者ΔLDH情况比较 PD患者平均ΔLDH为(23.82±31.10)U/L,无PD患者平均ΔLDH为(-2.74±27.80)U/L;PD患者ΔLDH高于无PD患者,差异有统计学意义(t=2.394,P=0.021)。
2.4 生存分析 截至2021-08-31,9例(20.5%)患者存活;中位PFS为6(2,11)个月;中位OS为11(7,18)个月。绘制不同基线LDH水平患者PFS、OS生存曲线,详见图1~2。基线LDH低水平与基线LDH高水平患者PFS、OS比较,差异均有统计学意义(χ2值分别为6.790、12.327,P值分别为0.009、<0.001)。

图1 基线LDH低水平与基线LDH高水平患者PFS生存曲线Figure 1 Progression-free survival curves of ESCC patients with low and high baseline LDH

图2 基线LDH低水平与基线LDH高水平患者OS生存曲线Figure 2 Overall survival curves of ESCC patients with low and high baseline LDH
2.5 晚期ESCC患者免疫治疗后PFS、OS影响因素的单因素、多因素Cox比例风险回归分析 以晚期ESCC患者免疫治疗后PFS、OS分别为因变量(赋值:实测值),以基线资料为自变量(赋值见表3),进行单因素Cox比例风险回归分析,结果显示,基线LDH水平是晚期ESCC患者免疫治疗后PFS、OS的影响因素(P<0.05),见表4。
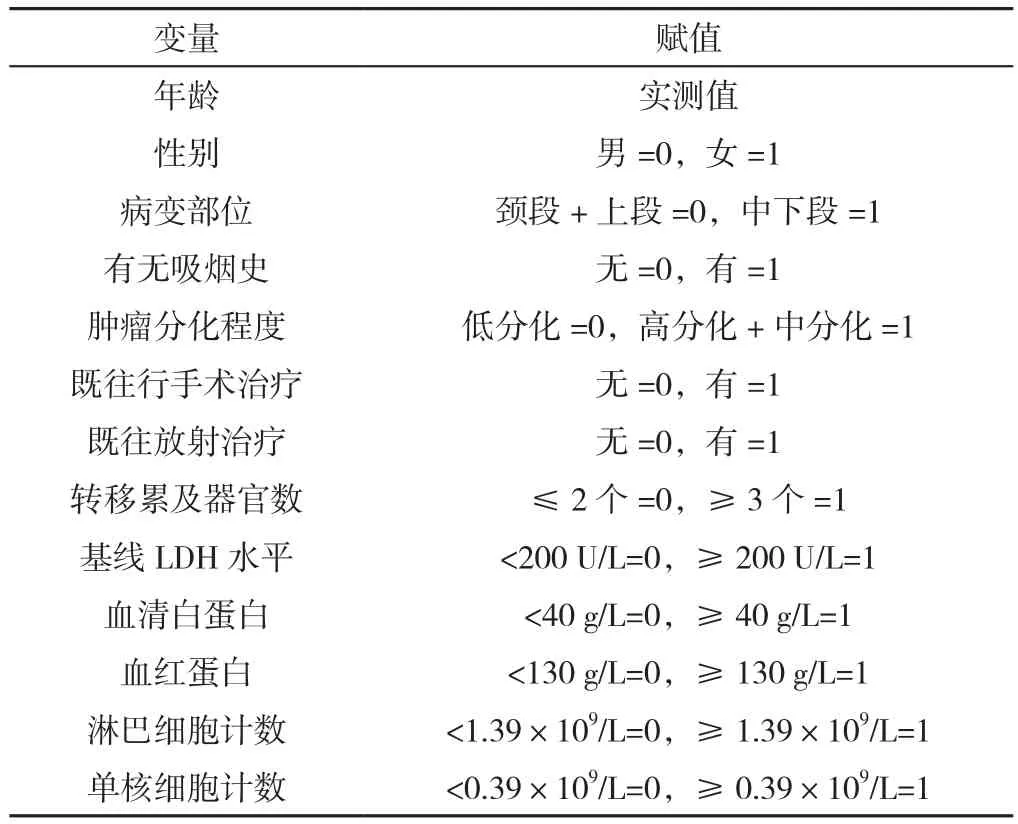
表3 晚期ESCC患者免疫治疗后预后影响因素单因素和多因素Cox比例风险回归分析变量赋值Table 3 Variable assignment for potential factors associated with prognosis in patients with advanced ESCC after immunotherapy analyzed using univariate and multivariate Cox regression

表4 晚期ESCC患者免疫治疗后PFS、OS影响因素的单因素Cox比例风险回归分析Table 4 Univariate Cox regression analysis of influencing factors of progression-free survival and overall survival in patients with advanced ESCC after immunotherapy
研究显示,临床多认为患者的年龄、病变部位、转移累及器官数、血红蛋白、淋巴细胞计数、单核细胞计数也与PFS、OS相关[20-23],故将上述因素与单因素Cox比例风险回归分析中P<0.1的因素共同作为自变量(赋值见表3),以晚期ESCC患者免疫治疗后PFS、OS分别为因变量,进行多因素Cox比例风险回归分析,结果显示,基线LDH水平是晚期ESCC患者免疫治疗后PFS的影响因素〔B=0.988,SE=0.381,Wald χ2=6.735,P=0.009,HR=2.686,95%CI(1.274,5.664)〕;基线LDH水平、血红蛋白、单核细胞计数是晚期ESCC患者免疫治疗后OS的影响因素(P<0.05),见表5。

表5 晚期ESCC患者免疫治疗后OS影响因素的多因素Cox比例风险回归分析Table 5 Multivariate Cox regression analysis of influencing factors of overall survivalin patients with advanced ESCC after immunotherapy
3 讨论
本研究结果显示,基线LDH水平是晚期ESCC免疫治疗后OS、PFS的独立影响因素。血清LDH水平可作为肿瘤患者预后的预测指标的原因可能为:从代谢角度看,不管氧气是否充足,肿瘤细胞均会优先进行糖酵解来提供能量,葡萄糖代谢至丙酮酸后不再通过线粒体的三羧酸循环进行有氧氧化,而是通过LDH转变成乳酸,即“Warburg effect”[24]。LDH是糖酵解过程中丙酮酸转化成乳酸的催化剂,因此随肿瘤细胞的糖酵解增强,LDH水平也会升高。另外,LDH被认为是组织破裂的指标,在癌症患者中,由于癌细胞的增殖能力较强,其生存周期会缩短,因此坏死风险增加;此外,邻近的正常组织也会受到癌细胞的侵犯和破坏[11,25],例如肺、肝和骨骼,这些器官的损伤也会引起LDH水平升高。也有研究表明,高LDH水平可能导致乳酸的产生和细胞外水空间酸化,这有助于增加癌细胞的侵袭能力[26]。因此,通过上述结论,可以认为LDH是由快速生长的肿瘤细胞释放的,是与肿瘤负荷相关的“管家酶”,且LDH与肿瘤的侵袭、转移密切相关。所有这些机制可能共同促进了癌症患者血清LDH水平的升高,使其可能成为肿瘤预测的标志物之一。
PD-1是一种跨膜蛋白,是细胞表面受体CD28家族中的一员,常表达于激活后的T细胞、B细胞、NK细胞、单核细胞和巨噬细胞等,是一种负性共刺激受体[27-29]。PD-1通过与B7家族的两种配体PD-L1和PD-L2相互作用,抑制T细胞增殖和细胞因子生成,下调免疫反应,降低T细胞消除肿瘤细胞的能力,诱导效应T细胞衰竭等;PD-L1可在癌细胞表面表达,癌细胞利用PD-1/PD-L1相互作用的功能效应来抑制激活的T细胞对肿瘤的免疫监视[27-28,30]。PD-1抑制剂通过阻断PD-1与PD-L1的相互作用,恢复T淋巴细胞的抗肿瘤活性,增强免疫应答,从而降低肿瘤细胞的增殖及转移率[31]。
关于LDH预测其他晚期癌症的疗效及患者生存期的研究在其他研究中也有报道。如DE JONG等[32]回顾性分析了593例接受一线化疗的晚期非小细胞肺癌(non-small-cell lung cancer,NSCLC)患者,结果表明LDH的降低,特别是在治疗早期时,其与放射反应显著相关,基线时LDH高水平及治疗时LDH水平升高均与较低的总生存率显著相关。SHIBUTANI等[33]回顾性分析了91例不能行切除术的转移性结直肠癌行免疫治疗的患者,结果显示LDH水平较低的患者PFS明显优于LDH水平较高的患者。LDH升高在转移性黑色素瘤患者中也是生存期不佳的预后指标[33-34]。本研究结果与上述研究一致。本研究结果显示,基线LDH低水平与基线LDH高水平患者PFS、OS比较,差异有统计学意义。既往研究大多只关注LDH的基线值,很少有研究关注LDH在治疗过程中的变化是否与治疗反应相关。本研究结果不仅表明基线时LDH低水平与更好的PFS、OS相关,也与较好的近期临床疗效有关。
研究发现LDH与近期疗效的相关性在临床治疗中具有重要的意义,临床医生在评估ICIs治疗晚期ESCC疾病的进展及预后时,经常遇到放射学证实病情进展的患者伴有益的临床反应和表现评分,也就是放射学中假进展的现象[35-36],这种情况下临床医生将面临是否继续免疫治疗的抉择,LDH水平对近期疗效的评估作用可以减少临床医生的判断失误。有研究表明,血清白蛋白与癌症患者的生存率相关,可作为治疗的预后标志物[37]。但本研究并未观察到血清白蛋白与晚期ESCC患者PFS或OS的相关性。而单核细胞计数可以作为预测晚期ESCC患者PFS的原因是单核细胞计数可能具有促肿瘤作用,其可以通过分泌白介素(IL)-10将中性粒细胞召集到肿瘤微环境,达到免疫抑制的作用[38];单核细胞也可促进血管生成,从而导致癌症迅速恶化[39],已有研究证实其在肿瘤预测中的作用[40]。据报道,血红蛋白水平可预测癌症患者的不良预后[41]。低血红蛋白水平可导致血氧供应下降和肿瘤细胞缺氧,而缺氧可导致肿瘤细胞对化疗药物和放射治疗不敏感,从而导致局部区域控制较差[42]。
本研究尚存在一定的局限性:(1)关于近期疗效本研究只分析了基线LDH及治疗早期LDH的变化与治疗疗效的相关性,需要进一步的研究来确定8周后LDH水平的变化与疗效的关系是否有改变,应进行长期随访;(2)本研究为单中心回顾性研究;(3)纳入患者的数量相对较少,随访时间不够。
综上所述,LDH在监测免疫治疗对晚期ESCC患者的效果方面发挥着一定作用,且通过简单的血液检测即可获得这一检验指标,具有快速、廉价、方便的临床应用优势,因此值得推广。
作者贡献:李艳、杨晖、袁翎负责研究设计,并对研究的可行性及数据进行了分析;李艳收集数据、绘制图表,并撰写论文及校正;王昆仑、杨晖、赵二江负责文章的质量控制及审校;李炳旭、李胜磊、董小滔对文章进行结果的分析与解释;袁翎对文章整体负责,监督管理。所有作者均已审阅并认可论文。
本文无利益冲突。
