髂动脉分支支架拓展应用保留单侧髂内动脉的可行性与安全性
2022-07-12黄玉龙黄国强符伟国王利新卢伟锋洪翔洪诗钗陈刚陈艺辉林越谢新胜
黄玉龙,黄国强,符伟国,3,王利新,3,卢伟锋,洪翔,洪诗钗,陈刚,陈艺辉,林越,谢新胜
(复旦大学附属中山医院厦门医院 1.血管外科 2.放射科,福建厦门 361015;3.复旦大学附属中山医院血管外科,上海 200030)
主-髂动脉瘤占腹主动脉瘤(abdominal aortic aneurysm,AAA)的40%,其中合并髂总动脉瘤(common iliac artery aneurysm,CIAA)70%~90%,合并髂内动脉瘤(internal iliac artery aneurysm,IIAA)占0~30%[1]。单侧IIAA 结扎后可不予动脉重建,而双侧IIAA 则需谨慎处理。双侧髂内动脉(internal iliac artery,IIA)栓塞,可导致缺血相关并发症发生[2]。2020年欧洲血管外科学会(European Society for Vascular Surgery,ESVS)指南[3]推荐,腹主动脉瘤腔内修复(endovascular abdominal aortic aneurysm repair,EVAR)治疗时至少应保留一侧髂内动脉[3-4]。目前,多种方式应用于保留IIA,包括“三明治”技术、“喇叭口”技术、“翻山烟囱”技术、髂动脉分支支架(iliac branch device,IBD)技术等,研究[2,5-8]证实IBD 具有较高的技术成功率及较低的并发症发生率,逐渐成为保留IIA 的首选方式。商业化的IBD 因个体化解剖差异而应用受限,其中IIA 的直径是主要的解剖限制因素[1,9]。尤其对于合并双侧IIAA 的患者,IIA 无法绝对满足IBD 应用要求,成为至少保留单侧IIA 的难点。本研究旨在探讨如何拓展IBD 适应证用于治疗合并双侧IIAA患者,观察其早期疗效。
1 资料与方法
1.1 一般资料
1.1.1 患者资料回顾性分析复旦大学附属中山医院厦门医院血管外科2021年4月—2021年6月拓展应用G-iliacTMIBD 保留单侧IIA 3 例患者的临床资料。纳入标准:超出IFU 要求IIA 最大直径11.4 mm,其余以G-iliacTMIBD使用说明(illustration for use,IFU)为标准:⑴髂总动脉(common iliac artery,CIA)近端直径≥10 mm;⑵远端髂外动脉(external iliac artery,EIA)直径8.4~14.5 mm;⑶远端EIA 锚定区长度≥15 mm;⑷CIA 分叉处开口直径≥18 mm;⑸IIA 夹角≤90°。
1.1.2 手术材料G-iliacTMIBD 系统(先健科技有限公司,中国)由覆膜支架和输送器组成。IBD 由PET 覆膜和可置入人体的弹性金属材料组成。在释放过程中,IBD 能够提供足够而平稳的扩张力将覆膜张开,支架主体近端和长分支远端会与血管壁贴附。
1.2 治疗方案
1.2.1 术前准备术前7 d 内行CT 血管造影(computed tomography angiography,CTA),扫描范围:由主动脉弓-股总动脉,获得1、3、5 mm 断层影像及重建图像,测量获得腹主动脉(Abdominal Aorta,AA)、双侧CIA、EIA、IIA 最大直径及管腔有效直径(表1)。余包括血常规、凝血及纤溶指标、电解质、肝肾功能、传染病等检验,心电图、胸部CT、肺功能、心脏彩超及穿刺点彩超等检查。
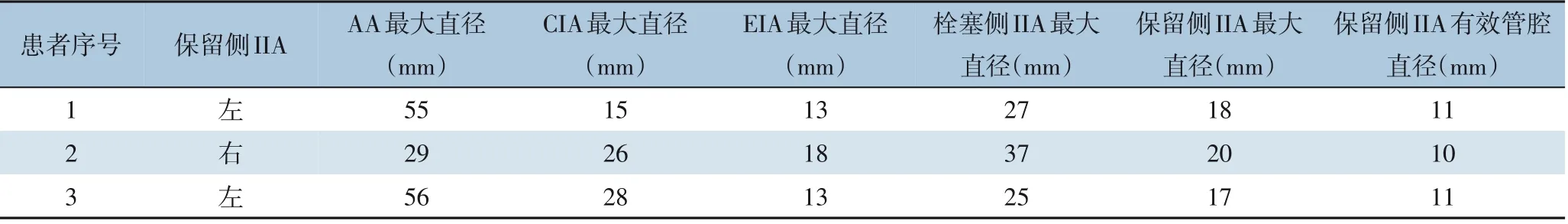
表1 患者CTA数据Table 1 CTA data of patients
1.2.2 手术操作(保留单侧IIA 手术过程)经保留侧股动脉穿刺点导入G-iliacTMIBD,IBD 支架近段桥接腹主动脉主体支架长分支远端,两者重叠3 cm,将IBD IIA 分支开口定位于EIA 及IIA 分叉上方0.5 cm处释放,经左侧肱动脉穿刺点导入MPA 导管(Cordis Corporation,美国)及0.035 Inch 导丝(TERUMO Corporation,日本),导丝选入IBD 短分支开口,选入IIA 主干远端,交换MPA 导管留置于IIA 主干远端,交换Supracore 导丝(Abbott Vascular,美国)及9 F-70 cm 长鞘,经鞘导入覆膜支架[Lifestream(Clearstream Technologies Ltd,爱尔兰)或Silver Flow(先健科技有限公司,中国)]且该支架近端与IBD 短分支重叠1 cm 释放,行IIA 支架内后扩,造影确认IIA 通畅性。
1.3 术后处理及随访指标
1.3.1 术后治疗术后口服阿司匹林100 mg/d 及阿托伐他汀20 mg/晚,控制血压、心率,随访常规血象指标。
1.3.2 结局指标及随访主要观察指标:技术成功率,30 d 内支架通畅率,内漏发生率,缺血并发症(臀肌跛行、性功能障啊、肠缺血、脊髓缺血)。次要观察指标:30 d 内病死率,心梗、脑梗、动脉栓塞等并发症;出院前及术后1、3、6 个月,然后每年1 次随访CTA 观察上述指标。
2 结果
2.1 临床资料
3 例患者均为男性,年龄66~70 岁;3 例主-髂动脉瘤患者均合并双侧CIAA、IIAA,其中1 例合并双侧股总动脉瘤(common femoral artery aneurysm,CFAA)。3 例患者的基本临床资料见表2。
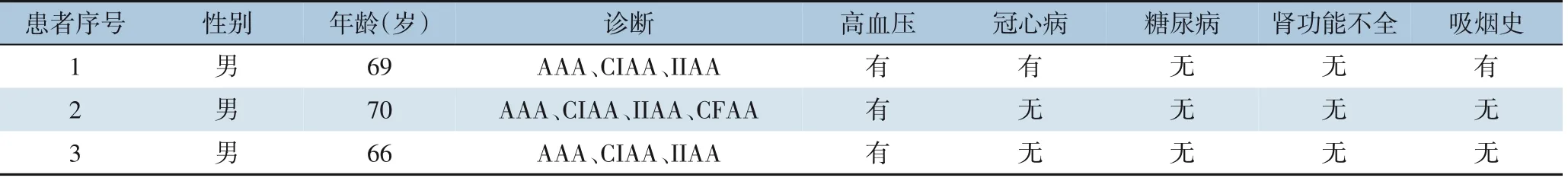
表2 3例患者的临床资料Table 2 Clinical date of 3 cases
2.2 手术情况
2.2.1 患者1保留左侧IIA,同期行EVAR+左侧IIA 重建+右侧IIA 弹簧圈栓塞,先行经左侧股动脉穿刺点翻山行右侧IIA 栓塞后行EVAR+左侧IIA 重建,选用G-iliacTM(14 mm/10 mm/100 mm/70 mm)+Lifestream(12 mm/58 mm)组合重建IIA,少量保留侧IIA 来源Ib 型内漏,行球囊后扩后内漏消失(图1)。
2.2.2 患者2保留右侧IIA,因合并AAA 及双侧CIAA、IIAA、CFAA,一期行EVAR+左侧IIA 栓塞+左侧CFAA 人工血管置换,二期行右侧IIA 重建,选用G-iliacTM(14 mm/12 mm/60 mm/150 mm)+Lifestream(10 mm/38 mm)组合重建IIA,三期行右侧CFAA 人工血管置换术(图2)。
2.2.3 患者3保留左侧IIA,同期行EVAR+左侧IIA 重建+右侧IIA 弹簧圈栓塞,考虑左侧IIA 开口狭窄性病变,导丝通过病变困难,成功行EVAR+左侧IIA 重建后,经肱动脉穿刺点行右侧IIA 栓塞,选用G-iliacTM(14 mm/12 mm/60 mm/130 mm)+Silver Flow(12 mm/80 mm)组合重建IIA,合并IIA 开口狭窄行支架内后扩,残余狭窄<10%(图3)。
2.3 结果及随访
应用IBD 技术成功率100%,30 d 内无支架移位、断裂等支架相关并发症发生,通畅率100%。患者1 术中出现保留侧IIA 来源Ib 型内漏,后扩消失,患者3 术中出现肠系膜下动脉来源少量I 型内漏,随访观察,术后3 d 出现左侧大腿疼痛,CTA检查发现保留侧IIA 远端分支来源假性动脉瘤,行弹簧圈栓塞术;无缺血性并发症发生,30 d 内无死亡、心梗、脑梗、动脉栓塞等重大并发症发生。随访时间3~6 个月,平均(4±1.4)个月,患者2 术后复查见栓塞侧IIA 来源II 型内漏,术后3 个月随访消失,患者3 术后3 个月复查肠系膜下动脉(IMA)来源II 型内漏,较出院前无明显变化,拟择日进一步栓塞(表3)。

表3 手术及随访数据Table 3 Surgical variables and follow-up data
3 讨论
对于AAA 合并CIAA 患者,通过计划性栓塞IIA 和延长髂支支架锚定于EIA 完成[10-11]。然而IIA栓塞导致多种临床缺血性症状,轻型缺血症状如臀肌跛行、勃起功能障碍,严重的并发症如肠缺血、脊髓缺血等[12]。研究报道,双侧的IIA 闭塞导致的缺血性症状明显增加[13-16],其中臀肌跛行发生率高达42%[17],因此EVAR 治疗时应避免双侧IIA栓塞,至少保留一侧[18]。多种腔内治疗及杂交技术逐步发展,IBD 逐渐成为AAA 合并髂动脉瘤(iliac artery aneurysm,IAA)保留IIA 首要腔内治疗方式,可有效隔绝CIAA,有效保证IIA 正向血流灌注。对于IBD 应用的文献报道越来越多,证实其可行性,技术的安全性,较低的内漏发生率及二次干预率[19-20]。多种人类解剖的个体化差异,并不能完全符合IFU 使用要求,Karthikesalingam 等[21]报道如果严格按照IFU,60%的患者将因至少一个解剖因素受限无法应用IBD。多种解剖因素中IIA 是应用受限的最主要因素,如IIA 直径、主干短、严重钙化,瘤样变等,其中以瘤样变最常见[6,9,22-24]。瘤样扩张的IIA 主干无足够的桥接支架锚定区,为避免双侧IIA 栓塞引起的并发症,有研究指出可扩大IBD 应用范围,拓展其在合并双侧IIAA 中的应用。Jerkku 等[19]认为由于髂内动脉瘤解剖形态特殊,在应用IBD 行IIA 重建时需要改进的腔内治疗策略延长IIA 远端锚区以获得好的密封效果,既可有效隔绝IIAA,同时保证IIA 血流灌注。Donas等[25]进行的一项多中心研究中,30%的患者超IFU应用IBD(IIA>12 mm),在IIA 重建时,与使用多枚覆膜支架桥接相比,使用单一覆盖支架的IBD 伴随臀部跛行、I 型内漏、分支狭窄或血栓形成的发生率明显更高。研究认为在IIA 主干或其分支的远端延长锚定区,可优化IBD 应用效果。但文章中并没有具体描述应用多枚支架的指征,也未对远端锚定区部位做具体统计分类。Noel-Lamy 等[26]认为,在合并IIA 瘤样扩张的患者中,重建IBD 分支时,可多枚支架桥接,远端支架锚定于臀上动脉(superior gluteal artery,SGA),同时将其上>5 mm 的IIA 分支栓塞安全可行[27](图4)。
多枚支架桥接延长锚定区至SGA 时,IBD 内分支近段采用球扩式覆膜支架,远端采用自膨式覆膜支架于IIA 远端,直接间重叠2~3 cm,桥接支架间内衬自膨式裸支架加强过渡区稳定性,可获得良好的中期通畅率,Austermann[28]等纳入16 例主髂动脉瘤合并IIAA 应用IBD 患者,IIA 分支采用多枚支架桥接延长锚定区,其初级通畅率达95.3%,辅助通畅率100%。同时可有效减少臀肌跛行并发症及III 型内漏的发生[25,28]。但多枚支架桥接应用存在支架间扭结及脱节的风险,多次更换导丝、导管等复杂手术过程操作[26]。针对IIA 选用多枚支架延长锚定区策略存在的弊端,我们采用不同的方法拓展IBD 应用,以期获得理想的治疗效果,既可有效保留瘤样扩张的IIA,同时避免多枚支架桥接方案的潜在风险。本研究纳入的3 例患者,均合并双侧IIA 瘤样扩张,选择保留一侧相对扩张小、附壁血栓少且有一段健康有效管径的IIA。3 例保留侧IIA 扩张最大处17~20 mm,平均直径(18.3±1.2)mm,超出常规应用G-iliacTMIBD的IIA 直径要求(5~11.4 mm)。尽管所保留的一侧IIA 均存在不同程度瘤样变,但IIA 主干仍有一段直径<12 mm 的正常有效管腔,术中将IBD 分支桥接支架锚定于此段,近段与IBD 短分支部分重叠,局部有效锚定于此相对较细髂内主干处,远端锚定于瘤样扩张近段,避免突入瘤体(图5)。
考虑保留侧IIA 局部瘤体最大处相对IIA-E 侧,短期破裂风险并不高,进行定期随访,一旦发现明显增大可行进一步桥接分支支架覆盖瘤体或进行瘤体栓塞。由于IIA 解剖迂曲,在选用桥接支架时应考虑较好的顺应性,还应考虑其径向支撑力及定位的精确性,Viabahn(W.L.Gore &Associates,美国)因其较好的顺应性为众多研究推荐[29-30],本研究纳入的患者,其IIA 主干不同程度的瘤样扩展,Viabahn 无法较好地与瘤样扩张段有效密封,内漏风险大。本研究患者1、2 中,保留侧IIA 开口距IIAA 间仍有一短段相对健康的IIA主干锚定区,尽管IIA 主干扩张,本研究选用了国内新上市的Lifestream 支架,其汇集了新型球扩式覆膜支架的优势,其后扩可放大特性,可使其远端后扩后呈喇叭口样扩张,有效加强远端锚定的密封性(图6)。
本研究中,患者1Lifestream 释放后见Ib 型内漏,远端选用直径14 mm 的球囊后扩,使其后扩后放大更贴附远端血管壁,术后及随访过程均未见内漏发生。在短期随访时间内,IBD 及IIA 分支支架通畅,均未出现支架内闭塞、移位、断裂等支架相关并发症。患者2 出现栓塞侧IIA 来源II 型内漏,术后3 个月内漏消失,患者3 出现IMA 来源II 型内漏,无IBD 及保留侧IIA 原因引起的内漏发生。
本研究采用IIA 短分支支架局部锚定于IIA 近段主干最细处及选用Lifestream 利用其远端后扩放大特性,作为桥接支架的拓展技巧可有效保留单侧IIA;结合文献分析,多枚支架桥接将分支支架远端锚定于IIA 分支主干,锚定区内分枝栓塞以保留IIA,可同时有效保护IIA 血流和修复IIAA;综上所述,多种拓展IBD 应用策略,为合并双侧IIAA患者行EVAR 治疗时保留单侧IIA 提供了选择。研究纳入的3 例患者,手术均取得成功,结果令人满意。但因患者例数少,随访时间短,无法进一步行统计学分析。
针对个体化差异采用合适拓展策略应用IBD治疗合并双侧IIAA 保留单侧IIA 可行且短期效果满意,需更多的患者及更长时间随访数据证实其临床适用性。
利益冲突:所有作者均声明不存在利益冲突。
