LncRNA EIF3J-AS1通过靶向调控miR-597-5p对胃癌细胞增殖、周期分布和凋亡的实验研究
2022-07-12张丽媛郭舒静伊雪石莺
张丽媛,郭舒静,伊雪,石莺
胃癌是我国居民中常见恶性肿瘤,据统计2019年中国胃癌新增病例达61.28万例,死亡病例42.15万例[1]。虽然以手术为基础的综合治疗策略取得了很大进展,但胃癌早期诊断率较低,多数患者在确诊时已处于晚期,现有治疗策略的有效性仍不令人满意[2-4]。近年研究揭示了长链非编码RNA(LncRNA)异常表达和缺失在人类癌症进展中的重要作用,LncRNA可与miRNA特异性结合,抑制其生物学功能,上调靶基因表达,从而影响肿瘤细胞基本生物学行为,参与癌症的发生发展[5-9]。研究指出,LncRNA真核细胞翻译起始因子3J反义RNA1(EIF3J-AS1)在肝癌中表达上调,通过检测LncRNA EIF3J-AS1等6中LncRNA表达对肝癌患者无复发生存期具有预测价值[10]。结直肠癌中LncRNA EIF3J-AS1高表达提示预后较差,沉默LncRNA EIF3J-AS1可促进结肠癌细胞凋亡,抑制细胞增殖[11]。靶基因预测显示miR-597-5p是LncRNA EIF3J-AS1的潜在靶点。已有研究指出miR-597-5p可与circ101555直接结合,沉默circ101555通过上调miR-597-5p表达显著抑制结肠癌细胞增殖和DNA修复能力,并诱导细胞凋亡[12]。然而,目前LncRNA EIF3J-AS1、miR-597-5p在胃癌中的表达情况,LncRNA EIF3J-AS1是否靶向miR-597-5p调控胃癌进展未见报道。本研究从细胞增殖、周期分布、细胞凋亡角度分析LncRNA EIF3J-AS1、miR-597-5p在胃癌进展中的作用,探讨LncRNA EIF3J-AS1对miR-597-5p的靶向调控作用,旨在为胃癌的早期诊断、分子靶向治疗提供潜在靶标。
1 材料和方法
1.1 材料和试剂
收集2019年1月至2019年12月在我院行手术治疗的37例胃癌患者[男21例,女16例,年龄30~75岁,平均年龄(51.25±4.21)岁]的癌组织和癌旁组织标本。组织离体后,迅速置于液氮中冷冻,后保存在-80 ℃冰箱。入组患者术前均未接受抗肿瘤治疗。本研究经我院伦理委员会批准,并获得所有患者知情同意。
人胃癌组织用液氮在研钵内研磨组织,直至粉末状,1 mL Trizol试剂加入可裂解细胞;胃癌细胞系(SNU-1、AGS、HS-746T)、人胃黏膜细胞GES1购自中国科学院上海细胞库;si-LncRNA EIF3J-AS1、si-NC、miR-NC、miR-597-5p mimics、pcDNA、pcDNA-LncRNA EIF3J-AS1、anti-miR-597-5p、anti-miR-NC、重组荧光素酶报告载体购自上海汉恒生物公司;SYBR Premix EX Taq试剂盒、PrimeScript逆转录试剂盒购自大连宝生物公司;miScript Ⅱ逆转录试剂盒、miScript SYBR Green PCR试剂盒购自德国Qiagen公司;CCK-8试剂盒、Cleaved-caspase-3兔多克隆抗体(ab2302)、β-actin兔多克隆抗体(ab8227)购自美国Abcam公司;Annexin-V-FITC凋亡检测试剂盒购自南京凯基生物公司;CytoFLEX S流式细胞仪为贝克曼库尔特公司。
1.2 方法
1.2.1 RT-qPCR检测LncRNA EIF3J-AS1、miR-597-5p表达
TRIzol法分析组织样本、胃癌细胞系、GES1细胞的总RNA。随后,分别用miScript逆转录试剂盒、PrimeScript逆转录试剂盒合成LncRNA、miRNA的cDNA。再用miScript SYBR Green PCR试剂盒、SYBR Premix EX Taq试剂盒进行RT-qPCR以检测LncRNA EIF3J-AS1、miR-597-5p表达。采用2-ΔΔCt法计算基因表达的变化。EI3J-AS1上游引物5′-GCC ACA ATG ATA CAG GTT-3′,下游引物5′-GCC AGT GAC CTG TCC ACC C-3′;β-actin上游引物5′-CGT GAC ATT AAG GAG AAG CTG-3′,下游引物5′-CTA GAA GCA TTT GCG GTG GAC-3′;miR597-5p上游引物5′-UGU GUC ACU CGA UGA CCA CUG U3′,下游引物5′-AGU GGU CAU CGA GUG ACA CAU U-3′;U6上游引物5′-CTC GCT TCG GCA GCA CAT ATA CT-3′,下游引物5′-ACG CTT CAC GAA TTT GCG TGT C-3′。
1.2.2 转染和实验分组
用不含血清的细胞培养液稀释40 nM的寡核苷酸或2 μg质粒,室温孵育5 min(A液)。同时,用不含血清的细胞培养液稀释5 μL的lipofectamine 2000,室温孵育5 min(B液)。将A液与B液混合,室温孵育20 min(C液)。将2×104个对数期SNU-1细胞接种24孔板,将C液加入60%融合细胞中进行转染。在转染48 h时用RT-qPCR检测基因表达的抑制或促进效果。未转染的SNU-1细胞记为对照组;转染si-LncRNA EIF3J-AS1、si-NC、miR-NC、miR-597-5p mimics、pcDNA、pcDNA-LncRNA EIF3J-AS1、si-LncRNA EIF3J-AS1与anti-miR-NC、si-LncRNA EIF3J-AS1与anti-miR-597-5p的细胞,分别记为si-LncRNA EIF3J-AS1组、si-NC组、miR-NC组、miR-597-5p组、pcDNA组、pcDNA-LncRNA EIF3J-AS1组、si-LncRNA EIF3J-AS1+anti-miR-NC组、si-LncRNA EIF3J-AS1+anti-miR-597-5p组。
1.2.3 流式细胞术检测细胞周期分布和凋亡
凋亡检测:PBS洗涤转染细胞2次,加入500 μL的1×结合缓冲液(含5 μL Annexin-V-FITC和5 μL碘化丙啶)在室温下避光孵育15 min。1 h内上流式细胞仪检测细胞凋亡情况。
周期检测:PBS洗涤转染细胞2次,向细胞悬液中加入预冷70%酒精4 ℃固定过夜。离心除去乙醇,PBS清洗1次,在离心管中留500 μL的PBS,吹散细胞团,加入RNase A工作液,室温避光孵育30 min。离心,用PBS清洗1次,再次离心,加入碘化丙啶,室温避光孵育30 min。混匀,过300目网筛,置于流式管中,4 ℃冰箱保存,待测。流式细胞仪检测细胞周期,Flowjo软件分析数据并导出结果。
1.2.4 CCK-8法检测细胞活力
转染的细胞按照每孔100 μL(3×103个)接种96孔板,孵育48 h后,加入十分之一体积的CCK-8试剂在37 ℃培养箱孵育2 h。用酶标仪在450 nm处检测光密度(OD)值来反映细胞活力。
1.2.5 Western blot检测Cleaved-caspase-3蛋白表达
裂解转染的细胞提取总蛋白,设定电压100 V、时间90 min进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,按照电流300 mA、时间30 min进行转膜。将膜置于5%脱脂牛奶中封闭2 h,再与一抗在4 ℃下孵育12 h。一抗如下:Cleaved-caspase-3抗体1∶1 500、内参β-actin抗体。然后酶标二抗稀释2 000倍,室温孵育膜1.5 h。化学发光法显影、定影。Image J软件分析Cleaved-caspase-3相对于β-actin条带灰度值以反映其蛋白表达水平。
1.2.6 双荧光素酶报告基因实验
合成包含miR-597-5p结合区域的野生型EIF3J-AS1片段,同时合成不含上述结合区域的突变型EIF3J-AS1片段,将其分别插入pmirGLO荧光素酶载体。将获得荧光素酶报告基因载体WT-EIF3J-AS1和MUT-EIF3J-AS1分别与miR-597-5p mimics、miR-NC共转染SNU-1细胞48 h后,测定细胞相对荧光素酶活性值。
1.3 统计学方法
2 结果
2.1 LncRNA EIF3J-AS1和miR-597-5p在胃癌组织、细胞中表达情况
胃癌组织中LncRNA EIF3J-AS1表达水平与癌旁组织比较显著升高(2.23±0.25vs1.00±0.15,t=25.662,P<0.05),miR-597-5p表达水平与癌旁组织比较显著降低(0.45±0.06vs1.00±0.12,t=24.936,P<0.05)。胃癌细胞系SNU-1、AGS、HS-746T中LncRNA EIF3J-AS1表达水平与人胃黏膜细胞GES1比较显著升高(2.43±0.21,2.05±0.17,1.82±0.14vs1.00±0.10,F=128.339,P<0.05),miR-597-5p表达水平与GES1细胞比较显著降低(0.40±0.04,0.48±0.03,0.53±0.04vs1.00±0.08,F=250.600,P<0.05),选择表达差异较大的SNU-1细胞进行功能实验。
2.2 沉默LncRNA EIF3J-AS1对SNU-1细胞增殖、周期分布、凋亡的影响
si-LncRNA EIF3J-AS1组细胞LncRNA EIF3J-AS1表达水平显著低于NC组(P<0.05),表明转染si-LncRNA EIF3J-AS1能够抑制LncRNA EIF3J-AS1表达。与NC组比较,si-LncRNA EIF3J-AS1组细胞Cleaved-caspase-3蛋白表达、G0/G1期细胞比例、凋亡率显著升高(P<0.05),细胞活力、S期细胞比例显著降低P<0.05)。见图1、表1。
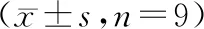
表1 沉默LncRNA EIF3J-AS1对SNU-1细胞增殖、周期分布、凋亡以及Cleaved-caspase-3蛋白表达的影响
图1 沉默LncRNA EIF3J-AS1对SNU-1细胞周期分布、凋亡以及Cleaved-caspase-3蛋白表达的影响 A:流式细胞仪检测细胞周期;B:流式细胞仪检测细胞凋亡;C:Western Blot检测Cleaved-caspase-3蛋白表达水平
2.2 过表达miR-597-5p对SNU-1细胞增殖、周期分布和凋亡的影响
miR-597-5p组SNU-1细胞miR-597-5p表达水平显著高于miR-NC组(P<0.05),提示转染miR-597-5p mimics可促进miR-597-5p表达。与miR-NC组比较,miR-597-5p组SNU-1细胞Cleaved-caspase-3蛋白表达、G0/G1期细胞比例、凋亡率显著升高(P<0.05),细胞活力、S期细胞比例显著降低(P<0.05)。见图2、表2。
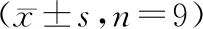
表2 过表达miR-597-5p对SNU-1细胞增殖、周期分布和凋亡的影响
图2 过表达miR-597-5p对SNU-1细胞周期分布、凋亡以及Cleaved-caspase-3蛋白表达的影响 A:流式细胞仪检测细胞周期;B:流式细胞仪检测细胞凋亡;C:Western Blot检测Cleaved-caspase-3蛋白表达水平
2.4 LncRNA EIF3J-AS1靶向调控miR-597-5p表达
LncBase Predicted v.2预测到miR-597-5p与LncRNA EIF3J-AS1存在特异性结合位点,见图3。过表达miR-597-5p可降低转染WT-EIF3J-AS1的相对荧光素酶活性(P<0.05),见表3。转染si-LncRNA EIF3J-AS1沉默LncRNA EIF3J-AS1表达后SNU-1细胞miR-597-5p表达水平显著升高(P<0.05);转染pcDNA-LncRNA EIF3J-AS1上调LncRNA EIF3J-AS1表达后SNU-1细胞miR-597-5p表达水平显著降低(P<0.05),见表4。
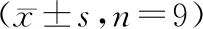
表3 双荧光素酶报告实验
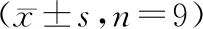
表4 RT-qPCR检测miR-597-5p的表达
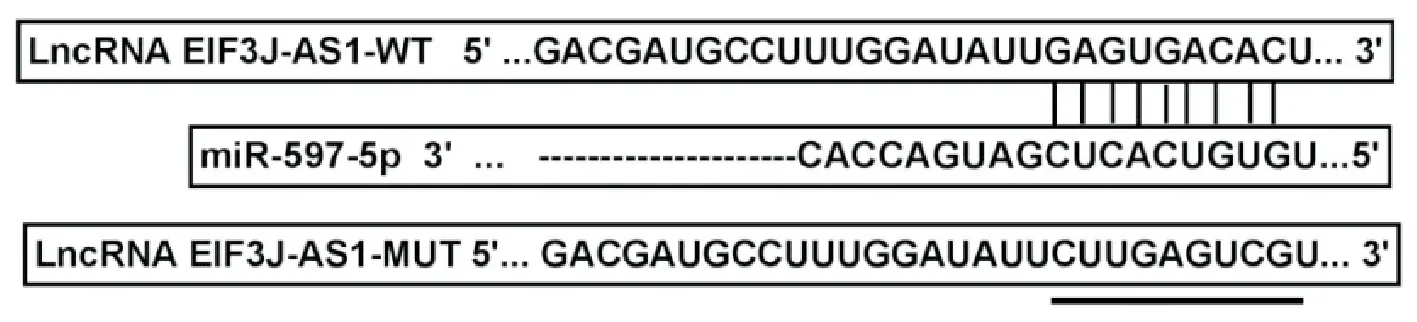
图3 miR-597-5p和LncRNA EIF3J-AS1结合示意图
2.5 抑制miR-597-5p表达可逆转沉默LncRNA EIF3J-AS1对SNU-1细胞增殖、周期分布和凋亡的影响
与si-LncRNA EIF3J-AS1+anti-miR-NC组比较,si-LncRNA EIF3J-AS1+anti-miR-597-5p组SNU-1细胞miR-597-5p表达水平、Cleaved-caspase-3蛋白表达、G0/G1期细胞比例、凋亡率显著降低P<0.05),细胞活力、S期细胞比例显著升高(P<0.05)。见图4、表5。
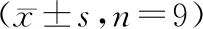
表5 抑制miR-597-5p表达可逆转沉默LncRNA EIF3J-AS1对SNU-1增殖、周期分布、凋亡的影响
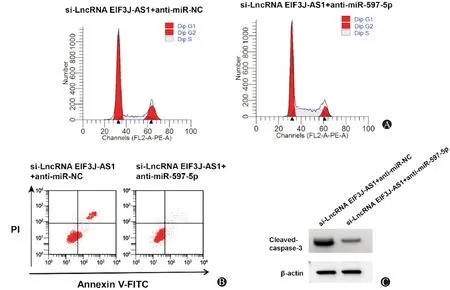
图4 抑制miR-597-5p表达可逆转沉默LncRNA EIF3J-AS1对SNU-1周期分布、凋亡、Cleaved-caspase-3蛋白表达的影响 A:流式细胞仪检测细胞周期;B:流式细胞仪检测细胞凋亡;C:Western Blot检测Cleaved-caspase-3蛋白表达水平
3 讨论
LncRNA不仅参与细胞的增殖、凋亡、转移,还与肿瘤大小、浸润程度、淋巴结转移及患者预后相关,是胃癌治疗有吸引力的分子靶点[13-17]。Wei等[18]人指出LncRNA HOX转录反义RNA(HOTAIR)通过下调miR-1277-5p表达、上调V型胶原蛋白α1表达促进胃癌的生长和转移,LncRNA HOTAIR高表达预示胃癌患者预后不良。Hu等[19]发现LINC00641表达上调与奥沙利铂耐药有关,下调LINC00641通过改变胃癌细胞自噬参与调节奥沙利铂耐药。Chen等[20]报道LINC01234表达增加与胃癌转移、更短生存时间相关,沉默LINC00641可诱导胃癌细胞凋亡和生长阻滞,并抑制裸鼠异种移植瘤形成。本研究检测到LncRNA EIF3J-AS1在胃癌组织和细胞中高表达,并通过体外实验证实沉默LncRNA EIF3J-AS1可抑制胃癌细胞活力,阻滞细胞周期,激活Cleaved-caspase-3,诱导细胞凋亡。LncRNA EIF3J-AS1在肝癌中表达上调,其表达水平与肿瘤大小、血管浸润和肿瘤分期等预后特征相关,敲低LncRNA EIF3J-AS1可抑制缺氧诱导的肝癌细胞增殖和转移[21]。沉默LncRNA EIF3J-AS1通过上调miR-1343-3p表达显著抑制胶质瘤的恶性表型[22],这与本研究中沉默LncRNA EIF3J-AS1的抗癌作用相似。LncRNA EIF3J-AS1还通过抑制miR-373-3p/ 蛋白激酶B1(AKT1)轴参与调控食管癌细胞生长和转移进程,在食管癌中发挥致癌作用,并可能作为食管癌患者预后生物标志物和潜在治疗靶点[23]。以上研究表明LncRNA EIF3J-AS1在胃癌扮演致癌基因角色,沉默LncRNA EIF3J-AS1通过抑制细胞增殖、阻滞细胞周期、诱导细胞凋亡来阻碍胃癌进展。
据报道miR-597-5p是胰腺癌的抑癌因子,miR-597-5p通过靶向下调转录因子ELK1显著抑制胰腺癌细胞活力和克隆能力,增加细胞凋亡水平[24]。在结肠癌中miR-597-5p能够影响上皮-间充质转化标志物的表达以及体外迁移和侵袭能力,抑制结肠癌转移[25]。在肝癌中miR-597-5p表达下调,miR-597-5p可通过靶向调控TEAD1 抑制肝癌细胞增殖、迁移和侵袭[26]。 本研究检测到胃癌组织、细胞中miR-597-5p表达均显著降低,过表达miR-597-5p可激活Cleaved-caspase-3,降低胃癌细胞活力,阻滞细胞周期,诱导细胞凋亡。双荧光素酶报告实验显示miR-597-5p为LncRNA EIF3J-AS1的直接靶点。RT-qPCR检测证实,在胃癌细胞中miR-597-5p表达受到LncRNA EIF3J-AS1的负性调控。过表达miR-597-5p和沉默LncRNA EIF3J-AS1在胃癌中的抗肿瘤作用相似,这提示沉默LncRNA EIF3J-AS1的功能是由miR-597-5p表达增加介导的。为证实上述猜想,本研究将si-LncRNA EIF3J-AS1、anti-miR-597-5p共转染胃癌细胞,结果显示抑制miR-597-5p表达可拮抗沉默LncRNA EIF3J-AS1对胃癌细胞活力、周期分布和凋亡的影响,这表明LncRNA EIF3J-AS1靶向miR-597-5p参与胃癌进展。然而,目前的研究仍存在不足之处。例如,LncRNA EIF3J-AS1/miR-597-5p轴的下游靶点和信号通路尚待阐明。此外,还需要通过体内实验和更多的细胞功能实验进一步验证实验结果。
总之,胃癌中LncRNA EIF3J-AS1表达升高,miR-597-5p表达降低。沉默LncRNA EIF3J-AS1通过上调miR-597-5p表达可抑制胃癌细胞增殖,阻碍细胞周期进展,诱导细胞凋亡。这些发现将有助于深入了解胃进展的分子机制,为临床胃癌治疗提供新的分子靶点。
