桉树无性系BL1号的组织培养技术研究
2022-07-11甘德煜吕明灿彭新荣杨福超王秋惠刘精华
甘德煜,吕明灿,彭新荣,杨福超,王秋惠,刘精华
桉树无性系BL1号的组织培养技术研究
甘德煜,吕明灿,彭新荣,杨福超,王秋惠,刘精华
(广西国有博白林场,广西 博白 537617)
以广西国有博白林场林科所选育的桉树无性系BL1号优株带芽茎段为外植体进行组培快繁技术体系研究。阐述了桉树无性系BL1号快速繁殖的过程,通过外植体的采集、消毒、诱导、扩繁、生根、移栽等阶段,培养出完整的植株。结果表明:晴天+纯净水冲洗30 min+0.15%HgCl2(3+7)min为外植体消毒最佳处理方案。在改良的MS培养基添加VC15.0 mg·L-1能有效控制外植体褐变,不同褐化剂对外植体的影响效果为:VC>Cys>Na2S2O3>CK。改良MS+BA 1.0 mg·L-1+KT 0.2 mg·L-1+NAA 0.05 mg·L-1是继代培养的最适培养基。改良MS+BA0.5 mg·L-1+NAA 0.08 mg·L-1+KT 0.02 mg·L-1是生根有效芽繁殖最适培养基。改良MS+BA 0.25 mg·L-1+NAA 0.1 mg·L-1+IBA0.6 mg·L-1是生根最适培养基。
桉树无性系;尾叶桉BL1号;组织培养
桉树()研究从“六五”开始首次被列入国家科技攻关计划,历时40余年科技创新研究,促进了我国桉树全产业链的快速发展[1-2]。目前,全国桉树年产木材超过4 000万m3,桉树产业全产业链总产值超过4 000亿元[3]。天然林保护工程实施后,我国木材供需缺口不断扩大,桉树的发展,提高了我国木材产出能力,维护了我国生态安全和木材安全[4]。林木种苗是林业建设的基础和前提,林业要发展,种苗是关键[5]。为进一步做好我国的森林种苗建设,推动我国林业持续快速健康发展,必须高度重视森林种苗培育工作[6]。研究结果表明,用组培苗造林在投入产出及林木生长量上优于扦插苗造林,桉树组织培养技术已成为桉树繁殖的重要手段[7-8],但影响桉树组培快繁的因子复杂多变,如何解决其中的技术问题已成了桉树优良无性系推广应用的关键[9-10]。
广西博白林场于1997年从东门林场引进尾叶桉()种子园的种子苗并营造了15.3 hm2纯林。2013年博白林场林科所选出树高27 m、平均胸径25.9 cm、枝下高18.3 m的优良单株,编号为桉树无性系BL1号。经过博白林场和周边地区种植试验表明,桉树无性系BL1号生长快、干形好、适应性强、经济价值高,发展前景良好。以往一般采用种子繁殖的方法进行育苗,阻碍了桉树无性系BL1号扩大种植的速度和优良遗传品质的保持,而利用离体组培快繁技术培育出完整植株,可在短时间内大量提供性状稳定的幼苗,为桉树无性系BL1号的高效快繁和规模化生产提供技术支持。本研究对桉树无性系BL1号的外植体消毒、降低外植体褐化率、提高诱导增殖系数、提高生根有效芽系数和幼苗生根率等方面进行探索,以期找出适宜的组织培养技术,为相关生产和科研单位提供参考依据。
1 材料与方法
1.1 试验材料
对桉树无性系BL1号在距离地面30 cm处进行环割催芽,当芽条长至30 ~ 40 cm时,在晴天午后选取洁净、无病虫害的健壮芽条进行采集,剪取萌条生长能力较强的顶芽茎段作为外植体,用干净并经过消毒的湿毛巾保湿带回组培室内进行处理。
1.2 试验方法
1.2.1 外植体消毒
将采集回来的外植体置于1 000倍退菌特溶液中浸泡15 min后用纯净水冲洗干净表面尘埃,去除叶片保留叶柄及腋芽,用去离子水洗5 ~ 6次,置于超净工作台上,然后用75%乙醇消毒25 min,再用 HgCl2处理10 min、(5+5) min、(3+7) min、(2+8) min进行消毒效果对比,期间轻轻摇动使消毒均匀,再用无菌水清洗3次。消毒后选取萌芽条半木质化部分,切成至少带一节眼1.5 ~ 2 cm长的茎段,用无菌滤纸吸干水分,剪掉茎段两端被药物损伤部分,接种于准备好的培养基中。
1.2.2 诱导培养
基本培养基选用MS固体培养基,适当调整大量元素N、P、K的比例和增加不同浓度的细胞分裂素及生长素、2%蔗糖和0.5%卡拉胶,pH值5.8 ~ 6.8。诱导培养基配比选用BA、NAA和KT 3种植物生长调节剂(下称激素),3种浓度,每个处理3个重复,每个重复25瓶,每瓶1个外植体,具体试验设计见表1。接种后先暗培养15 d,30 d时统计外植体污染率、褐化率、萌芽率。计算方法如下:污染率/%=污染数/接种总数,褐化率/%=褐化数/接种总数,萌芽率/%=萌发数/接种总数。
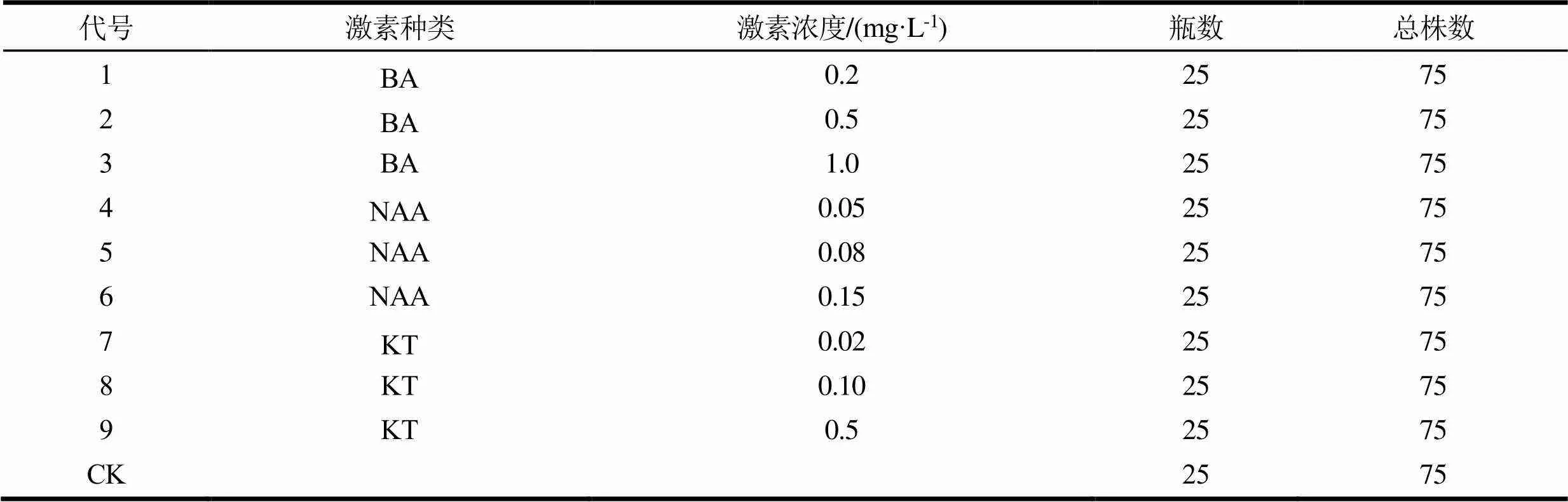
表1 外植体消毒和接种培养试验设计表
1.2.3 继代培养
采用正交设计对最佳继代培养基进行筛选,将诱导培养获得的丛生芽腋芽长至0.5 ~ 1 cm时,及时切下并转入增殖培养基上,每隔20 ~ 30 d,转移材料一次,每处理25瓶,每瓶1个外植体,重复3次。培养10 d后统计增殖系数与生根有效芽系数。增殖系数=新芽总数/接种芽总数,生根有效芽系数=生根芽(苗高0.5 cm以上)总数/接种芽总数。
1.2.4 生根培养
选用5种生根培养基,每个处理5瓶,3个重复,每瓶20株,培养35 d观察苗生长状况和统计生根率。生根率=生根苗(根长0.3 cm以上)数/接种总数。5种生根培养基为:MS+BA0.25 mg·L-1+NAA0.1 mg·L-1+IBA0.2 mg·L-1、MS+BA0.25 mg·L-1+NAA0.1 mg·L-1+IBA0.4 mg·L-1、MS+BA0.25 mg·L-1+NAA0.1 mg·L-1+IBA0.6 mg·L-1、MS+BA0.25 mg·L-1+NAA0.1 mg·L-1+IBA0.8 mg·L-1、MS+BA0.25 mg·L-1+NAA0.1 mg·L-1+IBA1.0 mg·L-1。
1.2.5 不同抗褐化剂对芽褐化的影响
以改良MS为基本培养基,通过添加抗褐化剂来降低外植体培养的褐化率。其种类和浓度各有3种:(1)半胱氨酸(Cys):100 mg·L-1、200 mg·L-1、300 mg·L-1;(2)抗坏血酸(VC):5 mg·L-1、10 mg·L-1、15 mg·L-1;(3)硫代硫酸钠(Na2S2O3):100 mg·L-1、200 mg·L-1、300 mg·L-1;(4)对照(CK)。每处理25瓶,每瓶1个外植体,重复3次。培养15 d、30 d时观察褐化程度及芽生长状况,统计褐化率。褐化率/%=褐化数/接种数。
1.3 培养条件
接种后暗光培养7 ~ 10 d。发生褐变时,要将外植体转移到新的培养基上。培养温度25 ℃,湿度75% ~ 85%,光照时间12 ~ 14 h·d-1,光照度1 500 ~ 2 000 Lux,如遇到连续阴雨天气,可用高压汞灯照明以补充光源。注意保持室内环境干净且经严格消毒。
1.4 数据处理
试验数据以EXCEL 2010和SPSS 26统计软件进行处理。
2 结果与分析
2.1 不同消毒处理对外植体的影响
HgCl2消毒时间和消毒方式对外植体消毒产生不同影响(表2)。接种12 d后侧芽出现萌动,茎段切口明显膨大,但未见愈伤组织。分两次消毒在污染率和褐化率的控制上均明显好于一次性消毒,且随消毒时间的延长,污染率降低,褐化率升高。综合污染率、褐化率、萌芽率,纯净水冲洗30 min+0.15%HgCl2(3+7)min为外植体消毒最佳处理方法。
2.2 不同植物生长调节剂组合对诱导继代培养增殖的影响
以改良MS为基本培养基,添加BA、NAA和KT 3种激素的不同浓度组合进行继代增殖培养和生根有效芽培养,对其生长调节剂组合进行筛选,结果见表3。由表4可知,BA对增殖系数及生根有效芽数的影响均达到了显著水平,NAA和KT对其影响不显著,说明BA是桉树无性系BL1号增殖的主导因子。从增殖系数来看,处理8、9显著高于其他处理;结合表5结果可知,增殖系数最高的处理8,即改良MS+BA 1.0 mg·L-1+KT 0.2 mg·L-1+NAA 0.05 mg·L-1是诱导继代繁殖的最适培养基。从生根有效芽系数来看,处理4、5显著高于其他处理,结合极差分析(表5)可知,生根有效芽系数最高的处理4,即改良MS+BA 0.5 mg·L-1+NAA 0.08 mg·L-1+KT 0.02 mg·L-1是生根有效芽繁殖的最适培养基。

表2 不同消毒处理对外植体和诱导的影响
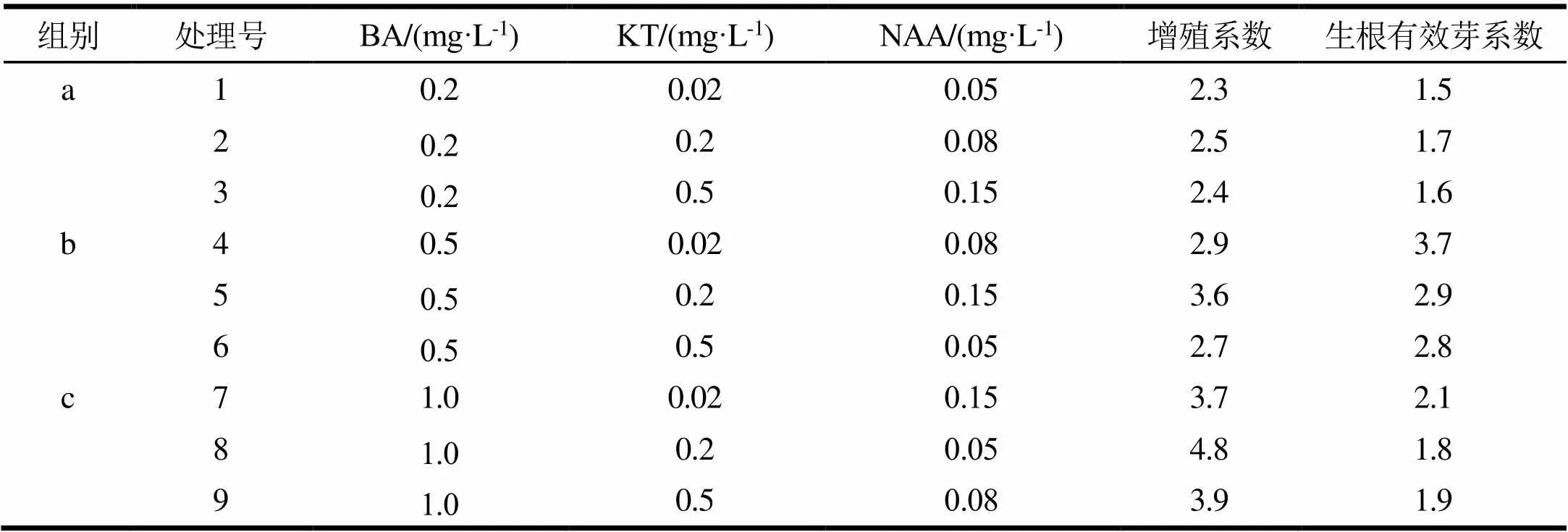
表3 不同植物生长调节剂组合对诱导继代培养增殖的影响
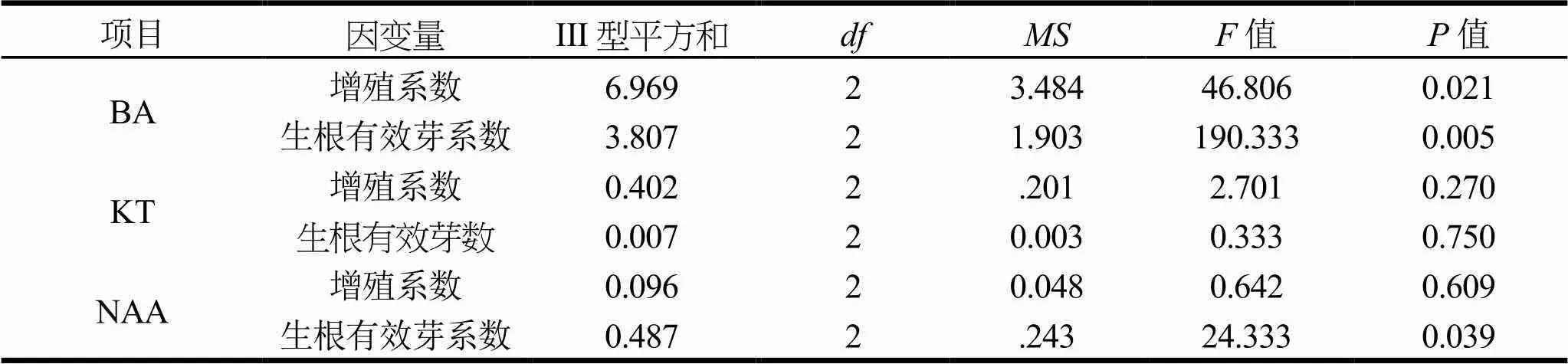
表4 不同植物生长调节对增殖影响的方差分析
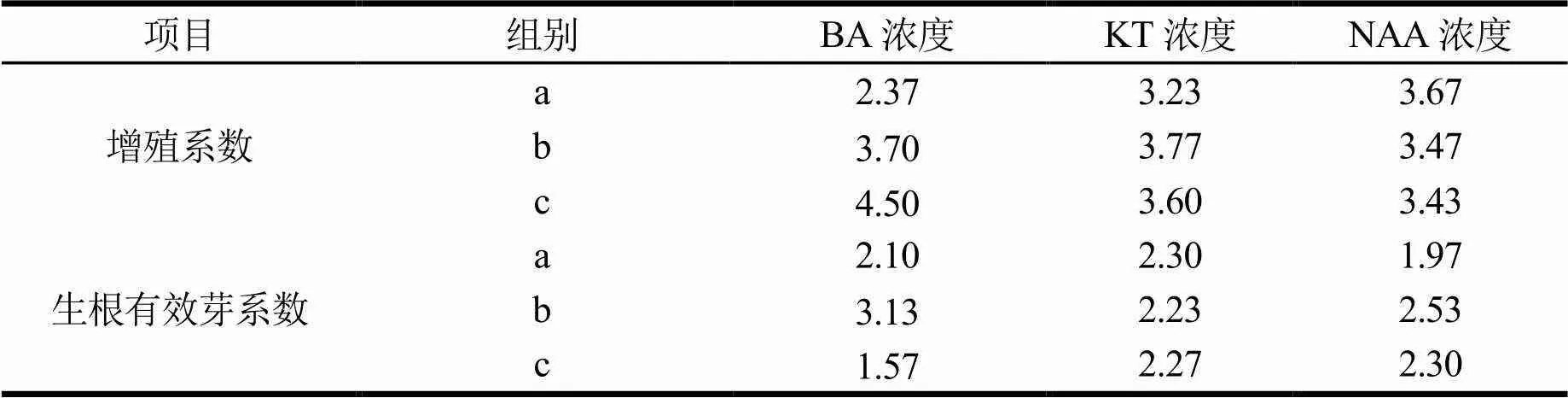
表5 增殖系数及生根有效芽系数极差分析
2.3 诱导生根数据统计与分析
丛生芽在培养基中培养20 ~ 30 d,挑选1.5 ~ 3 cm高、叶片舒展、健壮的小芽,转接于生根培养基中进行生根培养。结果发现,改良的5种配方培养基其生根率差异明显(表6),其中3号生根培养基(MS+BA0.25 mg·L-1+NAA0.1 mg·L-1+IBA0.6 mg·L-1)生根率最高,且苗木木质化较好,叶片伸展,叶色浓绿,接种20 ~ 30 d后,苗高可达3 ~ 5 cm。激素浓度高的基部有明显的瘤状愈伤组织,不利于生根。
2.4 不同抗褐化剂对外植体褐化控制的影响
由表7可知,添加抗褐化剂不同程度降低了桉树无性系BL1号外植体的褐化率。从抗褐化剂种类看,以Vc效果较好,Cys次之,而Na2S2O3效果最差。Vc随着其添加浓度的增加,抗褐化效果明显增强,褐化率降低;当添加到15 mg·L-1的Vc时,褐化率低至14%,而且芽体生长正常。在添加Cys的培养基中,在浓度为100 mg·L-1时,颜色为淡褐色,芽体生长正常,但褐化率较高,随着浓度的增加,抗褐化效果明显增强,褐化率降低,但芽体生长不良,细弱黄化。不同浓度的Na2S2O3表现较差,褐化程度均较高,且芽体均生长不良,黄化严重。CK对外植体褐变的控制几乎没有效果。因此添加15.0 mg·L-1的Vc为最佳抗褐化剂。
2.5 苗木移栽
为加强苗木的木质化,当瓶苗在室内根系长至0.5 ~ 1 cm时移到有适当光照条件的大棚内炼苗。炼苗7 ~ 15 d后待幼苗木质化较好、根系发达、有3 ~ 5对小叶、健壮时便可移栽。育苗基质采用黄心土基质,提前24 h用0.3%的高锰酸钾溶液对其消毒,移栽前将基质淋透水。幼苗移栽前用自来水将根系上的培养基清洗干净,置于盘中,之后用消毒过的镊子把苗栽于杯的中间,移栽完毕后淋透水。
2.6 幼苗管护
初移栽幼苗生命力脆弱,需细致管理,保持基质的湿润,水分以叶面湿为佳。苗移栽成活后,每隔7 ~ 10 d施肥1次,浓度0.1% ~ 0.3%,施时坚持由稀到浓的原则。苗木长至15 ~ 25 cm时即可出圃。幼苗易发生茎腐病、根腐病和猝倒病等,因此移栽6 ~ 10 d要喷灭菌剂如多菌灵、百菌清防病,每隔10 d左右喷杀1次。苗木的虫害主要有白蚁、蚜虫等,白蚁可用1 000倍70%辛硫磷淋杀,蚜虫可用800 ~ 1 000倍80%的氧化乐果喷杀。
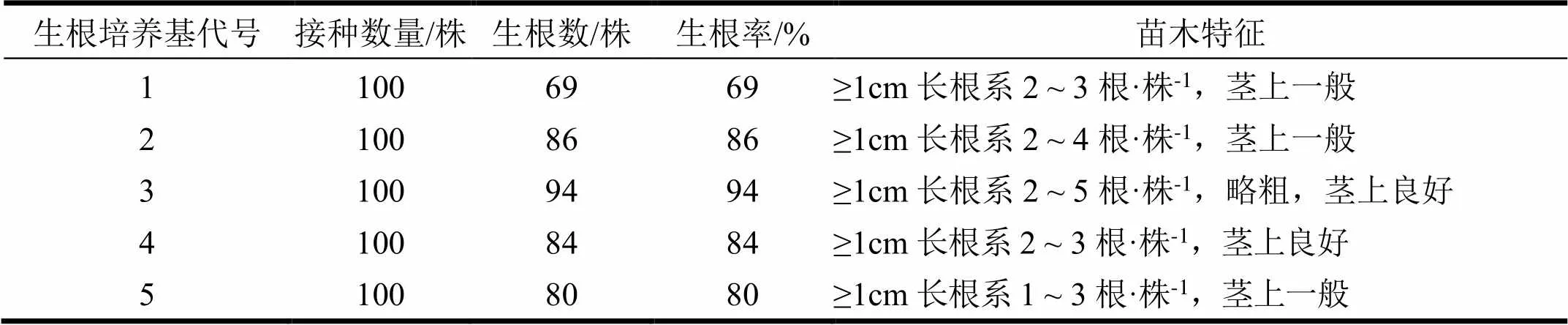
表6 不同激素组合配比生根培养基对幼苗生根的影响
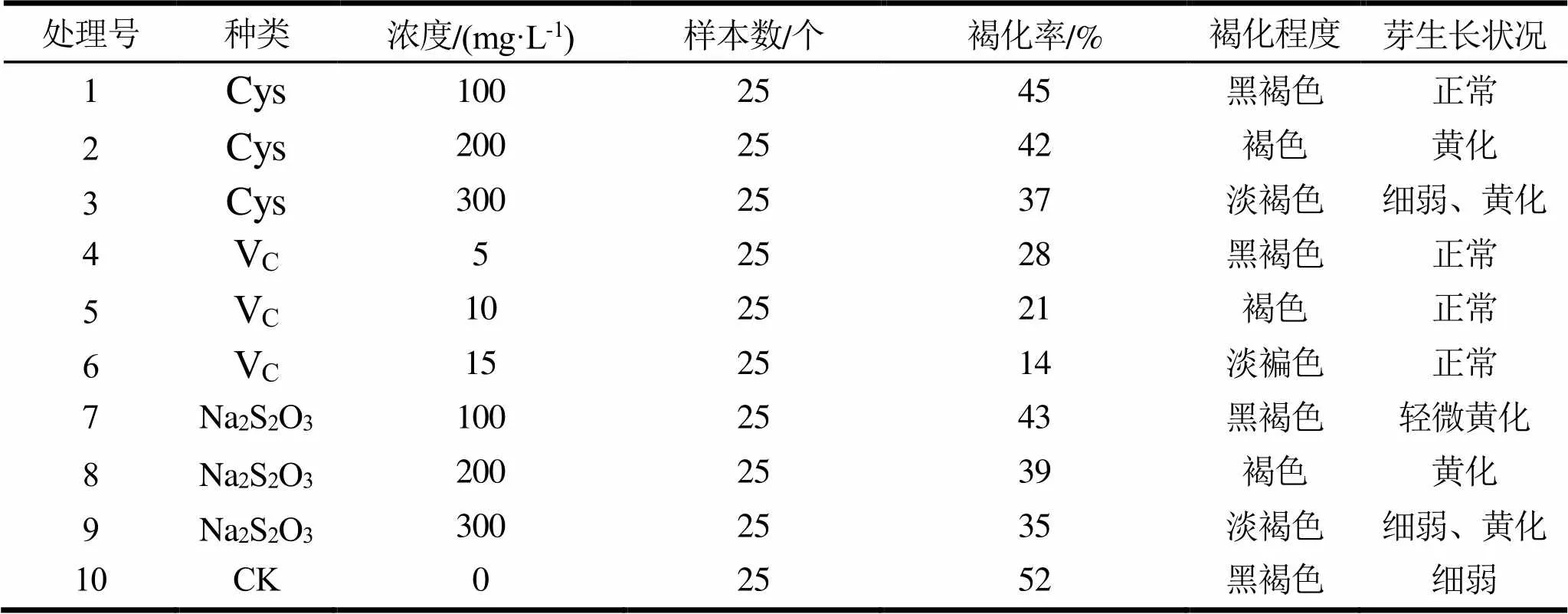
表7 不同抗褐化剂对芽诱导褐化率的影响
3 结论
(1)以晴天午后采条效果最好。用纯净水充分冲洗外植体,可起到较好的清洁作用。用1 000倍退菌特溶液浸泡15 min,有较好的杀菌作用。采用HgCl2分两个时间段的消毒方法,有良好的杀菌效果。试验表明,晴天+纯净水冲洗30 min+0.15% HgCl2(3+7) min为其外植体最佳采集消毒处理方法。
(2)不同植物生长调节剂组合对桉树无性系BL1号诱导继代培养增殖有显著影响。研究结果表明,改良MS+BA 1.0 mg·L-1+KT 0.2 mg·L-1+NAA 0.05 mg·L-1是诱导继代繁殖的最适培养基;改良MS + BA 0.5 mg·L-1+NAA 0.08 mg·L-1+KT 0.02 mg·L-1是生根有效芽繁殖的最适培养基。
(3)不同激素组合配比生根培养基对小苗生根的影响有显著不同。试验表明,改良MS+ BA 0.25 mg·L-1+NAA 0.1 mg·L-1+IBA 0.6 mg·L-1是桉树无性系BL1号生根繁殖的最适培养基。
(4)不同抗褐化剂对外植体褐化控制的影响不同。抗坏血酸(VC)随着添加浓度的增加,抗褐化效果明显增强,褐化率降低;当添加抗坏血酸(Vc)到15 mg·L-1时,褐化率低达14%,而且芽体生长正常。不同褐化剂对外植体的影响效果为:VC>Cys>Na2S2O3>CK。
[1] 谢耀坚.科技创新引领中国桉树研究和产业迅猛发展[J].桉树科技,2022,39(1):35-42.
[2] 赖崇健,李清香,邓月梅,等.桉树组培苗产业化发展的机遇与对策[J].吉林农业,2011(2):8-10.
[3] 蒋云安,谢守鑫,靳爱仙,等.巴西新一代人工桉树林经营策略及其启示[J].林业资源管理,2018(6):125-129.
[4] 韩郸,李秉略.“维护木材安全”背景下扩大我国速生丰产人工林种植面积必要性分析[J].林产工业,2021,58(7):113-115.
[5] 欧阳磊.桉树组培快繁中存在的问题与对策[J].福建林业科技,2006,33(1):203-206.
[6] 赵安然,张文龙.桉树组培快繁出现的问题及对策[J].现代农业科技,2020(6):143.
[7] 欧阳权.桉树的组织培养[J].桉树科技,1991(l):10-20.
[8] 温茂元.桉树壮苗培养[M].海口:海南出版社,2000.
[9] 刘勇.我国苗木培育理论与技术进展[J].世界林业研究,2000,13(5):43-49.
[10] 沈惠娟.木本植物组织培养技术[M].北京:中国农业科技出版社,1992.
Study on Tissue Culture Technology ofClone BL1
GAN Deyu, LV Mingcan, PENG Xinrong, YANG Fuchao, WANG Qiuhui, LIU Jinghua
()
The tissue culture and rapid propagation technology system ofclone BL1 was studied using stem segments with buds as explants. The process of rapid propagation of BL1 is described in this paper. Cultivation of complete seedling plants of this clone involved many steps including shoot collection, disinfection, induction, propagation, rooting and transplanting of explants. The results showed that the best method of explants collection and treatment involved collection on sunny days, then washing for +30 minutes with pure water +0.15% HgCl2for 3+7 minutes. It was found that VC15.0 mg·L-1was an effective method for controlling explant browning, and the effect of different browning agents on explants is as follows: VC> Cys>Na2S2O3>CK. Modified MS+BA 1.0 mg·L-1+KT 0.2 mg·L-1+NAA 0.05 mg·L-1was the optimal medium for subculture. Modified MS+BA0.5 mg·L-1+NAA 0.08 mg·L-1+KT 0.02 mg·L-1proved an effective medium for bud propagation. The optimal rooting medium was modified MS+BA 0.25 mg·L-1+NAA 0.1 mg·L-1+IBA0.6 mg·L-1.
clone;BL1; tissue culture
10.13987/j.cnki.askj.2022.02.005
S722.3+7
A
甘德煜(1966— ),男,本科,高级工程师,主要从事林木育种和林木栽培技术研究,E-mail:472591482@qq.com
