外泌体在肺移植排斥反应中的作用研究进展
2022-07-11蒋冠宇陈思远徐永瑞郑明峰毛文君
蒋冠宇 陈思远 徐永瑞 郑明峰 毛文君
肺移植是多种终末期肺病在替代手术和药物治疗失败后的唯一治疗方法[1]。自1963年第1例人类肺移植实施以来,全世界肺移植手术量已经超过65 000例[2]。尽管外科技术、供肺保存、免疫抑制管理以及对缺血-再灌注损伤和感染的处理都取得了进步,受者中位生存期在过去十年中从4.3年增加到6.5年[3],但与其他实体器官移植相比,肺移植术后的存活率仍然较低。而急性排斥反应(acute rejection,AR)和以慢性移植肺功能障碍(chronic lung allograft dysfunction,CLAD)为主要表现的慢性排斥反应仍然是影响同种异体移植物长期存活的主要障碍[4]。
外泌体是真核生物细胞间通讯的一种胞外信号体,可以携带复杂生物信息,参与各种生理、病理过程,在靶细胞中引起多效性反应[5]。近年来外泌体在排斥反应和免疫耐受方面的研究逐渐增多,已经成为移植术后排斥反应中的重要免疫介质,在排斥反应的监测和治疗上也发挥着关键作用。目前国内关于外泌体在肺移植术后排斥反应中的研究较少,本文就肺移植术后排斥反应类型、外泌体调控排斥反应的机制、外泌体作为生物标志物及其在排斥反应治疗中的应用等方面进行探讨。
1 肺移植术后排斥反应
1.1 急性细胞介导排斥反应
急性细胞介导排斥反应(acute cellular rejection,ACR)是肺移植术后最常见的并发症之一,被认为是导致CLAD的主要危险因素[6]。据国际心肺移植学会的注册报告,28%的肺移植受者在术后第1年至少经历一次AR。ACR是与主要组织相容性复合体(major histocompatibility complex,MHC)错配和T细胞同种异体识别有关的适应性免疫的结果。细胞免疫在AR的发生发展过程中起主导作用[7]。ACR的诊断基于肺组织中血管周围和间质出现单个核细胞浸润。有ACR的肺移植受者可能没有症状,也可能出现如低氧血症,不同程度的呼吸困难、焦虑及乏力等相对典型的临床表现。目前ACR的治疗通常建议大剂量甲泼尼龙静脉冲击。
1.2 抗体介导的排斥反应
抗体介导的排斥反应(antibody-mediated rejection,AMR)是由受者体内抗供者人类白细胞抗原(human leukocyte antigen,HLA)和(或)非HLA抗体导致的排斥反应,是AR的另一种表现形式,可以单独或与ACR同时发生,是导致慢性排斥反应和影响受者生存的主要因素之一[8]。在肺移植中,供者特异性抗体(donor specific antibody,DSA)与AMR密切相关[9]。AMR的组织病理学表现为中性粒细胞附壁、中性粒细胞性毛细血管炎、动脉炎和弥漫性肺泡损伤等。目前肺移植术后AMR没有系统的治疗方案,通常建议血浆置换及静脉滴注免疫球蛋白和利妥昔单抗[10]。
1.3 慢性移植肺功能障碍
慢性排斥反应是肺移植术后受者长期存活的主要障碍。CLAD是慢性排斥反应最主要的形式,主要包括以限制性通气障碍、周边肺纤维化改变为特征的限制性移植物综合征(restrictive allograft syndrome,RAS)和以慢性小气道阻塞性改变为特征的闭塞性细支气管炎综合征(bronchiolitis obliterans syndrome,BOS)[11]。CLAD的形成和发展涉及多种因素的相互作用,包括移植后诱导的炎症、移植后感染以及针对供者抗原的同种异体免疫和自身免疫之间的相互作用等[12]。目前慢性排斥反应的治疗效果不佳,通常采用个体化治疗方案。若病情持续进展,则需再次进行肺移植[13]。
2 外泌体在肺移植中的作用研究现状
外泌体在细胞间相互通讯中起着重要作用,是目前人们广泛关注的一类细胞外纳米囊泡。外泌体于分泌细胞的多囊体内形成,组成取决于细胞的起源、疾病状态和病理生理条件,主要由脂质双层、跨膜蛋白和核心内容[包括特定和非特定蛋白、信使核糖核酸(messenger RNA,mRNA)、微小核糖核酸(microRNA,miRNA,miR)和长链非编码RNA(long non-coding RNA,lncRNA)]构成,存在于多种生物体液中[14],主要参与膜融合和转运等。外泌体具有组织特异性的表面受体特征,可以通过转移蛋白质、转录因子、脂质、mRNA和miRNA介导细胞间的通讯[15]。外泌体与靶细胞融合后将功能性受体传递到靶细胞,在某些情况下甚至可以激活受体和效应器,并改变靶细胞的功能[16]。此外,外泌体已被证明可以改变变态反应中的细胞学行为,还能够通过MHC抗原以及巨噬细胞激活T细胞[17]。
在肺移植中,供者来源的外泌体主要表达自身抗原和供者HLA。据Ravichandran等[18]报道,在肺移植术后,当移植器官不处于应激状态时,含有供者HLA和自身抗原的外泌体不会释放入循环。当发生排斥反应时,可以在循环和支气管肺泡灌洗液中检测到组织特异性外泌体。据Sharma等[19]研究发现,诊断为AR和CLAD的肺移植受者的血清和支气管肺泡灌洗液中,存在具有不同抗原特性的外泌体,这些外泌体包含的mRNA和免疫调节miRNA也不相同。从诊断为排斥反应的肺移植受者中分离到的外泌体不仅含有供者来源的HLA,而且还含有肺相关自身抗原,如Ⅴ型胶原和K-α1微管蛋白等[19]。外泌体在正常和免疫损伤状态下具有不同的RNA谱。据Gregson等[17]研究发现,正常和发生AR的患者之间的外泌体穿梭RNA(exosomal shuttle RNA,esRNA)群体特征明显不同。esRNA谱介导对于基本肺功能至关重要的代谢途径,如胶原生物合成、血小板衍生生长因子信号传导、细胞表面相互作用、补体级联和烟碱型乙酰胆碱受体信息传递等。在肺移植术后静止状态下的基础肺代谢途径被过度表达,而在AR人群中则显示出抗原处理以及先天免疫和获得性免疫激活的esRNA歪曲表达谱。目前已经发现某些具有独特特征的供者来源外泌体在肺移植术后被释放,然而,其在肺移植中的作用相关研究仍处于初级阶段。
3 外泌体在肺移植术后排斥反应中的作用
3.1 外泌体调控肺移植术后排斥反应的机制
细胞免疫和体液免疫过程在排斥反应的发病机制中起重要作用。同种异体识别是肺移植术后排斥反应的重要过程,受者的免疫系统识别来自供者器官的错配MHC抗原,并激活T细胞,启动同种异体移植排斥反应[20]。在同种异体免疫领域,有几条途径描述了以上过程,包括直接同种异体识别、间接同种异体识别、半直接同种异体识别和固有同种异体识别(图1)。与之相反,调节性T细胞(regulatory T cell,Treg)在排斥反应中主要发挥免疫耐受的功能。而外泌体的参与是其中不可缺少的一环。
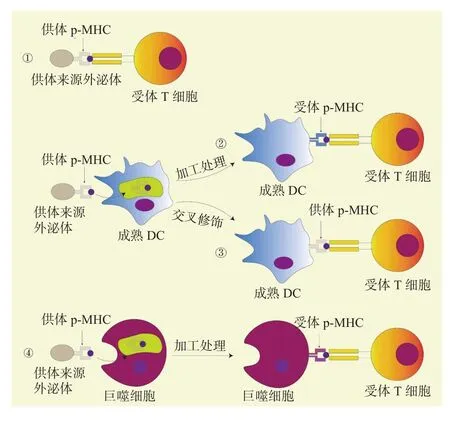
图1 外泌体介导的同种异体识别途径Figure 1 Exosome-mediated allogeneic recognition pathway
3.1.1 直接同种异体识别 直接同种异体识别途径解释了淋巴器官中的受者T细胞如何识别供者抗原提呈细胞(antigen-presenting cell,APC)表面的 MHC-抗原肽复合物(peptide-MHC,p-MHC)。在肺移植术后早期,供者APC来源外泌体迁移到受者次级淋巴器官,激活直接途径中的幼稚T细胞,产生同种异体反应性T细胞。T细胞直接识别同种异体抗原后引发大规模的多克隆性炎症反应,从而导致同种异体移植AR[21]。最近有证据表明,外泌体在直接途径中可以提高T细胞对供者MHC抗原的同种异体致敏效率。外泌体维持起始APC的拓扑结构,暴露囊泡表面MHC抗原的胞外区。APC释放的外泌体携带亲代细胞表面的MHC抗原,具有直接刺激CD8+T细胞和CD4+T细胞的能力[22]。
3.1.2 间接同种异体识别 随着供者APC减少,间接同种异体识别途径在慢性排斥反应中起主要作用。慢性排斥反应主要由CD4+T细胞和同种异体反应性抗体的产生所主导。通过间接同种异体识别途径,供者APC来源的外泌体被受者APC内化,由自身MHCⅡ类抗原处理后呈多肽形式递送给CD4+T细胞,这种机制在同种异体移植的整个过程中都是持续的[23]。研究表明,外泌体携带的供体p-MHC可以作为肽的来源,当被APC通过吞噬或微胞吞噬作用内化时,可以间接激活T细胞。
3.1.3 半直接同种异体识别 当供者来源外泌体表面的完整MHC抗原从供者APC转移到受者APC,然后由受者APC提呈给T细胞时,半直接同种异体识别途径就会发生,这是外泌体介导排斥反应的主要方式。通过半直接同种异体识别,受者APC不仅能够提呈供者来源的完整MHC抗原以激活直接同种异体反应中的幼稚CD8+T细胞,还能提呈受者MHC抗原中供者衍生肽以刺激间接同种异体反应中的CD4+T细胞[24]。这一机制使得直接和间接激活的T细胞能够通过同一APC进行交叉调节。受者APC与供者APC来源的外泌体融合并发生交叉修饰,显示完整的p-MHC。APC在体内能够将获得的同种异体抗原作为完整的p-MHC在细胞表面长时间保留和浓缩。而外泌体以小簇的形式黏附在受者APC表面,保留完整且功能正常的供者MHC抗原和APC激活信号。如果捕获的外泌体表达同种异体MHC Ⅱ类抗原,还有可能发生多肽特异的同种异体反应,即以同种异体限制性的方式将新的多肽提呈给受者CD4+T细胞。外泌体不仅可以将抗原靶标传播到全身,而且还可以产生导致细胞产物上调或下调的指令[25]。有研究表明,树突状细胞(dendritic cell,DC)可以诱导排斥反应或免疫耐受,这取决于它们的表型和(或)成熟阶段[26]。成熟的DC可以刺激免疫反应,分泌的外泌体能够激活T细胞;未成熟DC来源的外泌体(immature DC-derived exosome,imDEC),其MHC抗原表达水平较低,具有调节功能和抑制免疫应答的作用。此外,imDEC表达FasL,引起T细胞凋亡[14]。因此,根据释放外泌体的DC状态,可以产生刺激或抑制免疫反应的双重作用。
3.1.4 固有同种异体识别 固有免疫通过受者体内的成熟DC激活效应T细胞并诱导巨噬细胞产生同种异体毒性来触发或增强同种异体移植物排斥反应,包括巨噬细胞吞噬和抗原提呈、移植物内DC成熟以及同种异体反应性与供者特异性外泌体的分泌,这些外泌体迁移到受者淋巴组织后进行进一步的抗原处理。有研究指出,供者单个核细胞和分泌的外泌体上存在一种信号调节蛋白α(signal regulatory protein α,SIRPα),易引发同种异体排斥反应。由于供者特异性外泌体在移植术后持续存在于淋巴组织中,基于外泌体的固有同种异体识别可能是慢性排斥反应发生过程的重要一环[22]。
3.1.5 调节性T细胞 此外,据Pang等[27]报道,外泌体是Treg用来维持免疫耐受的重要工具。Treg可通过多种机制抑制排斥反应,包括抑制CD4+T细胞、CD8+T细胞的增殖和激活,抑制B细胞反应,调节巨噬细胞和自然杀伤细胞功能。而通过外泌体转运miRNA是Treg的核心功能。Treg介导的免疫耐受需要通过外泌体将miR-let-7d从Treg转移到CD4+T细胞。除了T细胞,Treg来源外泌体还可以调控APC,使它们偏向耐受表型。Treg来源外泌体修饰的DC改变了它们的细胞因子分泌谱及表面表达的免疫抑制分子,而在其中发挥关键作用的miRNA是miR-142-3p。据报道,miR-142-3p转染可干扰髓系细胞的每一步抗原提呈过程,包括降低吞噬功能、抑制抗原消化和表位加工以及增加程序性细胞死亡蛋白配体1的表达,最终导致APC无法激活T细胞[28]。
3.2 外泌体作为检测肺移植术后排斥反应的指标
早期、可靠地诊断肺移植术后排斥反应是肺移植受者良好预后的关键。体液中外泌体的存在反映了器官和组织的组织学和生理学特征,外泌体的含量和表面标志物在发生排斥反应和未发生排斥反应受者中存在很大的差异,可以作为一种非侵入性的可靠方法来检测同种异体移植排斥反应[21]。据Gunasekaran等[20]报道,在临床诊断前,伴有AR和BOS的肺移植受者血清中可检测到含有自身抗原的外泌体。BOS受者的外泌体内肺相关自身抗原含量(包括K-α1微管蛋白和Ⅴ型胶原)较未发生排斥反应受者显著升高[20]。研究发现,移植前或移植后存在的抗自身抗原抗体会导致同种异体移植物存活率降低,提示外泌体表达自身抗原会诱导体液免疫反应,导致同种异体移植物功能障碍。Gunasekaran等[29]研究发现,MHCⅡ类反式激活因子(MHC classⅡtransactivator,CⅡTA)、核因子(nuclear factor,NF)-κB、低氧诱导因子(hypoxia inducible factor,HIF)-1α、Toll样 受 体(Toll-like receptor,TLR)4途径相关分子白细胞介素1受体相关激酶1(interleukin-1 receptor-associated kinase 1,IRAK1)和髓 样分化因 子 88(myeloid differentiation factor 88,MyD88)存在于发生排斥反应的肺移植受者的外泌体中,而在稳定的肺移植受者的外泌体中不存在。同时,未发生排斥反应受者的外泌体不表达MHCⅡ类抗原和共刺激分子(CD80、CD86、CD40),但发生排斥反应和未发生排斥反应的受者均表达黏附分子[14]。外泌体还含有能够诱导炎症、内皮激活、AMR和辅助性T细胞(helper T cell,Th)17分化的miRNA,这些miRNA参与B细胞、T细胞免疫反应和转化生长因子(transforming growth factor,TGF)-β信号通路,调节重要的细胞过程,可能引发AR和BOS进展,如miR-144是BOS的一个主要生物标志物[30]。此外,肺移植术后外泌体的不同变化可能与不同类型的排斥反应有关[31]。Bansal等[32]研究发现,伴有RAS的肺移植受者体内外泌体中含有DSA。RAS来源的外泌体中参与MHCⅡ类抗原激活的转录因子CⅡTA、多聚体免疫球蛋白受体(polymeric immunoglobulin receptor,PIGR)、促炎转录因子NF-κB、20S蛋白酶体、HLA-DQ和HLADR均显著高于BOS来源的外泌体。在出现移植肺损伤的组织学表现之前,循环中的供者特异性外泌体谱可以早期检测排斥反应[33],用于评估同种异体移植物的状态以及排斥反应的性质和严重程度,有助于预测排斥反应的发生并及时调整治疗方案。各类外泌体标志物在肺移植术后不同状态下的表达情况见表1。
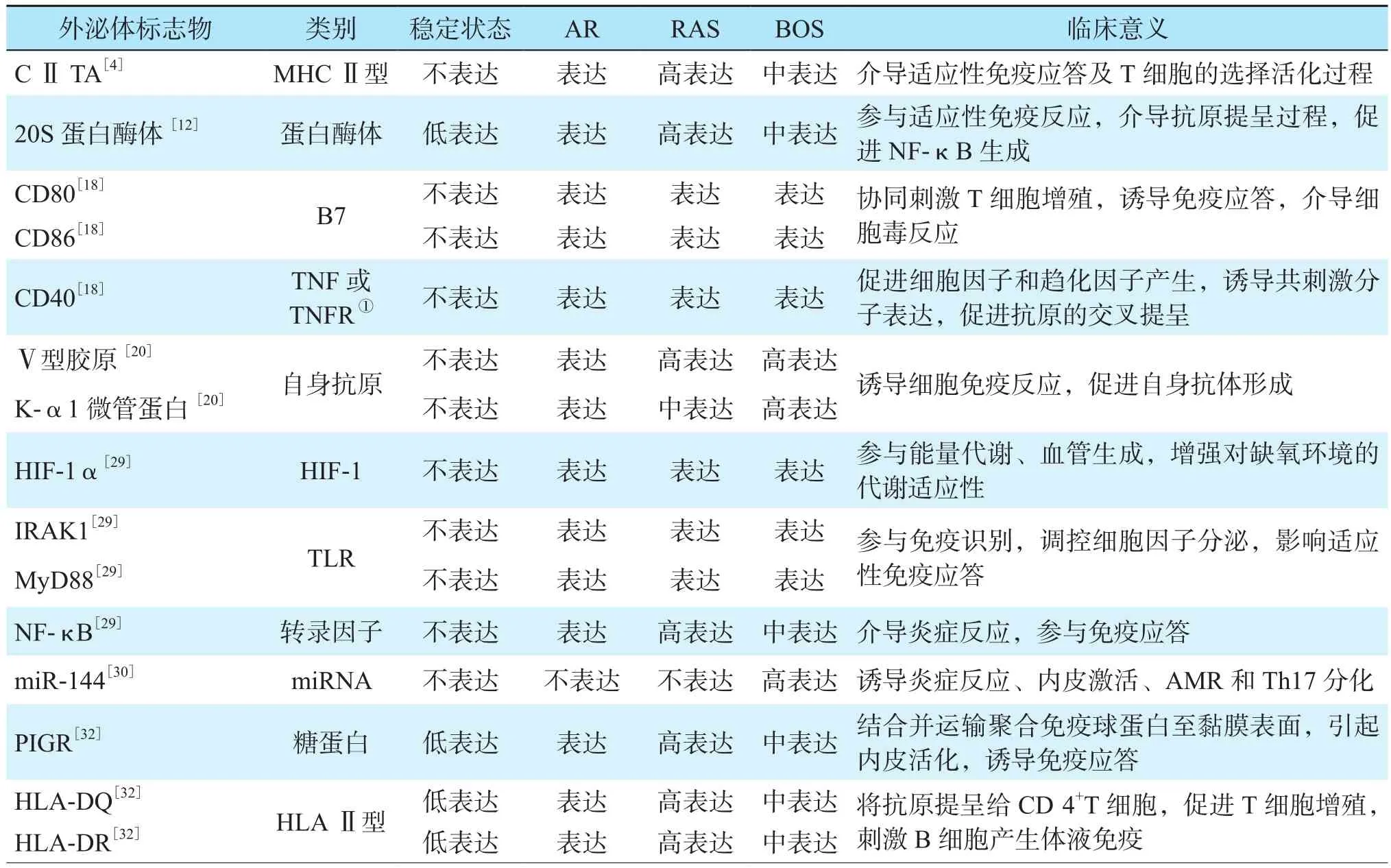
表1 外泌体标志物在肺移植术后不同状态下的表达情况Table 1 Expression of exosome markers in different conditions after lung transplantation
3.3 外泌体在肺移植术后排斥反应中的治疗应用
肺移植受者术后需要应用免疫抑制剂来抑制排斥反应,虽然AR能得到较好的控制,但长期使用免疫抑制剂会产生许多不良反应,而且并不能预防CLAD。针对同种异体移植排斥反应,人们提出了不同的替代疗法,主要基于预先输注不同类型的调节性细胞,包括DC、间充质干细胞和T细胞等。然而,这些方法缺乏效率,并且在适用性方面存在许多问题[34]。而外泌体在免疫调节中的作用已引起人们的广泛兴趣,可能成为诱导移植后免疫耐受和存活的一种无细胞替代方法。根据Lee 等[35]的报道,骨髓间充质干细胞来源的外泌体在调节各种免疫细胞亚群,促进免疫动态平衡方面发挥作用,其通过T细胞凋亡、增加Treg数量和释放白细胞介素(interleukin,IL)-10表现出很强的免疫抑制活性。外泌体还可以通过抑制单个核细胞向DC的分化、改善Treg的功能、抑制自然杀伤细胞和CD8+T细胞的活性来减弱免疫反应[36]。Yu等[37]研究发现,外泌体是Treg在同种异体移植免疫耐受中的远端调控机制之一,其释放的外泌体可以作为一种新型的免疫抑制剂以减轻同种异体移植排斥反应。imDEC可以抑制炎症和自身免疫反应,在Treg分化和诱导免疫耐受中发挥重要作用[27]。虽然单用外泌体治疗在延长同种异体移植物的存活时间上是有益的,但并不能诱导免疫耐受。而使用imDEC并联合短期免疫抑制剂或供者抗原特异性Treg,同种异体移植物存活时间会更长。外泌体诱导移植免疫耐受是一个研究要点,并可能在移植术后免疫抑制疗法上开辟新的道路,结合它们作为药物载体的能力,将会成为生物医学和生物技术未来着重发展的方向之一。
4 小结与展望
外泌体是促进细胞间相互交流的一种重要囊泡,具有调节免疫的作用。通过直接、间接或半直接等同种异体识别途径,外泌体在肺移植术后排斥反应中发挥调控作用。而具有某些特征的外泌体可以作为潜在的生物标志物来识别有排斥反应风险的受者。此外,外泌体作为新兴治疗方式可以延长同种异体移植物的存活时间。因此,外泌体介导的同种异体识别途径可能为解决肺移植领域的新问题方面提供新思路。但要想探明从移植器官中诱导外泌体的过程,并阐明这种诱导如何在排斥反应的免疫病理机制中起作用,尚需进一步研究。
