不同分子检测方法在肺结核诊断中的应用评估
2022-07-11王娟娟施旭东吴梅香陈凯南京中医药大学附属南京医院南京市第二医院检验科南京0003东南大学附属中大医院重症医学科南京0009
王娟娟,施旭东,吴梅香,陈凯(.南京中医药大学附属南京医院 南京市第二医院检验科,南京 0003;. 东南大学附属中大医院重症医学科,南京 0009)
我国属于30个高结核病负担国家之一,2019年新发结核病例83.3万人,结核病发病率为58/10万[1]。传统的病原学检测主要是抗酸染色涂片和分枝杆菌培养。随着分子生物学检测技术的发展,2017年重新修订的肺结核诊断标准中,已将分子生物学诊断阳性作为病原学阳性诊断依据[2],其中Xpert MTB/RIF因高敏感性、特异性和简单快速等优点逐渐受到关注。本文对293例患者进行回顾性分析,探讨不同分子生物检测方法在肺结核诊断中的应用价值。
1 资料与方法
1.1一般资料 回顾性选取2019年1月至2020年12月南京市第二医院收治的住院患者293例,其中男192例,女101例,年龄(48±12.3)岁,依照《肺结核诊断标准WS 288—2017》[2],结合患者临床表现、影像学检查、实验室检查等,最终临床诊断为肺结核患者171例,非结核肺病患者122例。非结核肺病包括肺癌、非结核分枝杆菌肺病、隐球菌肺病、肺炎性假瘤、肺放线菌病等。所有患者均采集痰液标本送检。本研究经南京市第二医院医学伦理委员会审核批准,患者及家属知情同意。
1.2仪器与试剂 MGIT培养管、BACTEC MGIT营养添加剂及杂菌抑制剂(美国BD公司),抗酸染色液、中性罗氏培养基、对硝基苯甲酸(PNB)培养基、噻吩-2-羧酸肼(TCH)培养基(珠海贝索公司),结核分枝杆菌DNA荧光定量PCR(FQ-PCR)试剂盒(中山达安基因公司),结核分枝杆菌RNA恒温扩增检测(SAT-TB)试剂盒(上海仁度生物科技公司),GeneXpert MTB/RIF试剂盒(美国赛沛公司);BACTEC MGIT 960分枝杆菌培养检测仪(美国BD公司),ABI 7500型荧光定量PCR仪(赛默飞世尔科技公司),GeneXpert检测仪(美国赛沛公司)。
1.3方法
1.3.1抗酸染色涂片法 采用萋-尼氏抗酸染色法。操作参照试剂盒说明书和《痰涂片镜检质量保证手册》。
1.3.2分枝杆菌快速培养 痰液标本使用N-乙酰-L-半胱氨酸氢氧化钠(NALC-NaOH)去污处理,用pH6.8的磷酸缓冲液洗涤后,吸取0.5 mL加入含营养添加剂和杂菌抑制剂的MGIT培养管中,置于BACTEC MGIT 960分枝杆菌培养检测仪中检测。根据《结核病诊断实验室检验规程》,阳性标本经抗酸染色涂片法确认后,用PNB、TCH鉴别培养基进行分枝杆菌菌种初步鉴定。如果2种鉴别培养基上均无分枝杆菌生长,报告为牛结核分枝杆菌;如果2种鉴别培养基上均有分枝杆菌生长,报告为非结核分枝杆菌(non-tuberculous mycobacterium, NTM)菌群;如果PNB培养基上无分枝杆菌生长而TCH培养基上有分枝杆菌生长,报告为结核分枝杆菌(Mycobacteriumtuberculosis, MTB)。
1.3.3TB-DNA(FQ-PCR)检测 按照试剂盒说明书对标本进行处理,后于荧光定量PCR仪中进行扩增检测。
1.3.4SAT-TB检测 按照试剂盒说明书对标本进行前处理,在核酸提取过程中,经超声破碎裂解释放出RNA,后于荧光定量PCR仪中扩增检测。
1.3.5Xpert MTB/RIF检测 处理液与痰液标本进行1∶2比例混合后,放置在涡旋振荡器上涡旋0.5 min,温育15 min后震荡0.5 min,并再次温育5 min直至标本液化完全。将混合液加入检测匣,放置于GeneXpert检测仪中检测。
1.4统计学分析 用SPSS 22.0统计软件进行。一致性分析采用Kappa检验,Kappa<0.4表示一致性较差,0.4≤Kappa<0.75表示一致性较好。计数资料以例数(n)或百分率(%)表示,不同方法阳性率比较采用配对χ2检验。以P<0.05表示差异有统计学意义。
2 结果
2.1不同检测方法对肺结核的诊断效能 171例肺结核患者中有70例培养阳性,经初步鉴定均为MTB;122例非结核肺病患者中痰涂片阳性13例,经菌种鉴定,共获得3种不同菌株,包括胞内分枝杆菌10例,鸟分枝杆菌2例,龟分枝杆菌龟亚种1例。以临床诊断为金标准,分枝杆菌快速培养、TB-DNA(FQ-PCR)、SAT-TB和Xpert MTB/RIF在肺结核诊断中的特异性和阳性预测值均达100%,其中Xpert MTB/RIF和临床诊断的一致性最高(Kappa=0.451)。见表1。

表1 不同检测方法的诊断效能
2.2不同检测方法和Xpert MTB/RIF的阳性率比较 293例患者中,Xpert MTB/RIF阳性85例,阳性率29.01%;痰涂片阳性70例,阳性率23.89%;快速培养阳性70例,阳性率23.89%;SAT-TB阳性56例,阳性率19.11%;FQ-PCR阳性75例,阳性率25.60%。FQ-PCR与Xpert MTB/RIF阳性率差异无统计学意义(χ2=2.89,P=0.087)。见表2。
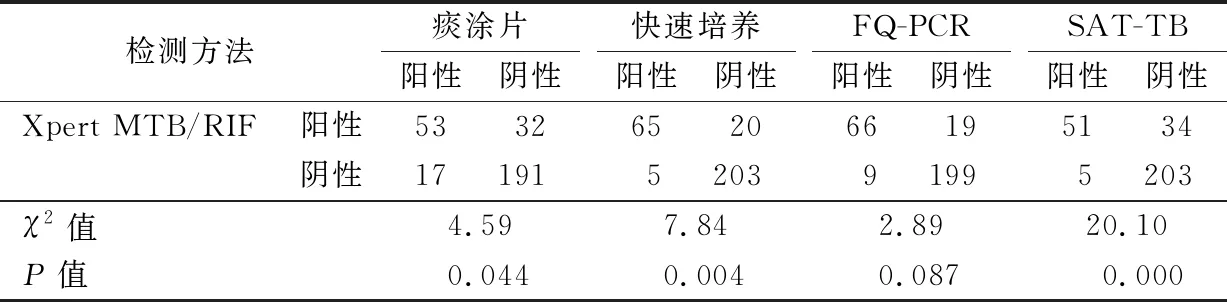
表2 不同方法和Xpert MTB/RIF检测结果比较
2.3不同分子检测方法在肺结核中的阳性率 171例肺结核患者中,痰涂片阴性114例(66.67%),培养阴性101例(59.06%);涂片阳性培养阴性8例(4.68%)、涂片阳性培养阳性49例(28.65%)、涂片阴性培养阳性19例(11.11%)、涂片阴性培养阴性95例(55.56%)。不同分子生物学检测方法的阳性检出率见表3,其中Xpert MTB/RIF在4组患者中均有较高的阳性检出率。

表3 不同分子检测方法在肺结核中的阳性检出率(%)
3 讨论
本研究显示,171例肺结核患者中涂片阴性占66.67%,培养阴性占59.06%,涂片、培养同时阴性占55.56%,提示在部分或未开展分子生物学检测的医疗机构,当患者临床表现不典型且缺乏明确的细菌学依据时,易造成误诊和漏诊。
痰涂片法虽操作简单、价格低廉,但其对标本含菌量要求高(103~104CFU/mL)[3]且无法区分MTB和NTM。本研究中非结核肺病患者中有13例痰涂片阳性,后经菌种鉴定均为NTM;分枝杆菌培养为传统的金标准,特异性高,但其受培养时间长、仅活菌才可能生长等因素限制,不能为快速诊断提供依据。本研究中70例痰快速培养阳性菌株经鉴定均为MTB,分子生物学检测无假阳性出现,特异性均达100%,部分报道[4]显示存在假阳性,可能是合并NTM感染、标本试剂污染或结果判读错误所致。
Xpert MTB/RIF针对rpoB基因81 bp利福平耐药核心区间(RRDR)设计引物、探针,FQ-PCR使用的引物和探针位于349 bp的人型结核杆菌插入序列IS986。两种方法检测靶标均为DNA,部分患者经治疗后体内仍有MTB核酸存在,因无法区分病原体活性,因此DNA检测只能用于结核病的诊断和鉴别诊断,不能用于疾病进程监测和疗效评估。SAT-TB是以结核分枝杆菌特异的16S rRNA为检测靶标,而RNA只存在于MTB活菌中且在环境中极易降解[5],这可能是导致本研究中SAT-TB的敏感性(32.75%)和阳性率(19.11%)均较低的原因,提示临床工作中标本采集后应及时送检,防止因时间过久而出现假阴性。黄芳等[6]研究结果中Xpert MTB/RIF的敏感性(87.6%)明显高于本研究(49.71%),可能是因为研究对象不同所致,黄芳等研究纳入对象均为确诊肺结核患者且以分枝杆菌培养为金标准,另外Xpert MTB/RIF的最低检测限为131 CFU/mL[3],当痰液中菌量极低情况时不易检出。
本研究中,FQ-PCR与Xpert MTB/RIF的总阳性检出率虽相近,但Xpert MTB/RIF和临床诊断的一致性最高,对培养阴性和涂片阴性的肺结核患者也有较高的检出率。Xpert MTB/RIF是新型的分子生物学检测方法且逐渐被证实具有较高的肺结核诊断效能,相对于传统荧光定量PCR技术,在准确性、安全性和时效性方面更具优势。其以5条探针对检测区域进行全覆盖,内参设计确保结果更加准确可靠,独立并自成体系的一次性反应盒避免了操作过程污染及环境因素对实验结果干扰,最大程度减少实验中气溶胶的产生,整个过程可在2 h内完成[7]。肺结核患者临床表现个体差异大,Xpert MTB/RIF更准确高效快速的优势可以实现对肺结核的早期诊断,更适合推广使用。
