不同浓度的A-PRF 膜萃取液对人牙龈成纤维细胞增殖及OPG 表达的影响
2022-07-09陈嘉彤王雪松金鼎
陈嘉彤 王雪松 金鼎
随着生活水平的提高,越来越多的人们开始重视口腔健康,人们的思想观念也从治疗为主转向预防为主。越来越多的口腔材料都应用于临床造福人类,A-PRF 膜也广泛应用于口腔临床诊疗工作中,它作为一种富含生长因子的生物膜因制取方法便捷、取自自体血液、离心无排斥反应等优点深受广大医生的喜爱,是一种天然纤维蛋白为基础的生物材料,从不含抗凝剂的血液中收获,无需任何人工生化修饰。A-PRF 膜对种植体周围附着龈丧失具有很好的疗效,可以很好的促进急性外伤造成的鼓膜创口的愈合,促进上颌窦的骨组织再生,也可以很好的治疗牙周病导致的牙龈退缩[1-4]。A-PRF 膜还可以释放大量的生长因子从而促进人牙龈成纤维细胞分泌Ⅰ型胶原,有助于牙周组织的愈合[5]。Bozkurt 研究通过对20 例患者应用浓缩生长因子得出其有助于临床上复杂性牙龈萎缩的治疗[6]。本实验采取健康成人静脉血制作A-PRF 膜,将A-PRF 膜放置于患者自身体外培养的牙龈成纤维细胞培养瓶内,观察各放置组内人牙龈成纤维细胞的生物学行为及各组内OPG 的表达,具体报告如下。
1 材料与方法
1.1 试剂及仪器 磷酸盐缓冲液(PBS)(Solarbio)、胰蛋白酶消化液(Solarbio)、DMEM 低糖培养基(Solarbio)、无噬菌体低内毒素胎牛血清(杭州四季青)、Vimentin(D21H3)XP Rabbit mAb(Cell Signaling Technology)、Goat anti-rabbit IgG(H+L)/FITC (Sigma,USA)、免疫荧光染色试剂盒(汉恒生物科技有限公司,上海)、OPG-ELISA 试剂盒(瑞齐生物科技有限公司,上海)、荧光显微镜 (正置,OLYMPUS)、SW-CJ-2FD超净工作台(苏州净化设备有限公司)、CKX41 显微镜、MCO-15A 全自动CO2细胞恒温孵育箱(SANYO)、酶标仪(BioTek,synergy 2)。
1.2 方法
1.2.1 牙龈成纤维细胞的培养与组织来源鉴定 人的牙龈组织取材于本院口腔颌面外科门诊因有阻生智齿需要拔除、矫正牙齿过程中开窗牵引需要切除少量牙龈,或者口腔种植手术中需切除部分牙龈且牙龈没有炎症的健康患者,在取得患者知情同意后选用其牙龈组织用作培养来源,年龄18~26 岁。将门诊所选用的健康牙龈作为HGF 原代培养来源,利用牙龈组织块贴壁的方法进行细胞培养,培养液需要每2~3 天做一次更换,采用普通光学显微镜观察人牙龈组织块的生长情况以及HGF 细胞的爬出形态。选择胰蛋白酶消化传代法消化并且提纯人牙龈成纤维细胞[7]。利用免疫荧光染色的方法对健康传代的第3 代细胞进行抗波形丝蛋白以及抗角蛋白染色鉴定细胞的来源。
1.2.2 制备A-PRF 膜萃取液并将A-PRF 膜与人牙龈成纤维细胞共同培养 A-PRF 膜制备方法:取2 份志愿者自身静脉血10 ml,将其在无菌条件下进行离心,1500 r/min 离心14 min。见图1。离心后取得A-PRF生长因子凝胶,将凝胶进行压缩,制作A-PRF 膜。见图2。将A-PRF 膜放置于存有5 ml 的DMEM 无菌培养基内进行孵育。1 周后将培养基内的培养液进行收集,随后进行离心,采用无菌滤器进行过滤去除细菌,而后取得A-PRF 膜萃取原液。本实验将这种原液浓度设定为100%浓度,而后用DMEM 培养基以不同浓度进行稀释,从而获得10%、50%的A-PRF 生长因子提取液。将第3 代人牙龈成纤维细胞用酶联免疫法传代到含有盖玻片的六孔板内,取浓度0、10%、50%、100%的A-PRF 提取液100 μl 分别加入到人牙龈成纤维细胞培养基内,标记为A 组、B 组、C 组、D 组,每组内有7 个复孔。37℃的全自动CO2恒温孵育箱内孵育24 h 后取出,倒置相差显微镜观察人牙龈成纤维生物学形态。

图1 自体血离心
图2 制备A-PRF 膜
1.2.3 人OPG-ELISA 试剂盒检测不同浓度PRF 膜对OPG 表达的影响 吸取不同组别培养基上清液置于离心管承装并做好组别标记。依照OPG-ELISA 试剂盒使用说明进行操作。将标记好的稀释标准品用酶标仪检测各样品孔的OD 值。从而利用各孔的吸光值得出相应样品的OPG 含量的浓度。
1.3 统计学方法 采用SPSS22.0 统计学软件进行统计分析。计量资料以均数±标准差()表示,采用t检验,多组比较采用方差分析。P<0.05 表示差异具有统计学意义。
2 结果
2.1 人牙龈成纤维细胞的培养及鉴定 利用组织块贴壁的培养方法培养HGF,组织块贴壁。见图3。在倒置相差显微镜下进行观察,可见HGF 呈现梭形或者星形,细胞排列十分规则,呈束状或旋涡状。见图4。用免疫荧光染色法鉴别HGF 组织的来源,抗角蛋白抗体染色结果无染色呈阴性,抗波形丝蛋白抗体染色呈现阳性,胞浆呈现荧光绿色,HGF 的细胞有明显细长的伪足呈长梭形,胞核多呈椭圆形位于细胞的中央。见图5。照相记录HGF 的细胞形态,证实本实验所培养的细胞为来源于中胚层的纤维母细胞,具有HGF 的形态特点。

图3 培养的人牙龈成纤维细胞

图4 培养的人牙龈成纤维细胞(×40)

图5 牙龈成纤维细胞生物学形态的免疫荧光染色(×400)
2.2 不同浓度A-PRF 膜对牙龈成纤维细胞生长的影响 随着A-PRF 膜萃取液浓度的增高牙龈成纤维生长密度增加,细胞数量明显增多。见图6。
2.3 不同浓度A-PRF 膜对人牙龈成纤维细胞OPG 表达的影响 HGF 在低浓度的生长因子萃取液刺激的条件下,OPG 表达水平随着萃取液浓度的增高而不断增加。经不同浓度A-PRF 膜萃取液刺激后,四组的OPG 表达水平比较差异均具有统计学意义(P<0.05)。见表1,图7。
表1 四组OPG 表达水平比较 (,pg/ml)

表1 四组OPG 表达水平比较 (,pg/ml)
注:四组比较,P<0.05
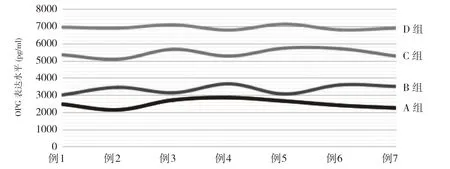
图7 四组OPG 表达水平比较
3 讨论
人牙龈成纤维细胞是牙周组织中的主体细胞,在牙周组织的保护及修复中占有重要的地位[8]。OPG 对骨组织吸收起抑制作用,抑制破骨细胞(OC)的分化、活化和成熟以及减少细胞数量[9]。本实验选用人牙龈成纤维组织块培养法体外培养HGF,原代培养的细胞以组织块为中心呈放射状增长,细胞继续传代呈旋涡状或放射状走行,排列十分紧密且有极性[10]。采用不同浓度的A-PRF 膜萃取液刺激人牙龈成纤维细胞,观察其生物学形态变化及OPG 的表达。随着A-PRF 浓度的增加人牙龈成纤维细胞的生长密度亦随之增加,OPG 的浓度也相应增大,这使得真正具有溶骨作用的OC 数量大大减少,OPG 通过上述途径起到了保护骨组织的作用。高浓度的A-PRF 膜萃取液可以通过支持促进细胞传代增殖、释放生长因子从而成为一种生物愈合基质[11]。有实验研究表明A-PRF 膜可以通过增加碱性磷酸酶的分泌促进牙龈成纤维细胞的增殖与分化[12],这与本实验的研究结果相一致。A-PRF 膜通过活化成骨相关的基因RUNX2 及骨钙素的表达促进HGF 的成骨过程[13],这与本实验OPG 随萃取液浓度的增加而表达增强,共同证实了A-PRF 膜具有促进骨组织愈合的能力。种植体周围炎的患者经过有效的洁治刮治等治疗后应用A-PRF 膜还能有效的促进种植体周围炎的愈合[14]。动物实验研究A-PRF 可以有利于短期内外伤脱位牙牙周膜愈合[15]。A-PRF 膜可以刺激体外牙髓干细胞的增殖,对于一些需要进行牙髓血运重建的患儿联合应用抗生素具有很好的疗效[16,17]。A-PRF 膜内凝集的大量白细胞及生长因子也可以有效的治疗拔牙创伤等原因引起的干槽症[18]。Shivashankar 等[19]研究者对根尖周炎症的患者进行根尖周骨组织手术并将A-PRF 膜及羟基磷灰石应用于术中骨缺损处,术后观察治疗效果稳定,促进新骨生成。Chandradas 等[20]也同样应用A-PRF 膜治疗骨缺损时发现其改善了临床及放射影学参数。A-PRF 膜亦可促进上颌窦提升术窦底的骨组织愈合[21]。A-PRF 还常常应用于因慢性牙周炎牙齿拔除术后的位点保存,从而减轻牙槽骨吸收量。改良后的A-PRF 膜可以更多的释放生长因子促进种植体周围附着龈的生长,因此,无论是口腔种植、智齿拔除、外伤牙脱位,还是其他口腔颌面外科的有创创口,A-PRF 膜都能很好的促进牙龈组织及骨组织的愈合,为患者缩短疗程减轻术后反应。
综上所述,A-PRF 膜萃取液能够很好的促进牙龈成纤维细胞的增殖,并且OPG 的含量也相应有所增加,更加证实了A-PRF 膜在促进牙龈组织愈合及骨组织愈合具有很好的贡献。
