RASSF1 基因表达水平与肝癌的相关性及对细胞生理活动的作用
2022-07-09毛荷莲刘婷
毛荷莲 刘婷
肝癌作为发病率最高的肿瘤之一,其在中国的发病率和死亡率一直居高不下[1]。肝硬化以及慢性肝炎感染是肝癌发生发展的重要危险因素,肝癌的发病率与这些情况密切相关[2]。由于大多数肝癌患者诊断于肝功能不全的晚期,所以死亡率和肝癌发病率大致是相似的[3]。经过对肝癌的长期研究,尽管在肝癌患者的治疗方面取得了一定进展,包括肝切除和肝移植等。但由于肝癌进展迅速,且肝癌的早期诊断具有挑战性,大多数肝癌患者仍预后不良[4-6]。因此,提高早期肝癌患者检出率对于临床治疗肝癌具有重要意义,成为当前临床诊治和基础研究急需解决的难题,其难点在于寻找新的且有效的肝癌分子生物学标志。RASSF1基因在人类癌细胞的生长和发展过程中起着重要作用[7]。已有研究表明该基因参与细胞凋亡、细胞周期控制、微管稳定性调节和肿瘤抑制,且在其他研究中显示RASSF1 在暴露于E2 后可在各种癌症中沉默[8-11]。然而,当前鲜有对于RASSF1 基因与肝癌临床指征的相关性的研究。因此,本文选择应用RT-PCR 技术检测胃癌组织及相应癌旁组织中RASSF1表达量,并分析两者之间的相关性。随后,通过脂质体转染技术将沉默RASSF1 的siRNA、siRNA-NC、分别导入细胞内,采用CCK-8 实验、transwell 细胞迁移、侵袭实验检测各组细胞的增殖、迁移、侵袭能力。
1 资料与方法
1.1 一般资料 选取2014 年1 月~2019 年12 月期间本院收录的154 份肝癌病理组织样本,所有患者均经术后病理组织学检查明确其肝癌诊断。纳入标准:①符合肝癌的诊断标准;②患者初诊、手术之前并未接受任何抗肿瘤治疗,包括放疗,化疗等手段;③临床病理资料完整。排除标准:①具有家族遗传性疾病者;②合并其他肿瘤患者。本研究经医院伦理委员会批准,患者均签署知情同意书。
1.2 方法
1.2.1 RASSF1 表达水平的检测 通过RT-PCR 技术检测肝癌组织以及对应癌旁组织中RASSF1 表达量,并对结果进行分析。
实时检测荧光定量PCR,通过Trizol 法提取细胞总RNA,借逆转录试剂盒,将提取出的RNA 反转录为cDNA,以cDNA 为模板进行PCR 扩增,在PCR 仪中按反应条件为 95℃,30 s;95℃,5 s;60℃,30 s,共进行40 个反应循环。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,采用 2-ΔΔCt法计算目的基因相对表达量。实验重复3 次,取平均值。引物序列见表1。

表1 PCR 引物序列
1.2.2 细胞培养与传代 选取10%胎牛血清、双抗的高糖DMEM 培养基用于细胞培养液,将细胞培养在含5%CO2、37℃的细胞培养箱中。将细胞培养至细胞融合率达对数生长期即可进行传代。使用胰酶消化细胞后加入完全培养基重悬细胞,将细胞制成单细胞悬液,充分离心后弃上清,保留沉淀的细胞。加入完全培养基后用移液器吹打细胞使其散开。将单细胞悬液分别装入2~3 个细胞培养瓶中,置于细胞培养箱中常规培养。
1.2.3 细胞转染 将细胞制成单细胞悬液,随后将其接种于六孔板中,继续培养至细胞融合度达半数左右更换Opti-MEM 无血清培养基。将RASSF1 模拟物、以及无关对照序列分别稀释后按比例与Opti-MEM 培养基混匀,而后将lipo2000、质粒分别按比例与制好的Opti-MEM 混合液相混,一段时间后,将两者混匀后静置,然后将转染液缓慢加入相应的孔中。4~6 h 后更换为完全培养基,在细胞培养箱中继续常规培养。
1.2.4 CCK-8 实验 常规培养转染后细胞至对数生长期,制成单细胞悬液接种于96 孔板,继续常规培养24 h 后,加入CCK-8 反应液,在细胞培养箱中孵育1~2 h。在酶标仪上450 nm 处检测细胞的荧光表达量。
1.2.5 transwell 细胞迁移实验 取转染后处于对数生长期的各组细胞,使用胰酶消化,含1%FBS 的DMEM培养基重悬细胞,调整细胞密度。将transwell 小室放置于24 孔板中,先在小室中加入100 μl 单细胞悬液,在下层24 孔板中加入500 μl 完全培养基。培养48 h后取出小室,弃培养基,甲醛固定、结晶紫染色以及磷酸缓冲液(PBS)清洗小室后,使用倒置显微镜下观察其外层滤膜上的细胞,随机选取各小室5 个视野并计数。
1.2.6 transwell 细胞侵袭实验 取转染后处于对数生长期的各组细胞的单细胞悬液,在transwell 小室上铺好Matrigel 凝胶并放置于24 孔板中,上室加入单细胞悬液,下室加入完全培养基。培养48 h 后取出小室,弃培养基,甲醛固定、结晶紫染色以及PBS 清洗各小室后,将其倒置显微镜下观察其外层滤膜上的细胞,随机选取各小室5 个视野并计数。
1.3 统计学方法 采用SPSS25.0 统计学软件处理数据。计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 RASSF1 基因表达水平 RASSF1 在肝癌中高表达,且其表达水平明显低于癌旁组织。采用RT-PCR技术对肝癌组织及其对应癌旁组织中RASSF1 的表达水平进行检测,肝癌组织中RASSF1 表达水平低于癌旁组织。见图1A,图1B。
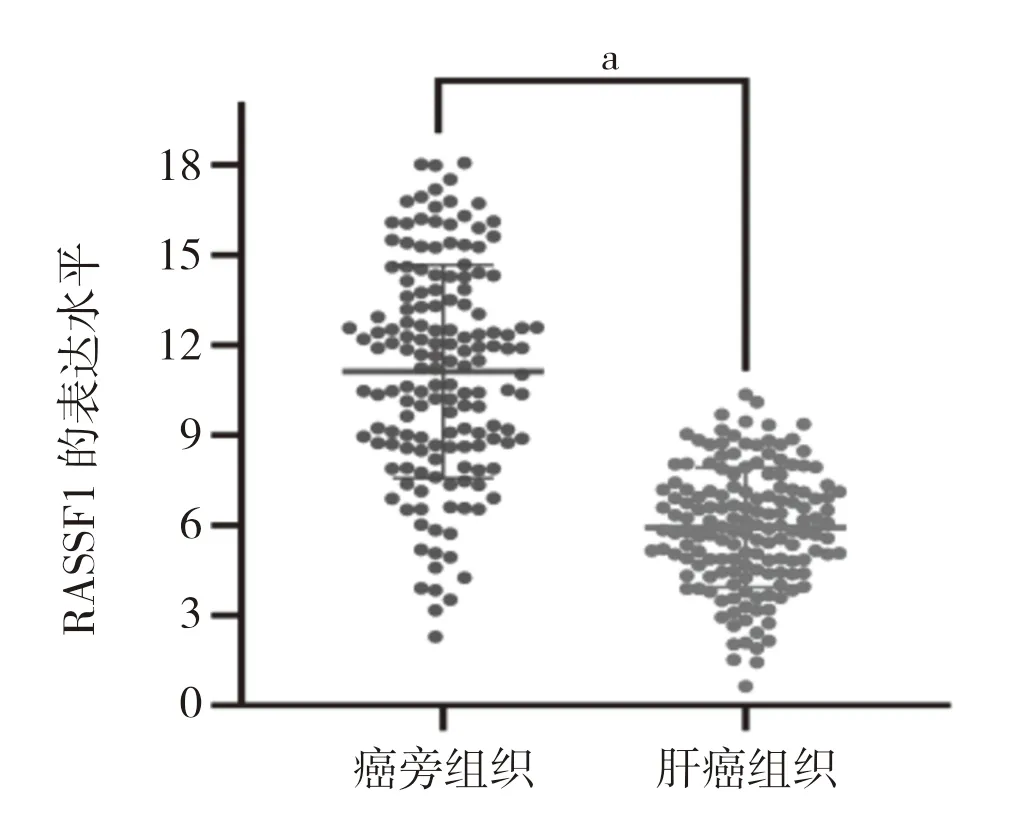
图1A RASSF1 基因表达水平离散图
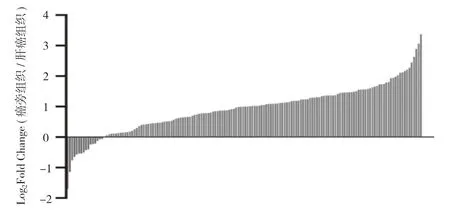
图1B RASSF1 基因表达水平柱形图
2.2 RASSF1 基因表达水平与临床特征相关性分析RASSF1 基因表达水平与肝癌肿瘤大小、病理分级、AJCC 临床分期相关(P<0.05),与患者的年龄、性别无明显相关性(P>0.05)。见表2。
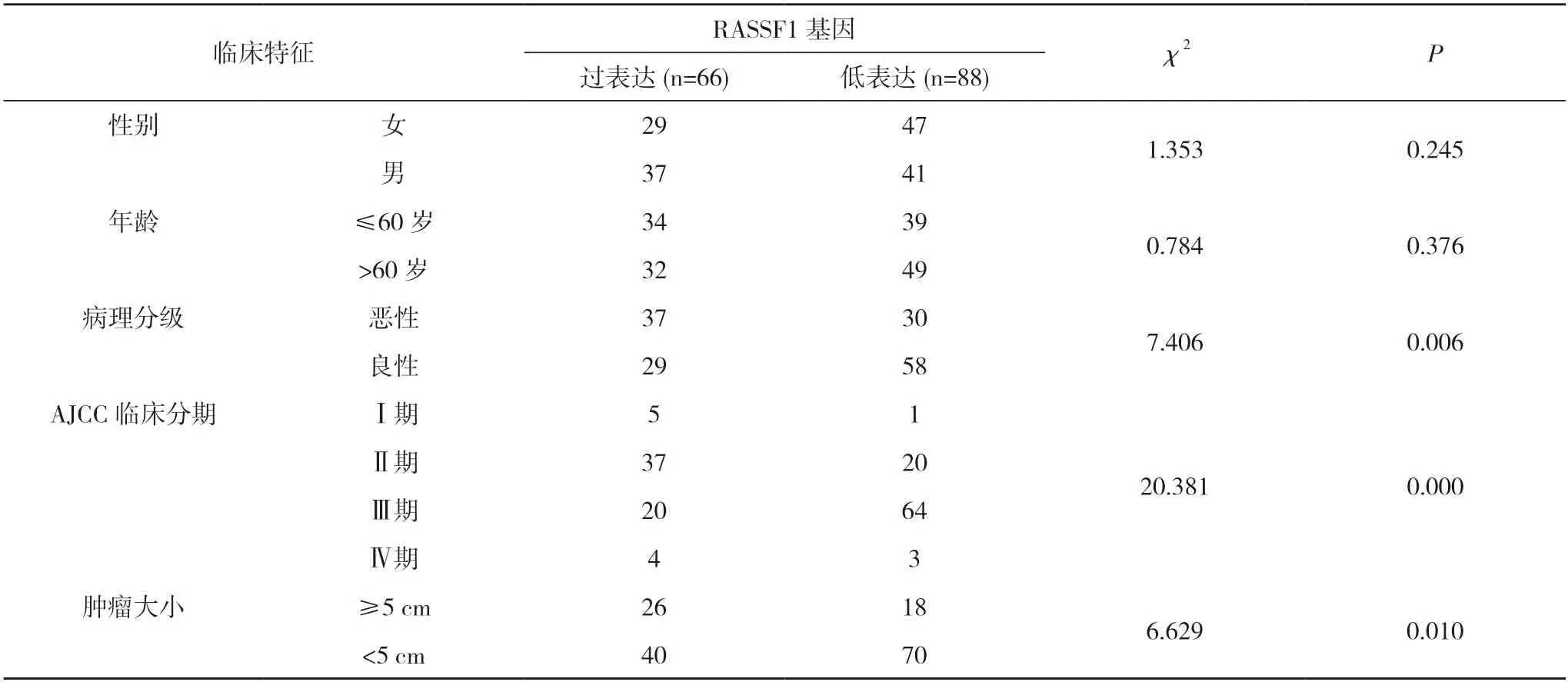
表2 RASSF1 基因表达水平与临床特征相关性分析(n)
2.3 RASSF1 表达水平对肝癌患者预后情况的影响将患者生存时间与聚合酶链式反应(PCR)检测结果比对分析,绘制患者的预后生存曲线。见图2。结果显示,低表达RASSF1 的肝癌患者预后较差,而高表达RASSF1 的肝癌患者普遍预后较好。表明RASSF1 表达水平与患者的预后存在明显相关。

图2 RASSF1 表达水平对肝癌患者预后生存曲线
2.4 RASSF1 低表达对细胞增殖、迁移、侵袭能力的影响 为探究RASSF1 与肝癌的关系,通过脂质体转染技术沉默肝癌LM3 细胞中RASSF1 的siRNA、siRNANC 分别导入至细胞内,应用CCK-8 实验、transwell 细胞迁移、侵袭实验分别对各类细胞的增殖、迁移、侵袭能力进行评估,结果显示,低表达细胞增殖OD 值为(1.45±0.19),高于对照细胞的(0.97±0.09),差异有统计学意义(P<0.05)。迁移实验中,低表达细胞穿膜细胞数为(683±45),高于对照细胞的(384±29),差异有统计学意义(P<0.05)。侵袭实验中,低表达细胞穿膜细胞数为(512±33),高于对照细胞的(291±12),差异有统计学意义(P<0.05)。证明低表达RASSF1 可以促使细胞增殖、迁移、侵袭能力增强。
3 讨论
原发性肝癌成为世界上第五大常见肝癌,具有高发病率的特征[12]。肝炎、脂肪肝和肝纤维化形成,都可能会最终发展为肝癌[13]。肝癌对于全球人类的健康造成威胁,2015 年,中国新发现并确诊了46.6 万例肝癌病例,其中有42.2 万例死亡[14]。由于早期肝癌的检出率不高,且大多数肝癌患者预后不良,使得当前有关寻找新的肝癌相关分子生物学标志的研究受到研究者们的高度重视。
RASSF1 基因最初是在使用XPA 作为诱饵的酵母双杂交筛选中鉴定的[15]。自从其在3 号染色体(3p21.3)上常见杂合性缺失的最小区域内被发现以来,作为候选抑癌基因位点受到了广泛的关注与研究。研究表明RASSF1 通过与MST1/2、LATS1、Sav1 和Mob1直接相互作用在rhBMP-2 治疗中起到关键作用[16]。且RASSF1 高甲基化作为乳腺癌的生物标志物可能与癌症的预后有关[9]。另有研究发现RASSF1 作为肿瘤抑制基因可诱导细胞周期停滞在G1期以此调控细胞衰老[10]。虽然RASSF1 被报道能够在多种癌症中沉默表达[8,11],然而,目前对于RASSF1 与肝癌相关性的研究鲜有报道。
本研究通过应用RT-PCR 技术检测临床肝癌组织标本以及癌旁组织中RASSF1 基因的表达量,分析该基因的表达与肝癌临床相关指标的统计学关联。研究结果显示,RASSF1 在肝癌组织中表达下调,且与患者肿瘤大小、病理分级、AJCC 临床分期有关。而后本研究从细胞层面上检测了肝癌细胞系与正常肝细胞中RASSF1 的表达量,结果显示肝癌细胞系中其表达量明显下降,说明RASSF1 的表达量对于肝癌的发生发展有重要意义。本研究采用脂质体转染技术构建低表达、其对照细胞系通过CCK-8、transwell 迁移实验及侵袭实验检测了各组细胞的增殖、迁移、侵袭能力。结果表明低表达RASSF1 可以促使细胞增殖、迁移、侵袭能力增强。
综上所述,RASSF1 具有成为肝癌早期诊断治疗的分子生物学标志的潜在价值。然而,对于RASSF1 高表达抑制肝癌的具体机制尚未明确,需要进一步的实验研究阐明其具体的分子机制。期望后续工作可以激励更多同行研究人员寻找用于早期诊断肝癌的分子生物学标志从而为治疗提供新的有效的分子靶点。
