基于缺氧诱导因子1信号通路治疗新型冠状病毒肺炎的潜在中药筛选及其机制研究
2022-07-09杨洋刘毓菲黄青松高培阳张传涛陈梅杨洪静王武军肖玮
杨洋,刘毓菲,黄青松,高培阳,张传涛▲,陈梅,杨洪静,王武军,肖玮
(1.成都中医药大学附属医院 呼吸科,四川 成都 610072;2.成都中医药大学附属医院 重症医学科,四川 成都 610072;3.成都市第五人民医院 呼吸科,四川 成都 611130)
新型冠状病毒肺炎(Coronavirus Disease 2019,COVID-19)是一种由急性呼吸道综合症冠状病毒2(Severe Acute Respiratory Syndrome Coronavirus 2,SARS-CoV-2)引起的高度传染性疾病[1]。病毒感染机体后会触发先天免疫应答系统,激活免疫细胞分泌大量细胞因子,从而抑制病毒复制,清除病原体[2]。但是炎症因子大量释放会造成“过度保护”,形成“细胞因子风暴(Cytokine Storm)”,损伤自身器官功能[3]。因此SARS-CoV-2感染后,有些患者临床症状为发热、咳嗽、乏力等,但也有患者可快速发展为急性呼吸窘迫综合征(Acute Respiratory Distress Syndrome,ARDS)、器官衰竭、脓毒血症、休克甚至死亡[4]。其中,缺氧是推进COVID-19病情加重的重要因素之一[5]。细胞因子、趋化因子激活后,大量聚集于肺部,损伤肺泡上皮细胞和肺毛细血管内皮细胞,屏障功能被破坏,造成肺泡水肿和黏液栓塞,影响通气功能,导致缺氧[6]。各种细胞对缺氧的反应会上调缺氧诱导因子1A(Hypoxia Inducible Factor-1A,HIF-1A)表达水平,一方面会增加细胞对缺氧的耐受,减缓凋亡,但另一方面也会继续诱导免疫细胞释放细胞因子,加重炎症[7]。因此,干预HIF-1信号通路可能为治疗COVID-19,减缓病情发展的方向之一。
COVID-19在中医理论中属于“疫病”范畴,中医药在治疗COVID-19过程中发挥重要作用,诸多临床研究证明,以“三药三方” 为代表的中成药和中药方剂[8-10]能够有效缓解COVID-19患者的临床症状,减缓病情发展,降低死亡率,临床总有效率高达90%[11]。虽然中药复方和中成药可以有效治疗COVID-19,但其具体机制尚不完全明确。网络药理学是基于多种数据库分析药物在治疗疾病过程中发挥作用的途径和靶点的生物信息学方法[12-14],还可以用于挖掘潜在的治疗药物[15-16]。本文将利用网络药理学方法通过HIF-1信号通路挖掘潜在的治疗中药及活性成分。
1 数据库及工具
京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库;GeneCards数据库[17](https://www.genecards.org/);基因间功能关联关系搜索工具(Search Tool for Recurring Instances of Neighbouring Genes,STRING)数据库[18](https://string-db.org/,Version 11.0);Cytoscape软件[19](Version 3.7.2);全球蛋白质资源数据库[20](Universal Protein Resource,UniProt,https://www.uniprot.org/);中药系统药理学数据库及分析平台[21](Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,https://tcmspw.com/tcmsp.php);蛋白质结构数据库[22](Protein Data Bank,PDB)(http://www1.rcsb.org/);有机小分子生物活性数据库(PubChem,https://pubchem.ncbi.nlm.nih.gov/);化学结构式画图软件(ChemBio3D);三维分子结构软件(PyMOL);分子对接软件(AutoDockTools 1.5.6;AutoDock Vina)。
2 方法
2.1 HIF-1信号通路相关基因的搜集
以“ko04066:HIF-1 signal pathway”在KEGG数据库检索HIF-1信号通路,下载相关基因名称及通路图,并以“HIF-1 signal pathway”为关键词在GeneCards数据库检索进行补充。
2.2 PPI网络构建及关键模块筛选
将HIF-1信号通路上的基因导入STRING数据库,进行蛋白质-蛋白质相互作用(Protein Protein Interaction,PPI)网络构建,物种选择“Homo Sapiens”,阈值选择“Medium Confidence”,网络显示选项选择“Hide Disconnected Nodes in the Network”,并下载TSV文件。将TSV文件导入Cytoscape软件,使用cytoNCA插件进行拓扑分析,以度值(Degree)、介数(Betweenness Centrality,BC)、中心性(Closeness Centrality,CC)和特征向量(Eigenvector,EC)均大于中位数筛选核心基因,并根据Degree和连接强度(Combined Score)调整网络展示效果。
2.3 潜在治疗活性成分及中药预测
将核心基因上传至Uniprot数据库进行基因-蛋白映射,并将匹配的蛋白靶标上传至中药系统药理学数据库及分析平台,检索内容选择“Target name”,根据口服生物利用度(Oral bioavailability,OB)≥30%,类药性(Drug-likeness,DL)≥0.18筛选活性成分。保存每个蛋白对应活性成分的MOL号和相关中药,导入Cytoscape软件构建基因-活性成分-中药作用网络,使用其内置工具Network Analyzer工具计算各个节点的Degree。
2.4 分子对接
在PubChem数据库下载Degree前五活性成分的SDF文件,在PDB 数据库下载核心基因蛋白的3D结构,运用ChemBio3D软件和PyMOL软件对化合物和蛋白质进行处理,然后利用AutoDockTools1.5.6及AutoDock Vina软件进行分子对接。分子对接结果中结合能越小提示结合强度越高。
3 结果
3.1 HIF-1信号通路相关基因
在KEGG数据库下载HIF-1信号通路图(见图1),在KEGG数据库和Genecards数据库共获得相关基因126个。

图1 HIF-1信号通路图
3.2 PPI网络构建及关键基因筛选
将HIF-1信号通路上的基因上传至STRING数据库进行PPI网络构建,获得一个节点数(Number of Nodes)为126(包含2个游离节点),边数(Number of Edges)为1815的网络。运用CytoNCA插件拓扑分析,获得GAPDH、AKT1、EGFR、VEGFA、MAPK1、HIF1A等44个核心基因(见图2)。
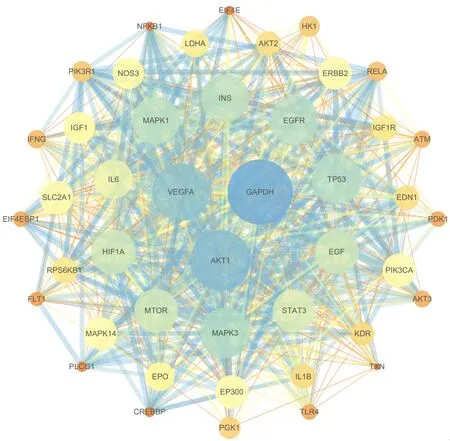
图2 HIF-1信号通路相关基因PPI网络核心
3.3 根据HIF-1信号通路核心基因预测潜在治疗活性成分及中药
将44个核心基因上传至Uniprot数据库进行基因-蛋白映射,并将匹配的蛋白靶点上传至TCMSP数据库,共有16个蛋白靶点对应的活性成分符合OB≥30%,DL≥0.18。共检索到233个活性成分,对应439种中药。将这些基因对应的活性成分和中药导入Cytoscape软件,构建中药-活性成分-基因网络图,并用Network Analyzer工具计算各个节点的Degree。由于部分中药仅对应单一活性成分及靶点,考虑到多靶点为中药作用特点,因此保留Degree≥3的中药及活性成分(见图3)。以Degree排序,排名前三的活性成分Degree远高于其他,依次为槲皮素(Quercetin,MOL000098)、山奈酚(Kaempferol,MOL000422)、木犀草素(Luteolin,MOL000006)见表1;排名前五的中药为余甘子、白果、枇杷叶、红花、苦参,均包含至少4个活性成分,作用至少10个核心基因,具体见表2。

图3 中药-活性成分-基因网络图

表1 基因-活性成分-中药网络中排名前五活性成分

表2 基因-活性成分-中药网络中排名前十中药
3.4 分子对接
所有对接结果均<-6 kcal/mol,说明有较强的结合强度(见图4)。运用PyMOL 软件对AKT1、MAPK1、HIF1A、VEGFA四个基因结合活性最高的结果进行可视化(见图5)。

图4 分子对接结果

图5 分子对接结果展示
4 讨论
SARS-CoV-2感染后,先天免疫系统激活,多种细胞因子释放以助于清除病毒[20]。但是,过量的细胞因子可使保护性的免疫应答转变成破坏性的免疫反应,造成严重的肺部炎症和肺水肿,导致呼吸困难、低氧血症甚至死亡[15]。缺氧反应是先天免疫应答形成的一种微环境特性,即是免疫应答的结果,又可以激活HIF-1A,调节白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)等细胞因子,参与和促进炎症反应[23],形成恶性循环。因此,本文选取HIF-1信号通路作为治疗COVID-19药物预测的靶点。
利用TCMSP数据库,根据OB≥30%和DL≥0.18为条件共筛选出233种活性成分,对应439种中药。但是预测出的中药部分包含的活性成分及作用的靶点较少,因此本文进一步根据Degree对中药进行筛选,中药Degree越高,说明包含的活性成分及作用的靶点越重要,越能有效调控HIF-1信号通路。最终筛选出以槲皮素、山奈酚、木犀草素等为代表的活性成分,以余甘子、白果、枇杷叶、红花、苦参等为代表的中药。
槲皮素、山奈酚和木犀草素为广泛存在于自然界的黄酮类活性成分,具有抗炎、抗缺血再灌注损伤、抗氧化应激损伤、改善内皮功能等作用[24-26]。研究表明,槲皮素能够有效保护缺氧心肌细胞,减轻损伤程度[27],还能通过调节HIF-1信号通路起到脑保护作用[28],并促进缺氧缺血性脑损伤新生大鼠的神经再生[29]。山奈酚能够通过激活mTOR通路促进缺氧心肌细胞增殖,抑制缺氧心肌细胞凋亡,降低活性氧水平和抑制自噬[30],还能够在缺氧条件下抑制丝裂原活化蛋白激酶(MAPK)和HIF-1活性,从而有效地抑制肝癌细胞的存活[31]。木犀草素可用于食品抗氧化剂,可减少活性氧的积累,防止曲霉素诱导的氧化应激作用,并能通过HIF-1信号通路促进血管生成和上皮恢复[32]。在对“三方三药”的研究中,槲皮素、山奈酚和木犀草素均为高频有效活性成分[33-38],与3CL水解酶及ACE2受体具有良好结合活性,能够有效抑制SARS-COV-2与ACE2蛋白结合,起到治疗COVID-19的作用。
COVID-19临床主要表现为发热、干咳、乏力,伴恶心、呕吐、便溏、腹泻等消化系统症状,舌苔多厚腻。中医认为,COVID-19当以湿毒疫论治[39]。本研究构建的基因-活性成分-中药网络中Degree较高的中药多归肺、胃、肝、大肠经,功效主要偏于清热、止咳、和胃、凉血,与COVID-19临床症状相符,可能为治疗COVID-19的潜在中药。余甘子属大戟科叶下珠属植物,归肺、胃经,具有清热凉血,消食健胃,生津止咳的作用。研究证明,余甘子能够提高小鼠在缺氧环境中的运动能力,对脑缺血缺氧具有保护作用[40],还能够能降低缺氧引起的肺动脉高压、右室高压和减轻右室肥厚[41]。白果系银杏科植物,归肺、肾经,具有敛肺气,定喘嗽,止带浊,缩小便的功效。动物实验证明,白果注射液能显著降低缺氧性肺动脉高压和血中一氧化氮水平,起到保护作用[42]。枇杷叶为蔷薇科植物枇杷的干燥叶,归肺、胃经,具有清肺止咳,降逆止呕的功效。枇杷叶是临床治疗肺系疾病的常用药物,多用来治疗肺热咳嗽、痰湿蕴肺[43-44],药理研究证明,枇杷叶具有抗炎、抗氧化应激的作用[45]。红花属菊科植物,归心、肝经,具有活血通经,散瘀止痛的功效。研究证明,红花可以通过调节pVHL/HIF-1α/VEGF信号通路增强血管生成,从而促进成骨分化[46],还可以抑制HIF-1α及Caspase-3蛋白的表达,减少神经元的凋亡,起到对脑缺血再灌注损伤的保护作用。苦参是豆科、槐属草本或亚灌木植物,归心、肝、胃、大肠、膀胱经,具有清热燥湿,杀虫,利尿的功效。苦参碱对HIF-1A具有抑制作用,且随浓度升高而增强,能够减轻低氧条件下的炎症反应,并能促进细胞外基质重塑[47]。
综上所述,通过网络药理学对HIF-1信号通路相关基因的分析和潜在活性成分和中药的挖掘,发现槲皮素、山奈酚、木犀草素等活性成分,及余甘子、白果、枇杷叶、红花、苦参等中药可以发挥抗缺氧、抗炎、减轻缺氧损伤和促进血管、上皮重塑的作用,为进一步探索治疗COVID-19的有效药物提功了理论依据。但是,本研究仅仅是利用公共数据库进行筛选预测,由于中药成分复杂,作用基因繁多,目前相关数据库尚不完善,因此结果可能存在偏差,还需临床试验来验证这些药物的治疗效果。
