不同因子对兰州百合组培小鳞茎诱导及膨大的影响研究
2022-07-09牛慧婷杨道兰冯炜弘尹燕李爱兵王璐何潇
牛慧婷 杨道兰 冯炜弘 尹燕 李爱兵 王璐 何潇



摘要:为了缩短兰州百合生长周期,提高百合品质,以兰州百合组培小鳞茎为材料,研究了大量元素、NAA、6-BA、培养基状态、蔗糖、2,4-D等单一因素对百合试管鳞茎形成和膨大的影响。结果表明,高浓度的大量元素有利于鳞茎的膨大,而不利于鳞茎的诱导;大量元素浓度为2MS时鳞茎平均直径最大,但新增鳞茎数下降到4.56个;NAA浓度为0.2 mg/L时新增鳞茎数最多且鳞茎平均直径最大;6-BA浓度为0.1 mg/L时最有利于鳞茎的形成和膨大,新增鳞茎数5.25个,鳞茎平均直径10.642 mm;固体培养基对鳞茎的形成效果明显,而半固体更有利于鳞茎的膨大;蔗糖浓度为90 g/L时新增鳞茎数最多,120 g/L时鳞茎平均直径最大;2,4-D浓度0.02 mg/L处理对鳞茎的形成和膨大效果更好。
关键词:兰州百合;试管鳞茎;组织培养;膨大
中图分类号:S152 文献标志码:A 文章编号:1001-1463(2022)06-0066-06
doi:10.3969/j.issn.1001-1463.2022.06.016
Effects of Different Factors on Bulblet Induction and Enlargement in
Lanzhou Lily Bulb Tissue Cultivation
NIU Huiting, YANG Daolan, FENG Weihong, YIN Yan, LI Aibing, WANG Lu, HE Xiao
(Lanzhou Agricultural Science and Technology Research Extension Centre, Lanzhou Gansu 730000, China)
Abstract: To reduce the growth period and to improve the quality of Lanzhou lily bulb, the effects of mass elements, NAA, 6-BA, medium status, sucrose and 2,4-D concentration on the formation and enlargement of small bulb of Lanzhou lily in vitro were studied. Results showed that high concentration of macro elements was beneficial to the enlargement of bulbs, but not to the induction of bulbs, the bulb diameter reached the maximum at 2MS, but the number of newly grown bulbs decreased to 4.56. When NAA concentration was 0.2 mg/L, the number of new bulbs and the bulb diameter were the highest. When 6-BA concentration was 0.1 mg/L, it was most beneficial to the formation and enlargement of bulbs, the number of new bulbs was 5.25 and the diameter of bulbs was 10.642 mg. Solid medium showed obvious effect on bulb formation, while semi-solid medium was more beneficial to bulb enlargement. When sucrose concentration was 90 g/L, the number of newly grown bulbs was the highest, the bulb diameter was the largest when sucrose concentration was 120 g/L. 0.02 mg/L 2,4-D showed better effect on bulb formation and enlargement.
Key words: Lanzhou lilybulb; Test-tube bulb; Tissue culture; Enlarge
蘭州百合(Lilium davidii Var. unicolor)是百合科百合属川百合的变种,多年生鳞茎草本植物[1 ]。兰州百合作为甘肃省兰州市的名优特产,也是中国国家地理标志产品,个头大,鳞茎洁白如玉,味极甜美,肉质细腻,含有丰富的蛋白质、糖类、矿物盐和果胶[2 ],具有极高的观赏、食用和保健价值,是全国唯一能够食用的甜百合[3 - 8 ]。
鳞茎是百合用于繁殖和药用的重要器官,研究发现,组织培养可增大鳞茎的直径与鲜重,对组培苗移栽的成活率高低以及生长状况有着明显的影响[9 - 10 ]。近年来,有不少学者对促进百合鳞茎膨大的方法进行了研究,如张彦妮等[9 ]以毛百合无菌苗为试验材料,研究了激素种类及质量浓度、活性炭浓度、蔗糖浓度对试管鳞茎膨大的影响及适宜移栽的鳞茎大小;张洁等[11 ]以东方百合试管苗为材料,研究了蔗糖浓度、大量元素、培养基状态、多效唑和水杨酸浓度对试管鳞茎诱导和膨大的影响;秦新惠等[12 ]以新鲜兰州百合为试验材料,研究了单一的活性炭、蔗糖、PP333和水杨酸以及多因子对小鳞茎膨大的影响。但是,鲜少有学者研究大量元素、NAA、6-BA等不同浓度对兰州百合组培小鳞茎形成和膨大的影响。多年来,兰州百合面临的问题是生产周期长、产量低,长期采用无性繁殖的方法扩大繁育,导致种球自然退化或异化,引起品质下降,很难满足兰州百合产业化生产的需求[13 ]。为此,我们以兰州百合鳞片为外植体组培而成的小鳞茎为试验材料,采用蔗糖浓度、大量元素、不同激素种类及浓度以及培养基状态等多个单因素,研究了促进百合鳞茎膨大的方法,旨在缩短兰州百合生长周期,提高百合品质,为兰州百合产业化发展提供参考[13 ]。
1 材料与方法
1.1 试验材料
兰州百合种球于2020年1月从兰州市七里河区西果园镇百合试验田采集,试验选用外形饱满、颜色洁白、健壮无病虫害的三年生兰州百合鳞茎,用蘭州百合鳞片为外植体组培而成的小鳞茎作为供试材料。
1.2 试验方法
剥去兰州百合最外层鳞片后,选取第2~4层的鳞片,在无菌操作台上将鳞片中下部位切成约1 cm×1 cm小块,接种在诱导培养基(MS+6-BA 1.0 mg/L+ NAA 0.1 mg/L+蔗糖45 g/L)上,50 d后得到较多的小鳞芽。将诱导出的小鳞芽再通过增殖培养基(MS+6-BA 1.0 mg/L +NAA 0.2 mg/L+蔗糖85 g/L)培养,至小鳞茎的单芽基部直径长至0.5~0.7 cm,将其分割成单个小鳞茎,去除上部叶片和根,分别接种于附加不同添加物种类及浓度(大量元素、NAA、6-BA、培养基状态、蔗糖、2,4-D)的鳞茎膨大培养基上。其中NAA、6-BA、培养基状态、蔗糖、2,4-D均以MS为基本培养基,大量元素、NAA、6-BA、蔗糖、2,4-D均附加琼脂4.0 g/L,培养基pH均为5.8。培养基于121 ℃高压灭菌锅中灭菌20 min取出。组培室温度为(25±2) ℃,光照强度为1 600 lx,光照时间为14 h/d。每个处理接种5瓶,每瓶3~7个小鳞茎,重复3次。培养90 d。
1.3 鳞茎膨大培养基
1.3.1 大量元素培养基 设1/4MS、1/2MS、MS(对照)、3/2MS、2MS共5个浓度梯度,并附加6-BA 0.5 mg/L、NAA 0.1 mg/L和蔗糖90 g/L。
1.3.2 添加不同浓度NAA培养基 在培养基MS + 6-BA 0.5 mg/L +蔗糖90 g/L中,分别添加0(对照)、0.1、0.2、0.3、0.4 mg/L NAA。
1.3.3 添加不同浓度6-BA培养基 在培养基MS+ NAA 0.1 mg/L+蔗糖90 g/L中,分别添加0(对照)、0.1、0.5、1.0、2.0 mg/L 6-BA。
1.3.4 不同状态培养基 在MS+6-BA 0.5 mg/L + NAA0.1 mg/L+ 蔗糖90 g/L的培养基中,分别添加4.0 g/L琼脂(固体培养基)、2.0 g/L琼脂(半固体培养基)、固体培养基上层注入5 mL液体培养基(液体培养基)和不加琼脂(固液培养基)。
1.3.5 添加不同浓度蔗糖 在培养基MS+6-BA 0.5 mg/L +NAA 0.1 mg/L中,分别添加30(对照)、60、90、120、150 g/L蔗糖。
1.3.6 添加不同浓度2,4-D 在培养基MS+0.5 mg/L 6-BA+0.1 mg/L NAA+90 g/L中,分别添加0(对照)、0.01、0.02、0.03、0.04 mg/L 2,4-D。
1.4 测定项目及方法
培养90 d后,剪去小鳞茎的叶片及根,统计新增鳞茎数、鳞茎的直径及鳞茎直径增大倍数等相关指标,同时观察试管苗叶片和根系生长状况。用经高压灭菌锅灭菌的游标卡尺测量鳞茎直径。
直径增大倍数=鳞茎直径/接种时鳞茎直径。
1.5 数据处理
数据通过Microsoft Excel和SPSS(13.0) 软件进行统计分析。
2 结果与分析
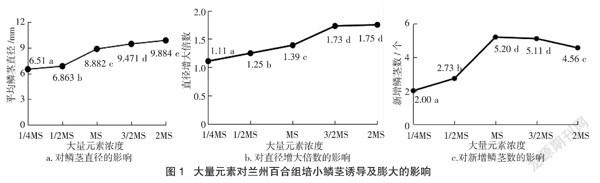
2.1 大量元素对兰州百合组培小鳞茎诱导及膨大的影响
由图1可知,随着大量元素浓度的提高,鳞茎平均直径与直径增大倍数呈明显上升趋势,而新增鳞茎数呈先增后减的趋势。大量元素浓度低于对照(MS)时,不利于小鳞茎的膨大和诱导。大量元素为1/4 MS时,基本无叶片,鳞茎平均直径为6.51 mm,直径增大倍数为1.11倍,新增鳞茎数为2个。大量元素为1/2 MS时,有少量叶片,长势较弱,鳞茎平均直径、直径增大倍数及新增鳞茎数均显著低于对照(MS)。当大量元素浓度大于对照(MS)时,试管苗叶片均长势良好,且有利于百合鳞茎的膨大,但会抑制鳞茎的诱导。大量元素为3/2 MS时,鳞茎平均直径为9.471 mm;新增鳞茎数为5.11个,与对照(MS)差异不显著。大量元素为2 MS时鳞茎平均直径最大,为9.884 mm;直径增大倍数最高,为1.75倍;新增鳞茎数为4.56个,显著低于对照(MS)。说明大量元素过低,既不利于鳞茎的诱导也不利于膨大,而大量元素浓度过高则不利于鳞茎的诱导,但对鳞茎的膨大有明显的促进作用。
2.2 NAA对兰州百合组培小鳞茎诱导及膨大的影响
在培养基中适量加入NAA,可以促进鳞茎的形成和膨大,且鳞茎平均直径和直径增大倍数各处理间差异显著(图2)。当NAA浓度为0.1 mg/L时,直径增大倍数最大,为1.68倍;叶片数目不多,长势良好。当NAA浓度为0.2 mg/L时,鳞茎平均直径最大,为8.806 mm;新增鳞茎数最多,为6.00个;根系及叶片均生长良好。当NAA浓度大于0.2 mg/L时,鳞茎平均直径、直径增大倍数及新增鳞茎数都明显下降,叶片数目减少以及根系长势变弱。综合考虑,NAA浓度为0.2 mg/L时最适宜促进兰州百合鳞茎形成与膨大。
2.3 6-BA对兰州百合组培小鳞茎诱导及膨大的影响
不同浓度的NAA对鳞茎平均直径、新增鳞茎数的影响差异均显著。随着6-BA浓度的增加,鳞茎平均直径与新增鳞茎数均呈先增加后减少的趋势,而直径增大倍数则呈逐渐下降趋势(图3)。当6-BA浓度为0 mg/L时,鳞茎平均直径增大倍数最大,为1.66倍。当6-BA浓度为0.1 mg/L时,鳞茎平均直径最大,为10.642 mm,新增鳞茎数最多,为5.25个,略高于对照,且叶片数目较多,根系长势良好。当6-BA浓度大于0.1 mg/L时,随着质量浓度的增加,鳞茎平均直径、直径增大倍数及平均新增鳞茎数均明显下降,叶片数目减少,根系长势较弱。说明低浓度的6-BA更有利于鳞茎的形成、膨大、生根及试管苗生长,而6-BA浓度过高则抑制鳞茎的形成和膨大,也不利于试管苗生长。因此,6-BA浓度为0.1 mg/L时最适宜兰州百合鳞茎的形成与膨大。
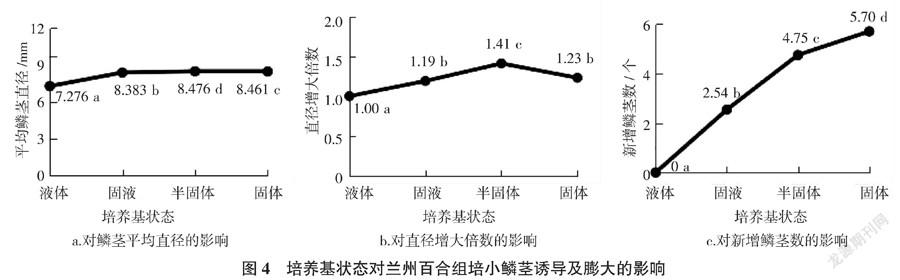
2.4 培养基状态对兰州百合组培小鳞茎诱导及膨大的影响
由图4可知,培养基为半固体时,鳞茎平均直径最大,为8.476 mm,直径增大倍数最大,为1.41倍。当培养基为固液和固体时,鳞茎平均直径分别为8.383 mm和8.461 mm,直径增大倍数分别为1.19倍和1.23倍,均显著低于半固体培养基。新增鳞茎数以固体培养基最多,为5.70个。液体培养基对鳞茎的形成和膨大均无促进作用,可能由于鳞茎长期处于液体状态下缺氧导致死亡。综合考虑,半固体培养基更适用于兰州百合鳞茎的形成和膨大。
2.5 蔗糖对兰州百合小鳞茎膨大的影响
由图5可看出,蔗糖浓度不同,对鳞茎平均直径、新增鳞茎数的影响均有显著性差异。随着蔗糖浓度的增加,鳞茎的平均直径、直径增大倍数、新增鳞茎数均呈增加后减少的趋势。当蔗糖浓度30、60 g/L时,试管苗长势好,叶多浓绿,但鳞茎的形成和膨大效果不佳。当蔗糖浓度90 g/L时,新增鳞茎数最多,为8.17个。当蔗糖浓度120 g/L时,鳞茎的直径和增大倍数均达到最大,鳞茎的直径为9.912 mm,增大了1.63倍,叶片很少,大部分的营养都用于鳞茎的膨大。当蔗糖浓度为150 g/L时,基本无叶片,根系细弱,新增鳞茎数、鳞茎平均直径及直径增大倍数明显减少。说明蔗糖浓度为90 g/L时有利于兰州百合鳞茎的诱导形成;蔗糖浓度为120 g/L时,更有利于兰州百合鳞茎的膨大。从成本考虑,在生产中蔗糖浓度以90 g/L為宜。
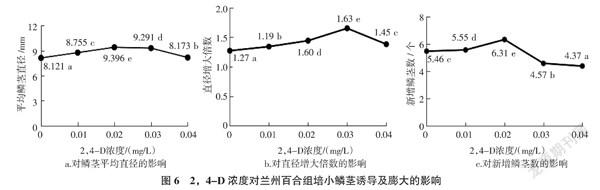
2.6 2,4-D对兰州百合组培小鳞茎诱导及膨大的影响
随着2,4-D浓度的增加,鳞茎平均直径、直径增大倍数及新增鳞茎数均呈先增加后减少的趋势,且各处理间均有显著性差异(图6)。当2,4-D浓度低于0.02 mg/L时,叶片少,叶色黄绿,鳞茎的膨大效果不佳。当2,4-D浓度为0.02、0.03 mg/L时,试管苗的长势均良好。其中,当浓度为0.02 mg/L时,鳞茎平均直径最大,为9.396 mm,新增鳞茎数最多,为6.31个。当浓度为0.03 mg/L时,直径增大倍数达最大(1.65倍);鳞茎平均直径和新增鳞茎数均低于添加 0.02 mg/L 2,4-D的培养基。当2,4-D浓度为0.04 mg/L时,鳞茎平均直径、直径增大倍数和新增鳞茎数明显减少,叶片呈淡黄绿色,苗长势弱。说明适当加入2,4-D有利于百合鳞茎的形成和膨大,较低浓度和较高浓度都不利于百合的诱导形成和膨大。综合考虑,2,4-D浓度为0.02 mg/L时适宜兰州百合鳞茎的形成和膨大。
3 小结与讨论
对影响兰州百合小鳞茎形成及膨大的多个单因素进行研究,以明确大量元素、NAA、6-BA、蔗糖、2,4-D浓度及培养基状态,促进百合试管鳞茎新增鳞茎数的增加和鳞茎平均直径膨大。结果表明,高浓度的大量元素有利于鳞茎的膨大,而不利于鳞茎的诱导。大量元素浓度2MS时鳞茎平均直径最大,但新增鳞茎数下降到4.56个。NAA浓度为0.2 mg/L时新增鳞茎数最多且鳞茎平均直径最大。6-BA浓度为0.1 mg/L时最有利于鳞茎的形成和膨大,新增鳞茎数5.25个,鳞茎平均直径10.642 mm。固体培养基对鳞茎的形成效果明显,而半固体更有利于鳞茎的膨大。蔗糖浓度为90 g/L时新增鳞茎数最多,蔗糖浓度为120 g/L时鳞茎平均直径最大。2,4-D浓度为0.02 mg/L处理对鳞茎的形成和膨大效果更好。
高浓度的大量元素对兰州百合鳞茎的膨大效果好,但对百合鳞茎的诱导效果不佳。当大量元素2MS时形成的鳞茎最大,而新增鳞茎数减少,这与张洁等[11 ]对百合鳞茎的研究结果相似。适当的激素浓度可以促进百合鳞茎的形成和膨大。研究表明,最适宜兰州百合鳞茎形成和膨大的6-BA和NAA浓度分别为0.1 mg/L和0.2 mg/L。张延龙等[14 ]研究发现,当NAA浓度为0.5 mg/L时,东方百合鳞茎的直径和鲜重最大,当大于0.5 mg/L时,鳞茎的直径和鲜重均有所下降,可见,较低浓度的NAA和6-BA更有利于百合鳞茎的形成和膨大,而植物种类和品种不同,其适宜的浓度也有所差异。不同的培养基状态对兰州百合鳞茎的形成和膨大的影响也有所不同。研究结果显示,半固体培养基状态下,鳞茎膨大效果最好。在液体培养基中兰州百合鳞茎处于完全不生长状态。这一结果与张洁等[11 ]对东方百合试管鳞茎的形成和膨大的研究及Niim i等 [14 ]对红点百合在液体培养基中前8~12周的亚培养对小鳞茎的膨大发育的研究结果不尽相同,可能是百合品种不同或因本试验中操作不当引起的,具体原因有待进一步研究。蔗糖浓度对百合鳞茎的形成、直径和鲜重有着直接的影响。当蔗糖浓度为120 g/L时,鳞茎平均直径最大;但当蔗糖浓度高达150 g/L时,又会抑制鳞茎的膨大和形成。这与张延龙[15 ]、王家福等[16 ] 、裴怀弟[13 ]对百合鳞茎的研究基本一致,适当的蔗糖浓度有利于百合鳞茎的形成和膨大。2,4-D作为一种植物生长调节剂,对百合鳞茎的形成及直径大小有着一定的影响。本试验结果表明,当培养基中添加2,4-D浓度为0.02 mg/L时,对兰州百合鳞茎的直径膨大及新增鳞茎效果最好,当其浓度大于0.02 mg/L时,鳞茎的直径和新增鳞茎数明显下降,可见适宜的2,4-D浓度对百合鳞茎形成和膨大有良好的促进作用。本文仅对影响兰州百合组培小鳞茎形成诱导及膨大的6个单因素进行了研究,对综合优化的6个因素组合培养基下鳞茎膨大的效果尚待研究。
参考文献:
[1] 林玉红. 气温对兰州百合鳞茎粗淀粉累积含量的影响[J]. 甘肃农业科技, 2022,53(1):68-72.
[2] 李红娟. 卷丹百合营养成分、活性物质及栽培特性的研究[J]. 西北农林科技大学学报,2007(6):15-17.
[3] 李瑞琴,于安芬,陶海霞,等. 兰州百合干中的二氧化硫本底值研究[J]. 甘肃农业科技,2021, 52(2):41-44.
[4] 王康才. 百合栽培新技术[M]. 北京:中国农业出版社,1999.
[5] 徐 岩. 兰州百合引种及其栽培措施对生长特性和品质的影响[D]. 长春:吉林农业大学,2013.
[6] 王生林,王明霞. 兰州百合产业发展的思考与对策[J]. 甘肃农业大学学报,2002,37(1):82-87.
[7] 张德纯. 甘肃兰州百合[J]. 中国蔬菜,2020(10):41.
[8] 孔宪武. 兰州植物通志[M]. 兰州:甘肃人民出版社,1958.
[9] 张彦妮,李兆婷,张艳波,等. 毛百合试管鳞茎形成和膨大的培养优化[J]. 江苏农业科学,2016,44(4):74-78.
[10] 王爱勤,何龙飞,周 琼,等. 百合试管苗的移栽对比试验[J]. 广西农业生物科学,1999(3):187-190.
[11] 张 洁,蔡萱梅,林 真,等. 百合试管鳞茎诱导及膨大技术的研究[J]. 福建农业学报,2010,25(3):328-331.
[12] 秦新惠,崔兴林,陈学红,等. 不同因子对兰州百合组培小鳞茎膨大的影响研究[J]. 林业科技通讯,2015(12):44-47.
[13] 裴怀弟,林玉红,李淑洁,等. 兰州百合组培小鳞茎诱导技术研究[J]. 甘肃农业科技,2019(7):29-32.
[14]NIIMIY,MISAKIY,NAKANOM. Production of commercial bulbs of Lilium rubellum baker:Changes in carbohydrates in bulblets and sugars of liquid medium during their culture[J]. Journal of the Japanese Society for Horticultural Science,2000,69(2):161-165.
[15] 張延龙,梁建丽,牛立新. 东方百合试管鳞茎膨大的研究[J]. 西北农林科技大学学报,2006,34(6):75-78.
[16] 王家福,陈振光. 百合快速繁殖条件的优化[J]. 福建农业大学学报,1999,28(2):152-156.
收稿日期:2021 - 12 - 28;修订日期:2022 - 02 - 26
基金项目:兰州市人才创新创业项目(2020-RC-144)。
作者简介:牛慧婷(1991 — ),女,甘肃永登人,助理农艺师,研究方向为农产品贮藏与加工。Email:1017943093@qq.com。
通信作者:杨道兰(1970 — ),女,甘肃皋兰人,高级农艺师,主要研究方向为蔬菜育种。Email:875516380@qq.com。
