微波超声协同提取白刺果原花青素工艺及抗氧化性研究
2022-07-08只德贤李建颖
只德贤,张 妮,李建颖
(天津商业大学生物技术与食品科学学院,国家级食品与药品实验教学示范中心,天津 300134)
白刺(Nitraria tangutorumBobr.)为蒺藜科白刺属植物,广泛分布于我国新疆、青海、内蒙古、甘肃等地,是旱生植物,对生长环境的适应性强,已成为荒漠区、风沙地区优势植物,可以防风固沙,维护荒漠生态稳定[1]。白刺植物具有较高的应用价值,营养丰富,富含多糖、氨基酸、挥发油、黄酮类、酚类、生物碱等多种有效成分[2]。现代药理学研究表明,白刺具有降血糖[3−4]、降血压[5]、抑制肿瘤生长、抗氧化[6]、调节机体免疫、抗疲劳[7]及神经保护[8]等作用。原花青素(proanthocyanidin,PC),是有着特殊结构的生物类黄酮混合物,分为低聚和高聚原花青素[9],主要存在于植物的果皮、果实和种子中。原花青素有保护血管、降血脂[10]、改善胃肠功能[11]和认知障碍[12]等作用。原花青素还被称为“天然抗氧化剂”,它可以有效地清除人体内的自由基[13−14],其清除DPPH 自由基、羟自由基的能力均高于VC和VE[15−16]。
目前,从植物中提取原花青素的方法有萃取法[17]、超临界提取法、超声辅助提取法、微波辅助提取法和酶辅助提取法等[18]。超声波可以加速细胞壁的破裂,使细胞内的成分充分进入到溶剂中,超声辅助提取可以有效地缩短提取时间,提高提取效率[19];微波可以使物体局部受热,加速目标成分的溶出,微波辅助提取能够节约溶剂,缩短提取时间,避免因提取时间过长造成目标成分的分解[20]。魏文慧等[21]采用超声-微波协同法对酒花残渣中的原花青素进行提取,发现原花青素的提取率显著高于超声波提取法或微波提取法,而微波超声协同提取白刺果原花青素的方法尚未见报道。
目前,白刺资源的利用率较低,同时也是原花青素的主要来源,因此,本文采用响应面法对微波超声协同提取白刺果原花青素的工艺进行优化,并利用大孔吸附树脂法对提取物进行纯化。再对纯化后的白刺果原花青素进行体外抗氧化活性测定,以期为更好地开发利用白刺资源提供理论依据。
1 材料与方法
1.1 材料与仪器
白刺果 甘肃武威(2020 年9 月采收);2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma 公司;2,4,6-三吡啶基三嗪[2,4,6-Tris(2-pyridyl)-striazine,TPTZ] 上海阿拉丁生化科技股份有限公司;儿茶素(纯度98%)、香草醛(纯度98%) 标准品,北京索莱宝科技有限公司;AB-8 型大孔树脂南开大学化工厂;羟自由基测试试剂盒 南京建成生物工程研究所;甲醇、乙醇、浓盐酸、浓硫酸 均为分析纯,天津鑫桥化工贸易有限公司。
XO-SM100 超声波微波协同反应系统 南京先欧仪器制造有限公司;UV-2802S 紫外可见分光光度计 上海尤尼柯公司;RV10 旋转蒸发仪 广州IKA仪器设备有限公司;Quintix125D 分析天平 北京赛多利斯科学仪器有限公司;Integral 10 超纯水系统Merck 公司;DFT-500 中药粉碎机 浙江荣浩工贸有限公司。
1.2 实验方法
1.2.1 白刺果原花青素提取工艺 白刺果样品置45 ℃干燥箱烘干,粉碎后过60 目筛,备用。参照文献[22]方法稍作修改,准确称取白刺果粉末2.00 g,提取后抽滤、浓缩、冻干,得到白刺果原花青素提取物。在微波功率200 W(室温),超声提取(功率300 W)30 min 的条件下,考察不同液料比、乙醇浓度、微波时间、超声温度对原花青素得率的影响。
1.2.2 单因素实验
1.2.2.1 液料比对得率的影响 固定乙醇浓度为70%,超声温度50 ℃,微波时间2 min,分别考察液料比为5、10、15、20、25 mL/g 对白刺果原花青素得率的影响。
1.2.2.2 乙醇浓度对得率的影响 固定液料比为15 mL/g,超声温度50 ℃,微波时间2 min,分别考察乙醇浓度为40%、50%、60%、70%和80%对白刺果原花青素得率的影响。
1.2.2.3 微波时间对得率的影响 固定乙醇浓度为70%,液料比为15 mL/g,超声温度50 ℃,分别考察微波时间为1、2、3、4 min 对白刺果原花青素得率的影响。
1.2.2.4 超声温度对得率的影响 固定乙醇浓度为70%,液料比为15 mL/g,微波时间2 min,分别考察超声温度为30、40、50、60、70 ℃对白刺果原花青素得率的影响。
1.2.3 响应面试验 在单因素实验结果的基础上,根据Box-Behnken 试验设计原理,利用Design-Expert.V 10.0.7 软件以原花青素得率为响应值,选取乙醇浓度、液料比、微波时间、超声温度为自变量,设计四因素三水平的响应面试验,对白刺果原花青素的提取工艺进行优化。响应面的因素水平见表1。
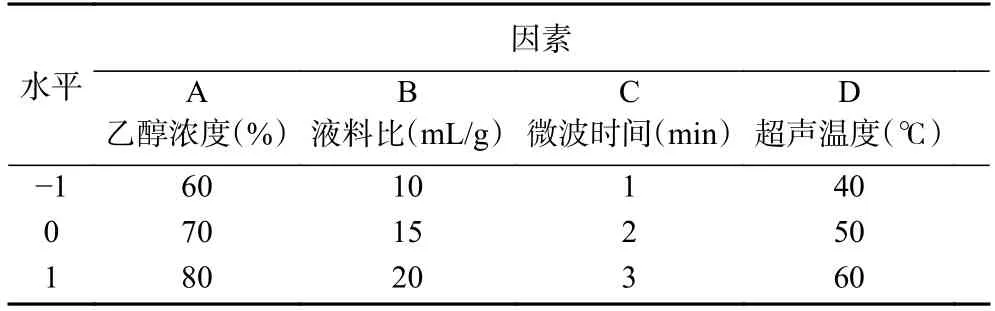
表1 响应面试验因素水平Table 1 Factors and levels of response surface test
1.2.4 原花青素得率的计算
1.2.4.1 标准曲线的制作 精密称取儿茶素标准品10.00 mg,置于10 mL 容量瓶中,甲醇溶解并定容,即得浓度为1 mg/mL 的儿茶素母液。
分别配成浓度为 0.0、0.2、0.4、0.6、0.8、1.0 mg/mL 的儿茶素标准溶液1 mL 于具塞试管中,依次加入浓度为0.04 g/mL 的香草醛-甲醇溶液3 mL 和1.5 mL 浓盐酸,45 ℃避光反应30 min,在500 nm 处测定吸光度。以吸光度为纵坐标,儿茶素标准溶液浓度为横坐标,绘制标准曲线[22]。回归方程为:y=0.4669x+0.1366,R2=0.9991,线性范围0.2~1.0 mg/mL。
1.2.4.2 原花青素得率的计算 计算公式(1)如下。

式中:W 为原花青素得率,mg/g;c 为根据吸光度值计算出的原花青素浓度,mg/mL;D 为溶液稀释倍数;V 为供试品溶液体积,mL;m 为白刺果粉末取样量,g。
1.2.5 白刺果原花青素提取物的纯化 参照文献[23−24]方法,采用AB-8 型大孔树脂对上述白刺果原花青素提取物进行纯化。取5 g 预处理好的AB-8 型大孔树脂装入色谱柱,上样质量浓度5.0 mg/mL,上样流速1 BV/h,洗脱液乙醇浓度40%,收集洗脱液,按公式(2)计算原花青素纯度,浓缩,冻干备用。

式中:c 为洗脱液中原花青素浓度,mg/mL;V 为洗脱液体积,mL;m 为原花青素纯化物冻干后质量,mg。
1.2.6 白刺果原花青素体外抗氧化分析
1.2.6.1 DPPH 自由基清除率的测定 参照谢瑞等[25]的方法,取上述经纯化后的原花青素粉末配成浓度为0.05、0.1、0.15、0.2、0.25、0.3 mg/mL 的原花青素提取液。分别取不同浓度的原花青素提取液和VC溶液2.0 mL,加入2.0 mL 浓度为0.2 mmol/L 的DPPH 乙醇溶液,置于暗处静置30 min,测定517 nm处的吸光度A,根据公式(3)计算DPPH 自由基清除率。
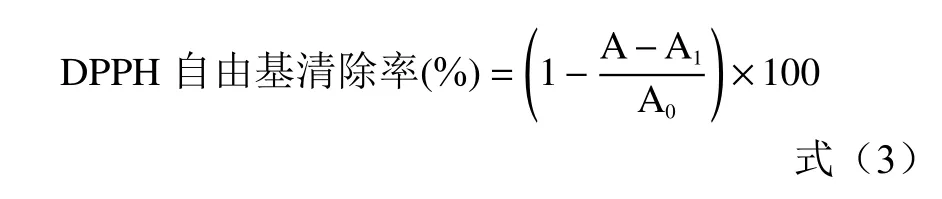
式中:A 为样品溶液的吸光度;A1为样品溶液本底吸光度;A0为空白对照溶液吸光度。
1.2.6.2 ABTS 自由基清除率的测定 参照王伟等[26]的方法,取2 mmol/L ABTS 溶液50 mL 和70 mmol/L过硫酸钾溶液200 mL 混匀后,4 ℃低温放置12 h,使用时用无水乙醇稀释,使其在734 nm 波长处吸光度A0为0.70±0.02。分别取0.1 mL 浓度为0.05、0.1、0.15、0.2、0.25、0.3 mg/mL 纯化后的白刺果原花青素提取液和VC溶液,加入1.9 mL 稀释后的ABTS自由基溶液,静置15 min,测定734 nm 处的吸光度A,根据公式(4)计算ABTS 自由基清除率。
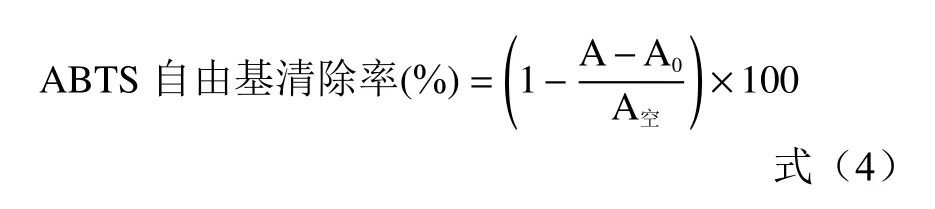
式中:A0为样品本底的吸光度;A 为样品溶液在734 nm 处测定的吸光度;A空为用无水乙醇代替样品在734 nm 处测定的吸光度。
1.2.6.3 还原能力(Ferric reducing antioxidant power,FRAP)的测定 FRAP 工作液:配制0.3 mol/L pH 为3.6 的醋酸钠缓冲液、10 mmol/L 的TPTZ 溶液和20 mmol/L 的三氯化铁溶液,按10:1:1 的体积比混合即得FRAP 工作液。
参考李颖晨等[27]的方法,分别取0.1 mL 浓度为0.05、0.1、0.15、0.2、0.25、0.3 mg/mL 纯化后的白刺果原花青素提取液和VC溶液,加入3 mL FRAP工作液,充分混合均匀后,37 ℃水浴避光反应10 min,在593 nm 测定吸光度值。按照上述方法,测定FeSO4系列标准溶液(浓度范围0.1~1.0 mmol/L)的吸光度值,得到标准曲线,根据回归方程计算出对应的FeSO4浓度,即为FRAP 值,此值越大,表明其还原能力越强。
1.2.6.4 羟自由基清除率的测定 分别取0.1 mL 浓度为0.05、0.1、0.15、0.2、0.25、0.3 mg/mL 纯化后的白刺果原花青素提取液和VC溶液,参照试剂盒说明书的步骤进行测定。按公式(5)计算羟自由基清除率。
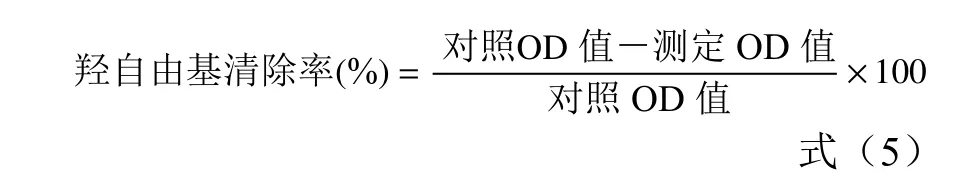
1.3 数据处理
本试验操作均平行测定3 次,结果采用平均值±标准差表示。采用Excel2010 进行单因素数据的统计分析及作图,Design-Expert.V10.0.7 软件进行响应面试验设计及方差分析,SPSS 20.0 软件得到半数抑制率IC50值。
2 结果与分析
2.1 单因素实验结果
2.1.1 液料比对白刺果原花青素得率的影响 如图1所示,在液料比为5~15 mL/g 时,随着溶剂的增加,白刺果原花青素得率呈上升状态,液料比为15 mL/g时,原花青素得率最高,达到16.93 mg/g,当液料比超过15 mL/g 时,白刺果原花青素得率呈下降趋势。可能是由于溶剂太少不利于原花青素的溶出,当溶剂达到一定程度时白刺果中原花青素已充分溶出,继续增加溶剂用量会使白刺果粉末受到的作用力减小[28],导致原花青素得率下降。故选取液料比10、15、20 mL/g进行响应面优化试验。

图1 液料比对白刺果原花青素得率的影响Fig.1 The effect of material liquid ratio on extraction rate of Nitraria proanthocyanidins
2.1.2 乙醇浓度对白刺果原花青素得率的影响 如图2 所示,当乙醇浓度在40%~70%之间时,白刺果原花青素得率随乙醇浓度的升高而增大,当乙醇浓度为70%时,白刺果原花青素得率达到最大,为17.03 mg/g,之后随着乙醇浓度的升高,白刺果原花青素的得率反而降低,可能是由于随着乙醇浓度的增加,溶液的极性发生了变化,一些醇溶性或脂溶性杂质成分的溶出增加,与原花青素竞争乙醇,导致得率下降[29]。因此,选取乙醇浓度60%、70%、80%进行响应面试验。
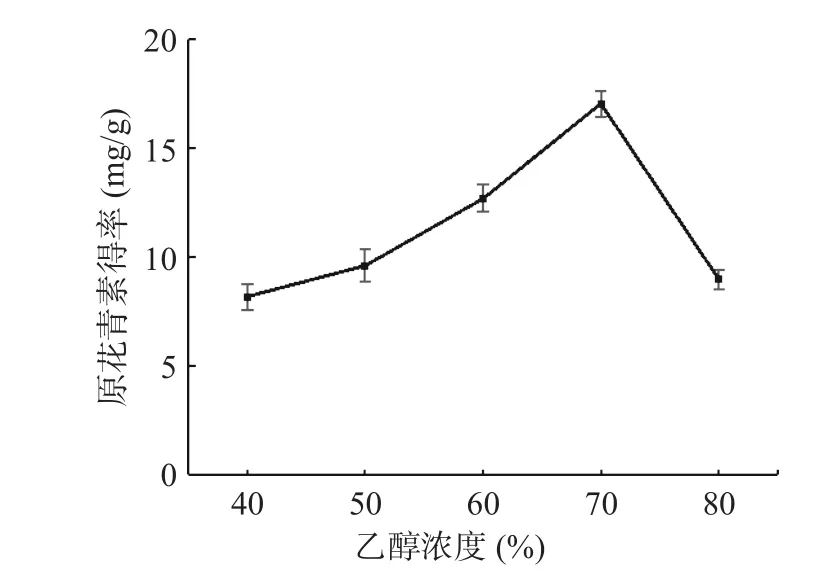
图2 乙醇浓度对白刺果原花青素得率的影响Fig.2 The effect of ethanol concentration on extraction rate of Nitraria proanthocyanidins
2.1.3 微波时间对白刺果原花青素得率的影响 如图3 所示,随着微波时间的延长,白刺果原花青素得率先增大后减小,是因为溶液中各成分吸收的能量使分子的无规则热运动加强导致扩散速率增加,当微波时间为2 min 时,白刺果原花青素得率为17.13 mg/g,达到最大,之后呈现下降趋势,可能是因为长时间的微波作用使局部温度过高,破环了原花青素的结构,导致得率下降[30−31]。因此,选取微波时间1、2、3 min进行响应面试验。
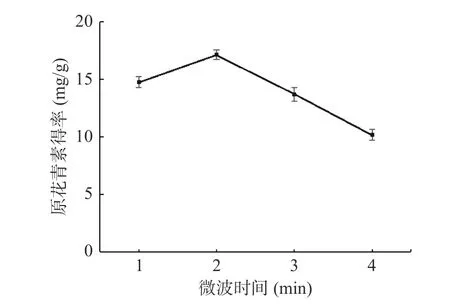
图3 微波时间对白刺果原花青素得率的影响Fig.3 The effect of microwave time on extraction rate of Nitraria proanthocyanidins
2.1.4 超声温度对白刺果原花青素得率的影响 由图4 可知,超声温度在30~50 ℃内,随着温度的升高,原花青素得率增加,超声温度为50 ℃时得率最高,达到16.47 mg/g。之后随着超声温度的升高,白刺果原花青素得率反而下降,说明随着温度的升高,有效成分的扩散速率加快,但温度过高会使原花青素分解,导致得率下降[29]。因此,选取40、50、60 ℃进行响应面试验。
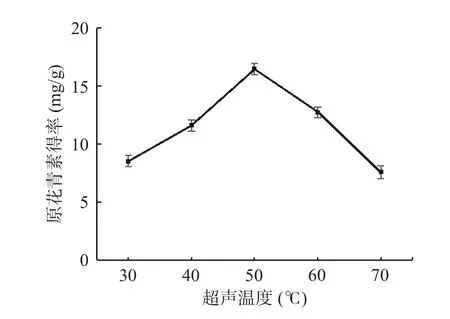
图4 超声温度对白刺果原花青素得率的影响Fig.4 The effect of ultrasonic temperature on extraction rate of Nitraria proanthocyanidins
2.2 响应面法优化结果
2.2.1 模型建立及方差分析 利用Design-Expert.V10.0.7 软件对所得数据进行响应面分析,响应面设计结果见表2。
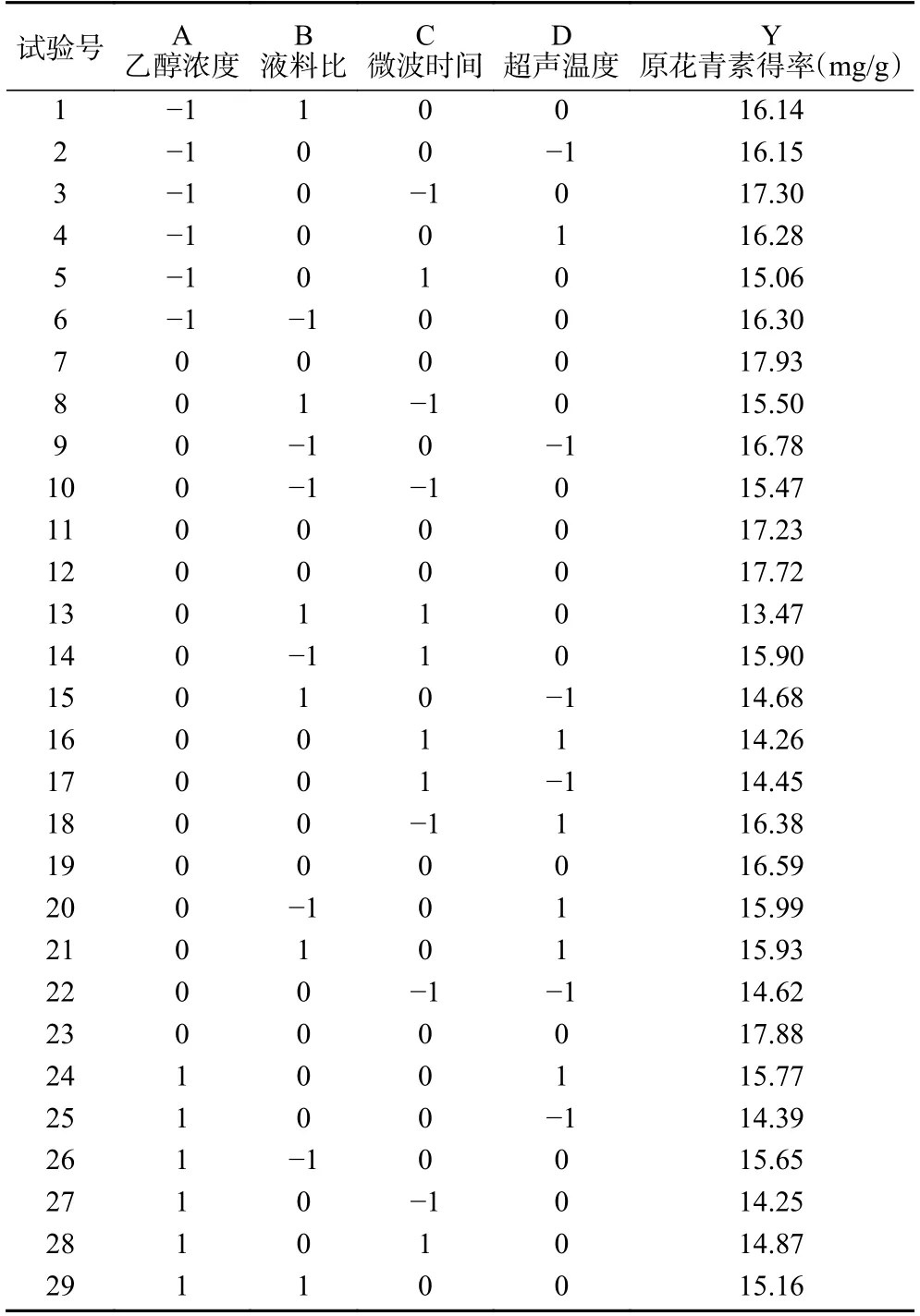
表2 响应面试验设计结果Table 2 Design and results of response surface test
经回归拟合后,得出模型的二次多项回归方程为:
Y=17.47−0.595A−0.4342B−0.4592C+0.295D−0.0825AB+0.715AC+0.3125AD−0.615BC+0.51BD−0.4875CD−0.7679A2−0.8117B2−1.4917C2−0.9729D2。
对上述回归模型的方差及显著性分析结果见表3。
由表3 可知,模型的P<0.0001,达到极显著,失拟项的P值为0.8753,不显著(P>0.05),表明该模型的拟合度良好,R2=0.9312,表明有93.12%的试验数据可以运用该模型进行分析,试验误差小,模型的可靠性较高。因此,可用该模型分析和预测白刺果原花青素的得率。
由表3 还可看出,模型中一次项A、B 和C,二次项A2、B2、C2、D2和交互项AC 对白刺果原花青素得率影响极显著(P<0.01);一次项D、交互项BC、BD 和CD 对白刺果原花青素得率影响显著(P<0.05),根据F值大小可以判断出各因素对白刺果原花青素得率的影响大小依次为A(乙醇浓度)>C(微波时间)>B(液料比)>D(超声温度)。
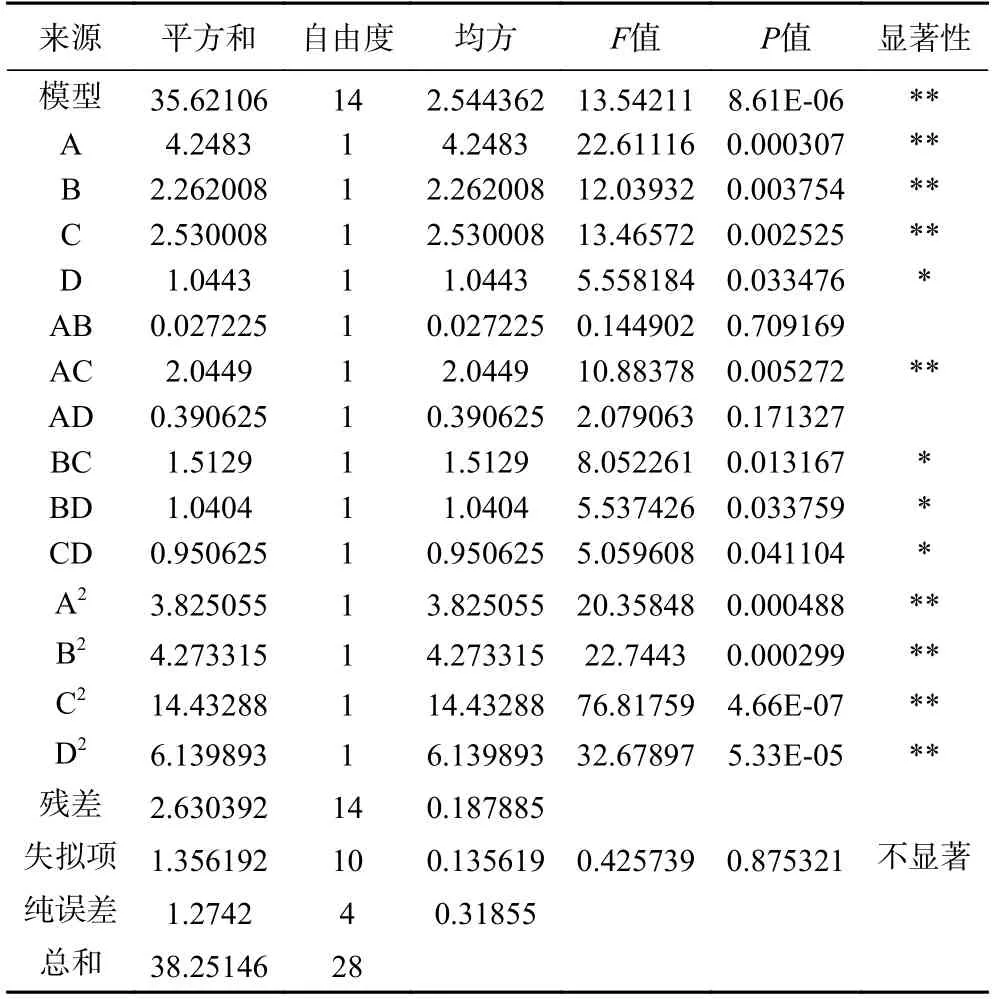
表3 模型回归方差分析结果Table 3 Variance analysis results of regression equation
2.2.2 因素间交互作用分析 通过Design-Expert.v10.0.7 软件绘制的响应面立体曲面图进一步分析和评价两个因素之间的交互作用,其曲面越陡峭,说明两个因素的交互作用越显著,各因素交互作用响应面图见图5。由图5 可以看出,AC 的交互作用对白刺果原花青素得率的影响极显著,BC、BD 和CD 对白刺果原花青素得率影响显著,这与表3 的方差分析结果相一致。
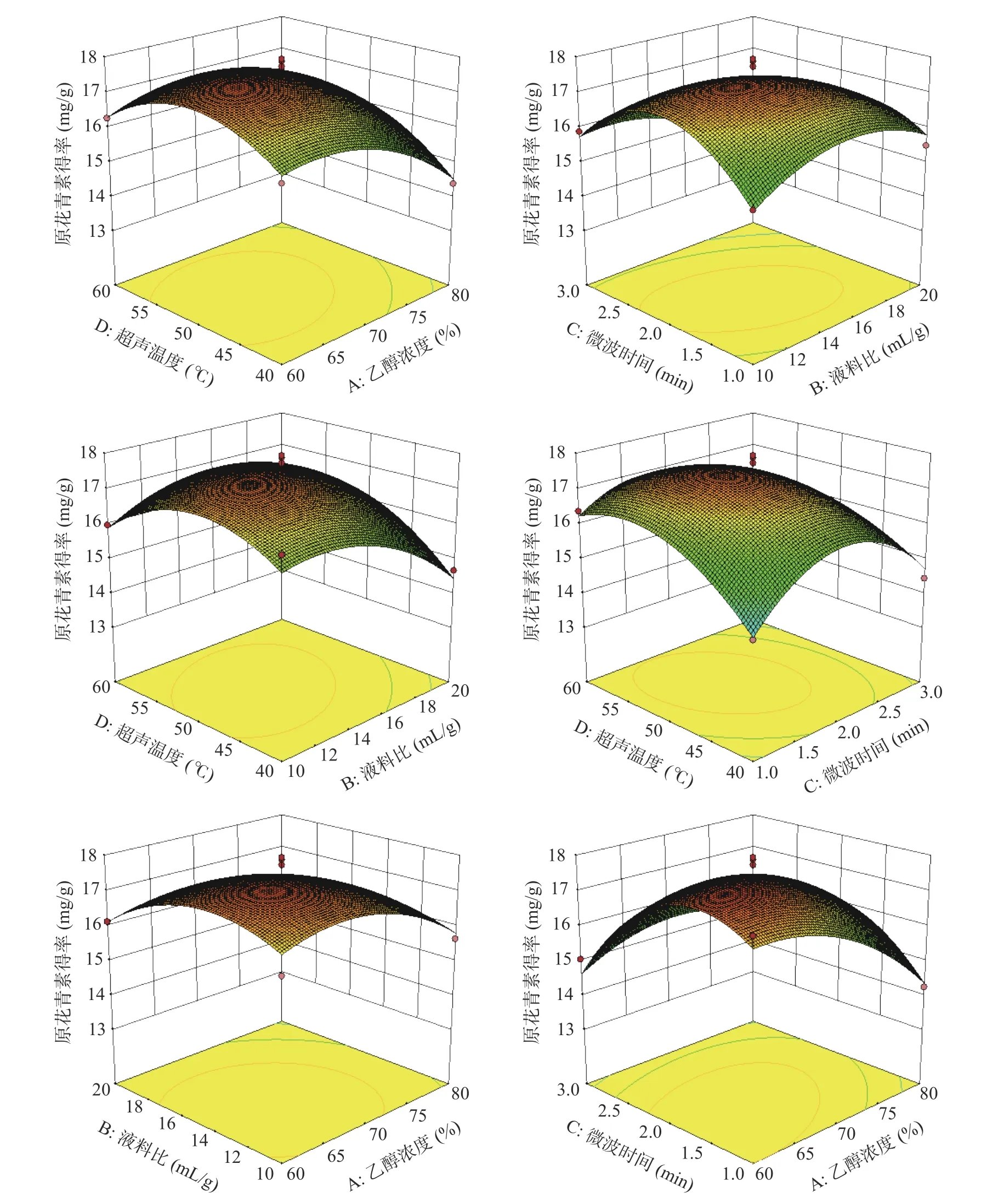
图5 各因素交互作用对白刺果原花青素得率影响的响应面和等高线图Fig.5 Response surface plot and contour plot of the effects of each factor on the extraction rate of Nitraria proanthocyanidins
2.2.3 验证试验 由回归方程得到的白刺果原花青素最佳提取工艺条件为:乙醇浓度65.18%,液料比14.47 mL/g,微波时间1.73 min,超声温度51.12 ℃。在此工艺条件下白刺果原花青素得率的预测值为17.714 mg/g。考虑到实际操作的可行性,将上述最佳工艺条件修正为:乙醇浓度65%,液料比14.5 mL/g,微波时间2 min,超声温度50 ℃,进行3 次平行试验,得到白刺果原花青素得率平均值为(17.289±0.402)mg/g,与理论预测值相差2.4%,说明由该模型优化的最佳提取工艺条件稳定可靠,具有实际应用价值。
2.3 白刺果原花青素纯化结果
利用AB-8 型大孔树脂纯化白刺果原花青素提取物,在上样质量浓度5.0 mg/mL,上样流速1 BV/h,洗脱液乙醇浓度40%条件下,收集洗脱液,计算得到的白刺果原花青素纯度为81.4%,低于蚕豆皮原花青素纯化后94.33%的纯度[32],与黑果腺肋花楸原花青素纯度78.4%相当[33]。
2.4 白刺果原花青素体外抗氧化活性结果
2.4.1 DPPH 自由基清除能力的测定 由图6 可知,纯化后的白刺果原花青素和VC溶液对DPPH 自由基的清除率随浓度的增加而逐渐增强,呈现明显的正相关性。白刺果原花青素浓度为0.30 mg/mL 时,其对DPPH 自由基的清除率达到78.02%,IC50为0.159 mg/mL,略低于VC(IC50为0.188 mg/mL),与文献报道花生红衣中原花青素清除DPPH 自由基结果相一致[34]。
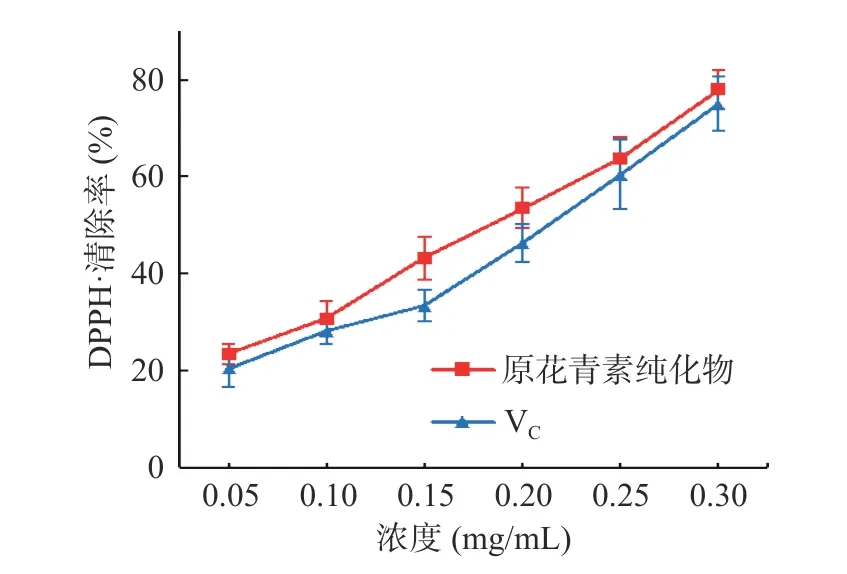
图6 不同浓度的白刺果原花青素对DPPH 自由基的清除作用Fig.6 Scavenging ability of different concentration of Nitraria proanthocyanidins on DPPH·
2.4.2 ABTS 自由基清除能力的测定 由图7 可知,纯化后的白刺果原花青素和VC溶液对ABTS 自由基的清除率随浓度的增加而逐渐增强。白刺果原花青素浓度为0.30 mg/mL 时,其对ABTS 自由基的清除率达到61.72%,IC50为0.261 mg/mL,略低于VC(IC50为0.308 mg/mL)。在相同浓度条件下,白刺果原花青素对ABTS 自由基的清除率整体低于对DPPH 自由基的清除率,表明其对DPPH 自由基具有更好的清除能力。
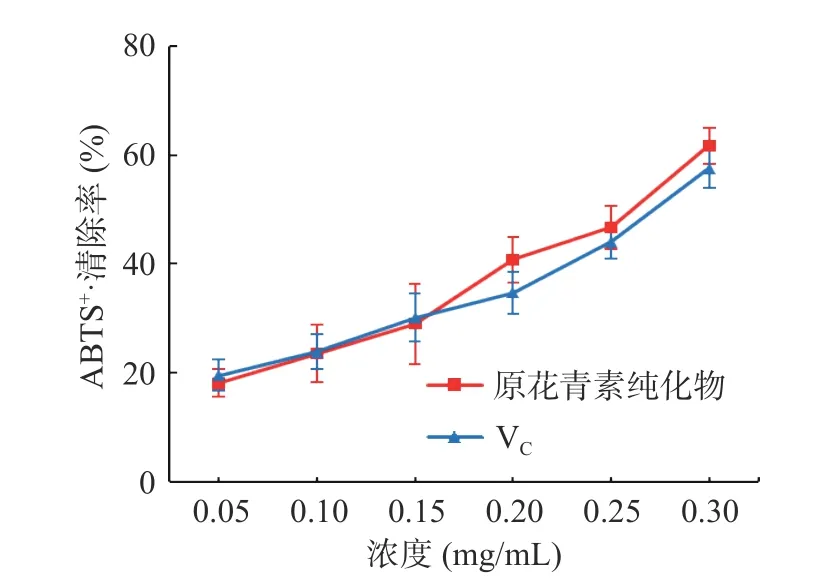
图7 不同浓度的白刺果原花青素对ABTS 自由基的清除作用Fig.7 Scavenging ability of different concentration of Nitraria proanthocyanidins on ABTS+·
2.4.3 还原能力的测定 FRAP 法测定白刺果原花青素还原能力如图8 所示。
铁离子还原抗氧化分析法用于一些抗氧化剂和植物提取物的总抗氧化活性的判定,结果可反映抗氧化剂还原能力的大小[27]。由图8 可知,FRAP 法测定抗氧化活性有剂量依赖关系,在测定的浓度范围内,随着浓度的增加,纯化后的白刺果原花青素和VC的FRAP 值增大,且呈一定的正相关,但VC的总抗氧化能力在高浓度时明显低于纯化后的白刺果原花青素,这与浦娜娜[35]的研究结果相一致。
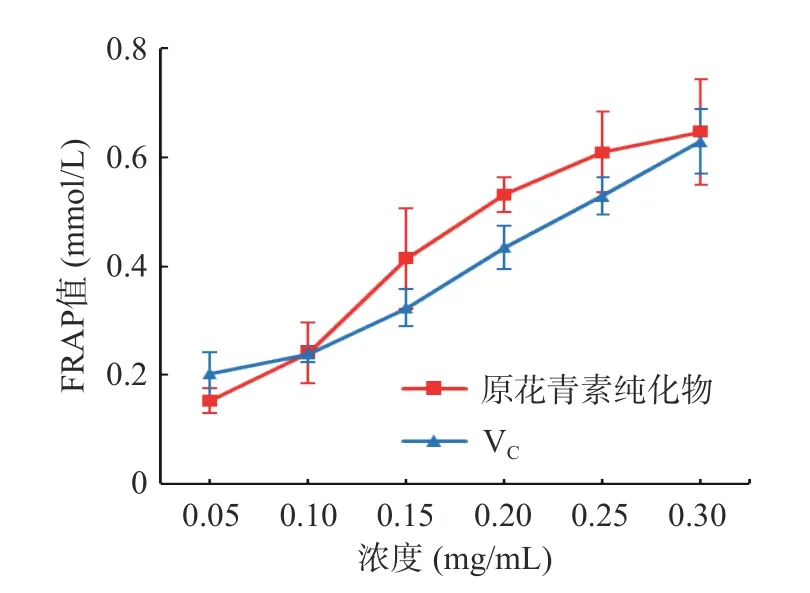
图8 不同浓度白刺果原花青素的铁离子还原能力Fig.8 Reducing power of different concentration of Nitraria proanthocyanidins
2.4.4 羟自由基清除能力的测定 羟自由基是非常活泼的自由基,可以很容易跨越细胞膜,导致细胞损伤,毒性相对较大[36]。由图9 可知,纯化后的白刺果原花青素和VC溶液对羟自由基的清除率随浓度的增加而逐渐增强,呈现明显的正相关性。白刺果原花青素与VC(IC50为0.301 mg/mL)相比其清除羟自由基的活性相对较弱,IC50为0.712 mg/mL。当浓度为0.30 mg/mL 时,其对羟自由基的清除率达到31.80%。
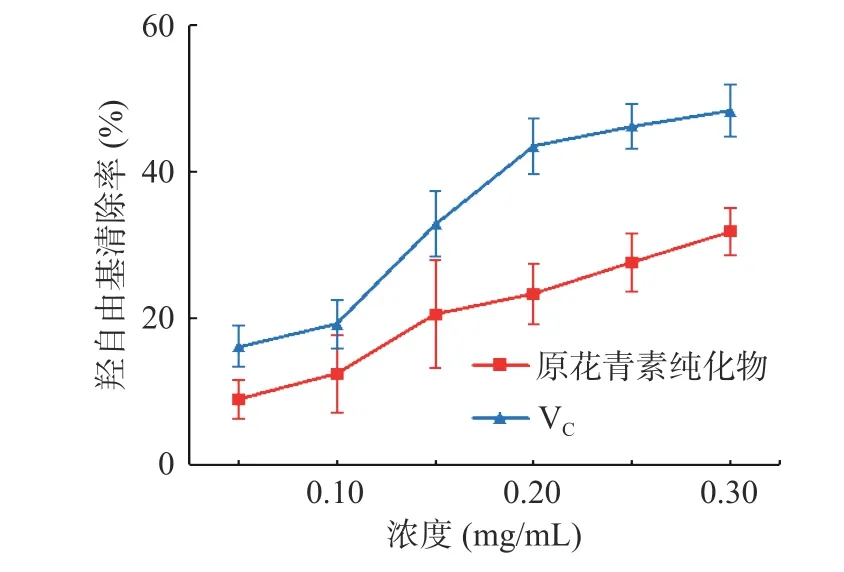
图9 不同浓度的白刺果原花青素对羟自由基的清除作用Fig.9 Scavenging ability of different concentration of Nitraria proanthocyanidins on hydroxyl free radicals
3 结论
本试验采用微波辅助超声法提取白刺果原花青素,通过单因素实验和响应面优化得到的最佳提取工艺条件为:乙醇浓度65%,液料比14.5 mL/g,微波时间2 min,超声温度50 ℃。在该条件下,白刺果原花青素得率为(17.289±0.402)mg/g,采用大孔树脂纯化后的纯度为81.4%。抗氧化试验结果表明纯化后的白刺果原花青素对羟自由基具有一定的清除能力,IC50为0.712 mg/mL;对ABTS 自由基和DPPH 自由基均具有较强的清除能力,IC50分别为0.261 和0.159 mg/mL。结果表明,微波超声联合提取白刺果原花青素具有明显的协同作用,能够明显地缩短提取时间,提高提取效率。白刺资源丰富,具有多种有效成分,基于以上研究,白刺果原花青素具有较强的清除自由基能力和抗氧化活性,为白刺资源的进一步全方位开发和利用提供一定的理论依据。
