普鲁兰酶酶解对葛根淀粉理化特性的影响
2022-07-08杨尚威刘传菊豁银强汤尚文
莫 琰,杨尚威,赵 灿,刘传菊,豁银强,张 倩,汤尚文,
(1.湖北文理学院食品科学技术学院,湖北襄阳 441053;2.襄阳市农业科学院,湖北襄阳 441057)
葛根是国家卫生部首批批准的药食同源两用植 物,具有多种生理活性,包括抗氧化、抗肿瘤和抗诱变等特性,有助于预防骨质疏松症、心血管疾病、癌症、肝纤维化、高血压和高血糖等[1]。葛根经挑选、清洗、去皮、切片、护色、干燥、粉碎等工艺可制取葛根全粉或葛根淀粉[2],辅以其它原料(亲水胶体、蛋白和淀粉类等)后可加工成功能性饮料[3]、固体饮料[4]、代餐粉[5]、面条[6]等产品。其中,冲调型固体饮料,因制备工艺简单,设备投资低,且产品市场接受程度高,成为众多中小葛根加工企业的主流产品。
葛根淀粉是葛根固体饮料最主要的成分,其由20%~22%直链淀粉和78%~80%支链淀粉组成[7],支链淀粉分子量约107~109Da,平均链长约20.5 DP,其链长分布和内部结构对淀粉的溶解、糊化、凝胶、消化等特性均有较大影响[8]。直接采用天然葛根淀粉生产的固体饮料存在冲调时易结块、溶解性差等问题,因此,有研究人员采用α-淀粉酶、糖化酶和普鲁兰酶等酶法改性改善饮料的冲调性、稳定性和口感[9−10]。现有酶法改性葛根淀粉工艺的共同点在于,均需先将葛根淀粉加热糊化后再降温至合适的酶解温度以加强酶的作用。这类工艺又带来两个新的问题。首先,糊化酶解后葛根淀粉的溶解性虽有提升,但糊化液干燥后再进行冲调时黏度大幅度下降影响饮用体验,需要额外添加亲水胶体等辅料进行增稠[11];其次,酶解后的淀粉糊液需要采用喷雾干燥等技术去除水分[12],增加了设备投资和工艺难度。为避免上述问题,赵凯等[13]在低于糊化温度(35~50 ℃)下采用普鲁兰酶对玉米淀粉进行脱支改性,制备颗粒态慢消化淀粉(SDS),研究发现,虽然未糊化条件下普鲁兰酶作用时间较长(6~14 h),但其依然对淀粉的结晶特性、热焓特性、颗粒形貌等产生了显著的影响,且颗粒态SDS 后处理过程中脱水、干燥及粉碎等操作相对简便。LI 等采用分支酶在低温(50 ℃)且未糊化条件下对葛根淀粉进行改性,结果表明葛根淀粉的直链淀粉含量、分子量、结晶特性、流变特性等均有显著变化。上述研究表明,在低温且未糊化条件下对淀粉进行酶法改性是可行的,且改性后仍然保持颗粒状态的淀粉更有利于进行分离、干燥等后处理。
现有研究采用的各种酶中,普鲁兰酶可定向水解支链淀粉中的α-1,6-糖苷键,减小淀粉的分支化度,增加直链淀粉含量,同时还对淀粉的消化特性有较大影响,其对淀粉的酶解作用相对α-淀粉酶和糖化酶更为缓慢和温和。因此,本文采用普鲁兰酶对未经糊化的颗粒态葛根淀粉进行酶解,考察其对葛根淀粉理化特性的影响,以期为葛根固体饮料的生产提供部分参考。
1 材料与方法
1.1 材料与仪器
葛根淀粉(食品级) 湖北葛百岁葛业有限公司;普鲁兰酶(10000 U/g,食品级) 嘉源食品配料有限公司;α-淀粉酶(3000~5000 U/g,BR) 北京双旋微生物培养基制品厂;胃蛋白酶(3000 U/g,BR)、葡萄糖淀粉酶(80000 U/g,BR) 合肥博美生物科技有限公司;其它化学试剂均为分析纯,水为超纯水。
UV-2600 紫外分光光度计、IR2000 傅里叶红外光谱仪 日本岛津;RVA-Tec Master 快速黏度分析仪 瑞典波通;AQ20 差示扫描量热仪 美国TA;DM2700P 偏光显微镜 德国莱卡;Mastersizer3000激光粒度仪 英国马尔文;D8 Advance X-射线衍射仪 德国布鲁克;S-4800 扫描电镜 日本日立。
1.2 实验方法
1.2.1 葛根淀粉的酶解 通过预实验结合已有研究文献[14−17],确定葛根淀粉酶解工艺为:称取50 g葛根淀粉,添加500 mL 纯水于恒温水浴中搅拌分散,缓慢滴加用1 mol/L HCl 调整pH 至5.5,添加0.25 g 普鲁兰酶,在50 ℃下搅拌酶解18 h,之后在4000 r/min 下离心20 min,离心后所得沉淀用纯水洗涤、离心(条件同上),直至上清液为中性,取沉淀50 ℃干燥至恒重,碾钵研磨后过100 目筛网于干燥皿中保存备用。葛根淀粉和酶解葛根淀粉分别标记为KS 和EHKS。
1.2.2 糊化特性的测定 配制10%(干基质量)的淀粉悬浮液置于RVA 测量铝桶内,用搅拌桨上下搅拌均匀后,迅速上机测试。测定条件:开始10 s 内搅拌转速960 r/min,之后搅拌转速160 r/min;在50 ℃保持1 min,随后以12 ℃/min 的速度匀速升温至95 ℃,在95 ℃保持2.5 min 后以12 ℃/min 匀速降温至50 ℃,在50 ℃保持2 min。
1.2.3 抗性淀粉含量测定 参考张焕新[18]的方法,采用Goni 法并略作改动测定抗性淀粉含量。淀粉试样经胃蛋白酶水解去除蛋白,之后采用α-淀粉酶和葡萄糖淀粉酶充分水解,加入无水乙醇离心后所得絮状沉淀即为抗性淀粉(RS)。RS 用KOH 溶解后加入葡萄糖淀粉酶充分水解成葡萄糖,水解液经离心取上清液用3,5-二硝基水杨酸法测定还原糖含量。抗性淀粉含量按下式计算:
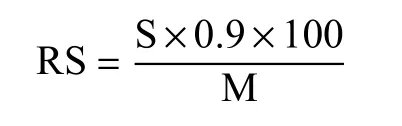
式中,RS(%)为抗性淀粉含量;S(g)为上清液中还原糖总量;0.9 为转换系数;M(g)为试样质量。
1.2.4 DSC 测定 称取5 mg 样品于DSC 专用铝盒中,添加15 μL 的蒸馏水后密封,室温放置2 h 后以空铝盒作参照,进行DSC 测定。升温速率为5 ℃/min,吹扫氮气为50 mL/min,温度扫描范围为30~120 ℃。
1.2.5 微观结构观察 偏光显微镜:用蒸馏水分散样品,涂抹在载玻片上,盖上盖玻片后置于偏光显微镜下观察,调整并固定光源,目镜10×、物镜50×下进行观察,得到偏光显微图。
扫描电镜:将适量样品均匀涂抹在双面导电胶上,用离子溅射仪喷金,置于扫描电子显微镜中,在不同放大倍数下观察葛根淀粉的表观形貌,加速电压5.0 kV。
1.2.6 粒度分布测定 将样品用纯水配制成质量分数为1%的悬浮液,充分震荡混匀上机测试。遮光度范围设置为5%~20%,分析模型选用球型模型。
1.2.7 红外光谱测定 取2 mg 待检测样品与200 mg KBr 于研钵中混合研磨均匀后采用压片机压片。测试模式为Absorption;扫描波段4000~400 cm−1;分辨率4 cm−1;样品扫描32 次。
1.2.8 XRD 测定 操作电压40 kV,电流30 mA,以Cu 作为靶。分别取酶解前后葛根淀粉少许置于样品架上,扫描速率10°/min,收集衍射角2θ在5~45°范围的衍射数据,得到XRD 图谱。
1.3 数据处理
RVA、DSC、FT-IR 数据均由仪器自带软件计算得出,所有试验均重复测试3 次以上,文中各表数据采用Origin 2018 计算平均值、标准差及显著性,表示方式采用(平均值加减标准差),显著性用小写字母上标表示,不同字母代表差异显著(P<0.05)。偏光和SEM 图片由仪器导出后采用PowerPoint 进行合并、大小调整和添加标注。IR 分峰和XRD 相对结晶度计算采用Peakfit4.12 软件完成。所有数据绘图采用Origin 2018 绘制。
2 结果与分析
2.1 酶解对葛根淀粉糊化特性的影响
图1、表1 分别为葛根淀粉与酶解葛根淀粉的糊化曲线和糊化特征参数。葛根淀粉经酶解后,其各项糊化特征参数均有显著性差异(P<0.05)。酶解后葛根淀粉的峰值黏度降低了28.33%,谷值黏度增加了12.53%,崩解值降低了94.69%,最终黏度增加了12.47%,回生值增加了12.37%,糊化温度上升至85.16 ℃。此结果与GE 等[19]采用普鲁兰酶改性颗粒甘薯淀粉(未糊化,酶解温度55 ℃)糊化特性的变化一致。
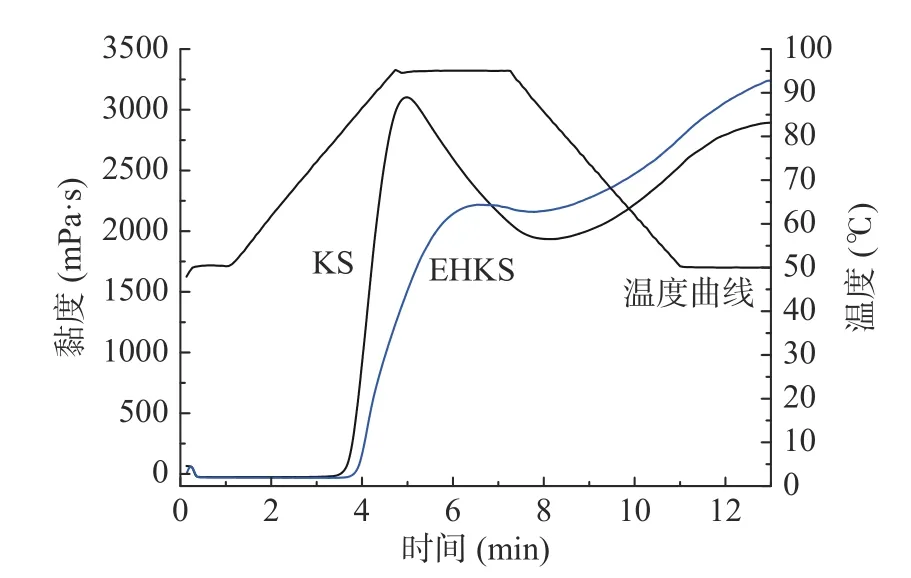
图1 葛根淀粉(KS)与酶解葛根淀粉(EHKS)的糊化曲线Fig.1 Pasting curves of KS and EHKS
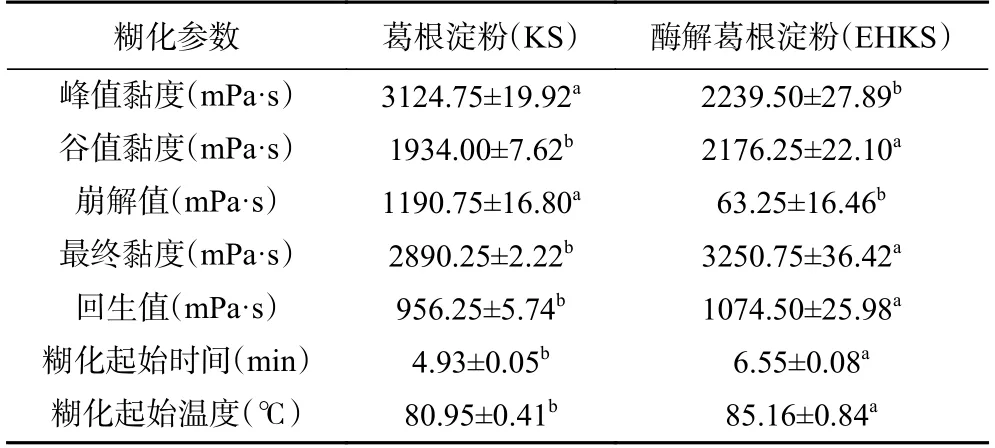
表1 葛根淀粉(KS)与酶解葛根淀粉(EHKS)的糊化特征参数Table 1 Pasting characteristic parameters of KS and EHKS
葛根淀粉糊化特性的变化主要是由普鲁兰酶脱支作用导致的,普鲁兰酶作用于支链分子的α-1,6-糖苷键,酶解后产支链淀粉的分支减少,同时产生大量的短直链分子。YAN 等[20]认为淀粉支链的分解减少了凝胶组分之间的相互作用从而导致其糊化特性的改变;亦有研究指出峰值黏度与直链淀粉含量呈负相关,大量直链淀粉与支链淀粉分子纠缠在一起限制了淀粉颗粒在糊化过程中的膨胀,从而导致峰值黏度下降和糊化温度的升高,但在冷却过程中直链淀粉与其他淀粉分子相互作用并形成网络促进了回生值和最终黏度的提升[21−23]。同时,酶解造成淀粉颗粒结构变得更加疏松,对剪切作用和热的抵抗力变低[24],从而使崩解值降低。
2.2 酶解对抗性淀粉含量的影响
葛根淀粉与酶解葛根淀粉的抗性淀粉含量分别为1.29%±0.11%和4.60%±0.04%,抗性淀粉含量增加了3.31%。普鲁兰酶是制备抗性淀粉的常用酶之一,在未糊化条件下对葛根淀粉进行酶解后,其抗性淀粉含量虽然有所提升,但相较于文献报道(糊化后降温至60 ℃酶解)的9%~12%抗性淀粉含量明显偏低[25]。
已有研究表明,淀粉的抗消化性是由多种因素决定的,包括颗粒大小、颗粒表面形状、淀粉颗粒中孔隙大小、直链/支链比、直链链长、支链淀粉的线性化和淀粉结晶度等[26]。其中,直链淀粉比例与抗性淀粉含量呈正相关[14,27]。抗性淀粉组分可以同时包含结晶区和非晶区[26],罗志刚等[28]指出,淀粉的结晶度和抗性淀粉含量之间并不呈现一定的规律性,相对于结晶度,结晶的致密性和完美程度对淀粉的抗消化性影响更大[29]。
普鲁兰酶酶解一方面会增加直链淀粉含量,另一方面支链淀粉脱支后分子链间距增大,短直链分子可深入支链结构与支链淀粉的直链分支重排为双螺旋结构,重新生成更为致密的完美结晶[13],而致密的结晶区会阻碍淀粉的消化,因此抗性淀粉含量增加。此外,在未糊化条件下进行酶解,由于淀粉分子链未舒展,普鲁兰酶很难作用于淀粉的完美结晶区,仅对无定形区和不完美结晶区中的支链淀粉有切支作用,酶解后完美结晶的相对比例提升,因此酶解后抗性淀粉含量增加。糊化和未糊化条件下酶解造成的抗性淀粉含量差异则是由于糊化后分子链更为舒展,普鲁兰酶作用位点相对更多,直链淀粉的溶出和生成相对未糊化条件下更多,在回生期间生成大量的RS3 型抗性淀粉[30]。
2.3 酶解对葛根淀粉热特性的影响
酶解前后葛根淀粉的DSC 图谱和参数如图2、表2 所示。从图中可以看出酶解后葛根淀粉吸热峰明显向高温区偏移。经计算,酶解后葛根淀粉的T0、Tp和Tc显著增加(P<0.05),T0从70.15 增加至74.98 ℃,Tp从75.78 ℃增加至79.23 ℃,Tc从82.79 ℃增加至84.03 ℃。△H 和△T 显著下降(P<0.05),△H 从5.43 J/g下降至2.58 J/g,△T 从12.63 ℃下降至9.05 ℃。
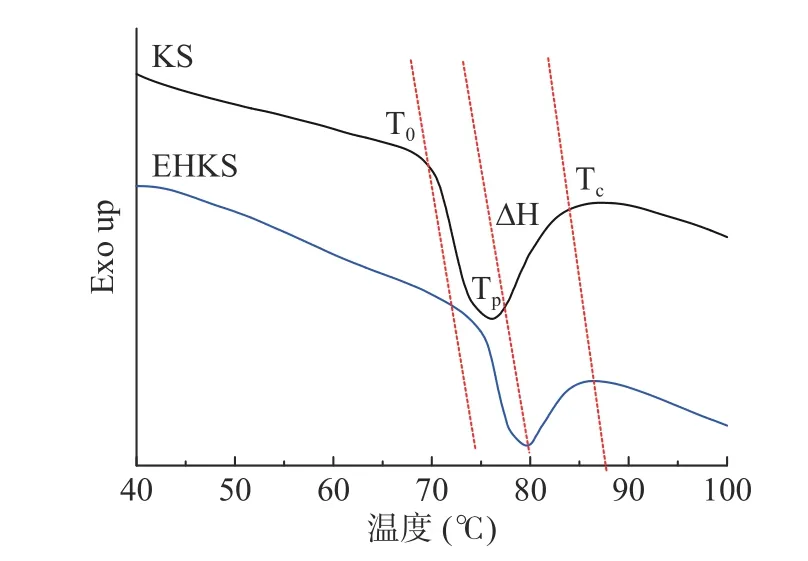
图2 葛根淀粉(KS)与酶解葛根淀粉(EHKS)的DSC 曲线Fig.2 DSC curves of KS and EHKS

表2 葛根淀粉(KS)与酶解葛根淀粉(EHKS)的热性能Table 2 Thermal properties of KS and EHKS
T0和Tc分别代表淀粉颗粒中最弱的微晶和最完美的微晶的熔化温度[31]。缪铭[32]认为无定形区的水解对结晶熔融过程干扰减少,从而导致T0、Tp和Tc的升高,而影响△T 的因素有结晶形状与大小、晶体完美程度、淀粉链相互缠结形成双螺旋的类型。普鲁兰酶对葛根淀粉无定形区和不完美结晶酶解后,剩余的完美结晶需要更高的温度才能熔融,同时脱支处理后产生的大量游离短直链分子相互间通过氢键结合形成了更多的短程有序结构[33],直链分子间结合力较强,其加热解聚和熔融时需要更高的温度。
△H 表示了淀粉颗粒中晶体结构破坏或螺旋解构所需的热量[34]。未酶解葛根淀粉颗粒中晶体的存在主要为支链淀粉的直链分支通过氢键形成的有序螺旋结构堆积形成晶区,此外还有少量的游离直链淀粉夹杂其间,由于支链分子分支众多,其吸热解构时分支相互间空间位阻较强,因此,需要吸收更多的热量用于解构[32,35]。酶解后淀粉颗粒体积变大、结构疏松,更易崩解,且支链分子的分支的位阻作用减弱,游离短直链比例增加,晶体更易解构。
2.4 酶解对葛根淀粉的微观形貌与粒度影响
葛根淀粉酶解前后的偏光和扫描电镜观察结果如图3 所示。从图3 可以看出,酶解后淀粉颗粒明显变大,少量颗粒崩解且存在表层剥落现象(图3 中a、b、c、d 等处),但颗粒外形仍然相对完整且偏光十字明显,这一现象与GE 等[19]对甘薯淀粉偏光十字的观测一致。进一步的通过激光粒度仪分析酶解前后淀粉颗粒的大小,结果如图4 和表3 所示。从图4可以看出,酶解后淀粉颗粒粒度明显变大,且粒度范围更广,未酶解时Dx(10)、Dx(50)和Dx(90)分别为1.55、7.57 和13.30 μm,酶解后粒径增大至3.76、10.80和20.30 μm,其结果印证了RVA 测试中关于酶解后淀粉颗粒膨胀的推测。

表3 葛根淀粉(KS)与酶解葛根淀粉(EHKS)的粒径参数Table 3 Particle size parameters of KS and EHKS
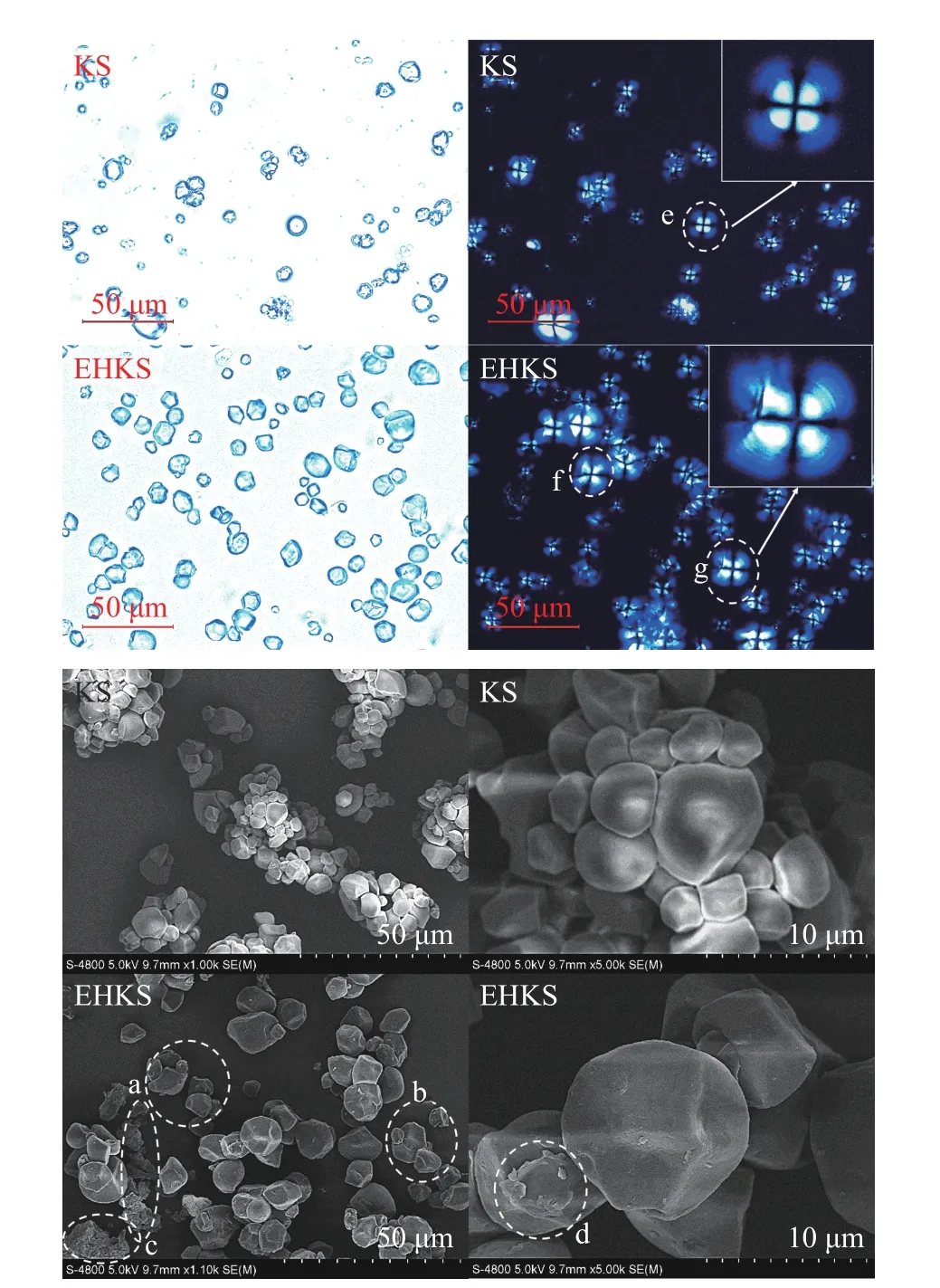
图3 葛根淀粉(KS)与酶解葛根淀粉(EHKS)的偏光显微镜和SEM 图Fig.3 Polarized light and SEM images of KS and EHKS
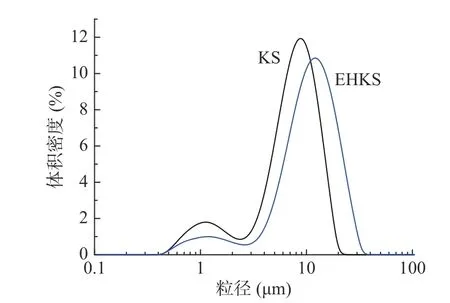
图4 葛根淀粉(KS)与酶解葛根淀粉(EHKS)的粒度分布Fig.4 Particle size distribution of KS and EHKS
因普鲁兰酶仅作用于α-1,6-糖苷键,酶解过程中不影响支链淀粉框架结构的完整性,而且酶解在较低的温度(50 ℃)下进行,酶解切支生成的短直链分子仍包含在颗粒内,因此,颗粒外形相对完整,偏光十字仍然存在。但仔细观察可以发现酶解前后淀粉颗粒的偏光十字外围有所不同(图3 中e、f、g 等处),未酶解颗粒偏光十字外围相对平滑致密,酶解后虽然十字仍然存在,但外围有明显的扩散以及光线由外向内的层次递进。说明酶解首先发生在淀粉颗粒表层,然后向内部递进,酶解后表层晶体结构破坏相对内部更为严重[19]。
2.5 酶解对葛根淀粉的分子与结晶结构的影响
图5 为酶解前后葛根淀粉的红外光谱图。从图5可以看出,酶解前后葛根淀粉红外光谱特征吸收峰峰位和峰形未出现明显变化,说明酶解后未形成新的基团。红外光谱中3000~3600 cm−1为淀粉分子中OH 的伸缩振动,2900 cm−1附近为C-H 伸缩振动,1640 cm−1附近由淀粉中水分子中的2 个O-H 剪切形成振动[36],820~1280 cm−1几个连续强吸收峰是由高度耦合的C-O 和C-C 伸缩振动峰引起的[37]。
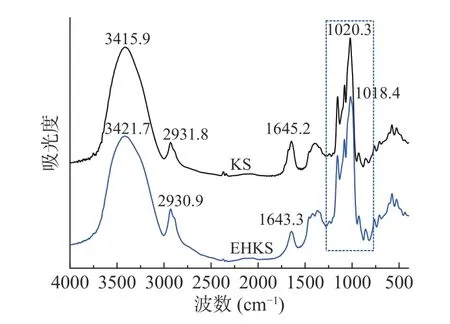
图5 葛根淀粉(KS)与酶解葛根淀粉(EHKS)的红外光谱Fig.5 FTIR spectra of KS and EHKS
在1047、1022 cm−1处的红外吸收分别与淀粉颗粒中短程有序结构和无定型结构有关[38],995 cm−1处的吸收与C-6 处羟基的分子内氢键有关,其中,(1047/1022)峰面积比值越大或(1022/995)峰面积比值越小,表明颗粒内短程有序度越高[39]。采用peakfit 软件对875~1190 cm−1区间红外光谱进行分峰处理,计算得出1047、1022 和995 cm−1三个峰的面积,计算结果显示未酶解葛根淀粉A1047/A1022和A1022/A995分别为1.65 和0.71,酶解后分别为3.41 和0.23。酶解后A1047/A1022增加、A1022/A995降低,说明酶解促进了淀粉分子短程有序结构的生成,主要是酶解产生的短直链分子通过氢键缔合重排为有序的螺旋结构。
图6 为酶解前后葛根淀粉的XRD 曲线及相对结晶度计算结果。从图6 可以看出,酶解前后葛根淀粉均在15.3°、17.2°和23.1°处出现强衍射峰,为典型的C 型结构。经计算,酶解前后相对结晶度(Xc)分别为37.31%、29.10%,酶解后葛根淀粉相对结晶度降低了8.21%。淀粉颗粒由有序的结晶区和无序的无定形区组成。其中,结晶区主要由支链淀粉起到骨架作用,其直链分支和长短不同的游离直链分子平行排列,通过氢键作用形成大致有规则的束状体即微晶束[40]。普鲁兰酶酶解切支后,微晶区的支链分支被切断,支链淀粉的支撑作用减弱,大量短直链呈游离状态分布于淀粉颗粒中,因此导致相对结晶度下降。

图6 葛根淀粉(KS)与酶解葛根淀粉(EHKS)的XRD 曲线Fig.6 XRD curves of KS and EHKS
3 结论
未糊化条件下,普鲁兰酶对葛根淀粉糊化特性的影响显著。酶解葛根淀粉的峰值黏度和崩解值降低,但谷值黏度、最终黏度和回生值增加。酶解后葛根淀粉颗粒变大,分子短程有序结构比例增加;XRD相对结晶度下降,但致密的完美结晶比例增加。酶解葛根淀粉的抗性淀粉含量增加了3.31%,但相对于糊化酶解工艺仍有较大差距,后续研究可考虑采用超声等物理方法辅助酶法提升抗性淀粉含量。本文研究结果可为葛根淀粉的酶法改性及其在固体饮料中的应用提供理论依据。
