贮藏过程中米谷蛋白纤维聚集体理化性质变化规律
2022-07-08王传洋李世超王发祥刘永乐李向红
黄 慧 王传洋 李世超 俞 健 王发祥 刘永乐 李向红
(1. 长沙理工大学食品与生物工程学院,湖南 长沙 410114; 2. 湖南省水生资源食品加工工程技术研究中心,湖南 长沙 410114)
几乎所有蛋白质均可通过自组装形成具有交叉β-折叠结构的淀粉样纤维[1]。经酸热处理得到的蛋白质纤维聚集体主要有两种保存方式,一是通过冷冻干燥得到固体样品[2],二是以液体样品的形式进行储存[3-4]。Wang等[5]认为蛋白质纤维溶液在酸性条件下贮存时,体系中的单体、低聚物、原纤维、成熟原纤维和无定型聚集体之间存在动态平衡;Ahmed等[6]研究发现Aβ42低聚物在37 ℃ 培养 6 h后,形成窄而细长的原纤维,而在培养12 d 后,形成致密的网络结构;Lassé等[7]发现5种蛋白质纤维聚集体在室温下培养7 d后达到稳定的荧光强度值,表明在贮存期间蛋白质纤维溶液经历了由原纤维向成熟纤维转变的过程。
Li等[8]研究发现米谷蛋白纤维聚集体对大米淀粉的体外消化性具有抑制作用,米谷蛋白纤维聚集体溶液在贮存(4 ℃)过程中荧光强度逐渐发生改变,但其结构性质的演变尚未深入探讨。迄今为止,贮藏对蛋白质纤维聚集体抑制淀粉消化性能的影响尚未见诸于报道。
研究拟将在85 ℃,pH 2.0下加热不同时间(2,4,6,8,10,15 h)形成的米谷蛋白纤维聚集体(RGFAs)溶液在4 ℃冰箱贮藏1 d和4 d,然后测定RGFAs的表面疏水性、粒径、剪切黏度及其对小麦淀粉糊化及消化性的抑制作用,以期揭示贮藏时间与蛋白纤维聚集体溶液功能特性之间的关系,为食品蛋白质纤维聚集体的保存及应用提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆油:金龙鱼,益海嘉里粮油工业有限公司;
粳米:市售;
小麦淀粉:食品级,郑州万邦食品有限公司;
葡萄糖试剂盒:上海荣盛生物医药有限公司;
8-苯氨基-1-萘磺酸铵盐(ANS):纯度97%,北京百灵威科技有限公司;
胃蛋白酶(250 U/mg)、α-淀粉酶(5 U/mg)、转苷酶(260 U/mL):Sigma-aldrich西格玛奥德里奇(上海)贸易有限公司;
盐酸、氢氧化钠、三氯乙酸、磷酸二氢钠、磷酸氢二钠、磷酸、无水乙醇、十二烷基硫酸钠(SDS):分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
荧光分光光度计:F-7100型,日本日立公司;
纳米粒度电位仪:NanoBrook 90Plus型,美国布鲁克海文仪器公司;
流变仪:DHR-2型,美国沃特斯集团;
紫外—可见光分光光度计:TU-1901型,北京普析通用仪器有限责任公司;
快速黏度测定仪:RVA-4500型,瑞典波通仪器公司;
集热式恒温加热磁力搅拌器:DF-101T型,巩义市予华仪器有限责任公司;
手持式均质机:T10 basic型,德国IKA公司;
真空冷冻干燥机:SCIENTZ-10N型,宁波新芝生物科技股份有限公司;
pH计:PHS-3C型,上海雷磁精密仪器有限公司。
1.3 方法
1.3.1 米谷蛋白的提取 参考李娜等[9]的方法并稍作修改。称取500 g梗米粉溶于5 L NaOH (0.05 mol/L)溶液中,常温低速搅拌2 h,离心(3 500 r/min, 30 min)后取上清液。采用HCl(1 mol/L)调pH至4.8,离心(3 500 r/min, 20 min)后取沉淀。用20 mL去离子水溶解沉淀后调pH 至7.0,接着将分散液与500 mL 5% NaCl溶液混合,搅拌1 h后离心(3 500 r/min, 30 min)取沉淀。将沉淀溶于250 mL 体积分数为70%的乙醇中,搅拌1 h后,抽滤取沉淀。最后将沉淀溶于500 mL去离子水中,搅拌20 min后,离心(3 500 r/min, 30 min)取沉淀,重复水洗两次。将得到的沉淀物溶于少量去离子水中,并置于-60 ℃ 冰箱中冷冻过夜,冷冻干燥得到米谷蛋白粉末(RG)。
1.3.2 RGFAs的制备 将一定质量的RG溶解于0.05 mol/L 磷酸氢二钠—磷酸缓冲液(pH 2.0)中,得到20 mg/mL的蛋白质分散液,室温搅拌过夜,使其充分水化。热处理前均质3 min(4档)使米谷蛋白进一步分散,然后将蛋白质分散液置于具塞试管中,并在(85±1) ℃下分别搅拌加热2,4,6,8,10,15 h,得不同加热时间下的米谷蛋白纤维聚集体(RGFAs)。取样后立即冰水冷却,待温度降至室温后置于(4±1) ℃冰箱贮藏1 d和4 d备用。
1.3.3 表面疏水性 参考Dong等[10]的方法并稍作修改,采用ANS荧光探针测定RGFAs的表面疏水性。将ANS粉末溶解于磷酸二氢钠—磷酸氢二钠缓冲液(pH 7.0)中得到8 mmol/L的ANS溶液(室温避光,现配现用)。将RGFAs液体样品的质量浓度分别稀释至0.1~0.5 mg/mL,取2 mL稀释后的样品溶液与50 μL ANS探针混合2 min后,使用荧光分光光度计测定荧光强度。设置激发波长390 nm,发射波长范围400~600 nm,扫描速度1 200 nm/min,激发和发射狭缝5 nm,电压400 V。以RGFAs分散液的梯度浓度为横坐标,测得的荧光强度值为纵坐标,通过线性拟合得到的斜率即为样品的表面疏水性。
1.3.4 乳化性的测定 根据文献[11-12]并稍作修改,测定RGFAs(1,4 d)的乳化活性(EAI)及乳化稳定性(ESI)。将大豆油与大米谷蛋白纤维聚集体溶液按V大豆油∶V大米谷蛋白纤维聚集体溶液=1∶3混合,均质1 min,取50 μL 静置0 min及10 min后的乳液添加至5 mL 0.1% SDS溶液中,混合均匀后,立即测定吸光度,设置波长为500 nm。
乳化活性及乳化稳定性的计算公式:
(1)
(2)
式中:
EAI——米谷蛋白纤维聚集体的乳化活性;
ESI——米谷蛋白纤维聚集体的乳化稳定性;
A0——乳液均质后静置0 min的吸光度;
A10——乳液均质后静置10 min的吸光度;
DF——稀释倍数,为100;
θ——乳液中大豆油的体积分数,为0.25;
L——比色皿的路径长度,为1 cm;
C——样品的质量浓度,g/mL。
1.3.5 剪切黏度的测定 采用配备40 mm平板的流变仪对贮藏1 d和4 d的RGFAs样品进行剪切黏度测试。设定模式为对数扫描;温度为25 ℃;剪切速率范围为0.1~100 s-1;平衡时间为30 s。
1.3.6 RGFAs-小麦淀粉混合物的糊化特性分析 将制备的RGFAs液体样品(1,4 d)进行冷冻干燥得到固体样品。参考Sun等[13]的方法并稍作修改,固定样品的总质量为3.0 g,小麦淀粉与RG或RGFAs的质量比为5∶1,再加入25 mL水,使得混合物的水分基为14%,用快速黏度仪进行测试。设置淀粉糊化程序为:50 ℃维持10 s,接着以26 ℃/min的速度升温至95 ℃,维持3.5 min后,以12 ℃/min的速度降至50 ℃。
1.3.7 RGFAs-淀粉混合物中淀粉水解率的测定 参照文献[8]并进行适当修改。制备含0.2 g/100 mL淀粉与0.8 g/100 mL RG或RGFAs的混合液,以纯淀粉为对照组。溶液用NaOH(0.1 mol/L)调节pH至7.0,于95 ℃水浴锅中糊化20 min后立即冰浴冷却,再调节pH至1.5。向每个样品消化瓶中加入3 mL含15 mg/mL胃蛋白酶的HCl-KCl缓冲液(pH 1.5),恒温摇床消化1 h(37 ℃,150 r/min),95 ℃水浴1 min使酶失活,立即冰水冷却。用NaOH(0.1,1.0 mol/L)调节pH至6.8,向每个样品消化瓶中加入5 mL含5 mg/mLα-淀粉酶的KH2PO4—NaOH(pH 6.8)缓冲液和0.1 mL转苷酶,37 ℃消化0,20,50,70,90,120,150,180 min后用95 ℃水浴加热1 min灭酶,冰水冷却。取10 μL样品与1 000 μL葡萄糖试剂盒溶液混合,37 ℃水浴反应10 min 后,测定505 nm处的吸光度。按式(3)计算淀粉水解率。
(3)
式中:
H——淀粉水解率,%;
A0——样品管吸光度;
A1——标准管吸光度;
C——样品中总淀粉含量,mg/mL;
5.55——标准液浓度,mmoL/L;
18——葡萄糖单位换算系数;
0.9——被消化的淀粉含量换算系数。
1.4 数据统计和分析
所有的试验均至少进行3次重复,每次试验均有3个以上的平行样。采用SPSS软件的Duncan对表面疏水性、糊化参数进行显著性差异分析(P<0.05),采用Origin 2021及Excel 2010作图。
2 结果与分析
2.1 贮藏时间对RGFAs表面疏水性的影响
研究表明,蛋白质在自组装纤维化的初期先发生水解,使得包埋在核内的疏水基团暴露在蛋白质表面[14],从而增加与蛋白质分子接触的机会并促进蛋白质纤维化[15]。
RGFAs样品在贮藏1 d和4 d后的表面疏水性如图1 所示。贮藏1 d后,RGFAs样品的表面疏水性随加热时间(2~10 h)的延长显著降低,表明在自组装纤维化的过程中,暴露在蛋白质表面的疏水基团相互作用促进纤维聚集体的形成。Wei等[14]研究发现,卵转铁蛋白在自组装纤维化的过程中,当加热时间超过3 h后,卵铁蛋白表面疏水性逐渐下降,而纤维的数量相应地增多。
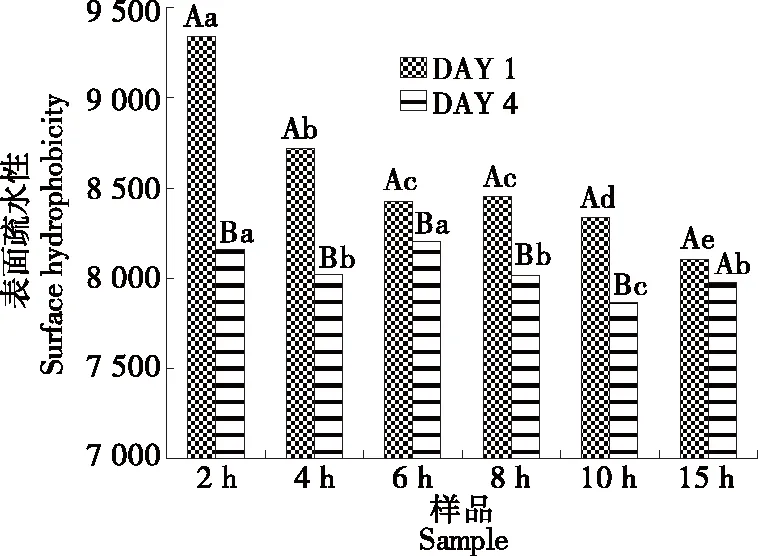
DAY1代表贮藏天数为1 d,DAY4代表贮藏天数为4 d;小写字母表示贮藏天数相同加热时间不同的样品的差异性,大写字母表示加热时间相同贮藏天数不同的样品的差异性,字母不同表示有显著性差异(P<0.05)
在经过4 d的贮藏后, RGFAs样品的表面疏水性随加热时间延长(2~10 h)显著下降,表明加热2~10 h形成的RGFAs在低温酸性条件下贮藏时,通过疏水相互作用促进蛋白纤维结构的伸长和成熟。而加热15 h后的RGFAs样品(简写为15 h-RGFAs)的表面疏水性在贮藏前后无显著差异,课题组前期通过透射电镜观察到贮藏4 d 的15 h-RGFAs的纤维结构发生断裂,Wang等[5]通过原子力显微镜也观察到在贮藏7 d后,大豆分离蛋白纤维中呈树枝状的纤维缩短或断裂,说明15 h-RGFAs样品在贮藏过程中纤维结构的降解可能与氢键断裂有关[16],而非疏水相互作用造成。
将米谷蛋白在高温(65~95 ℃)下处理时,由于蛋白质结构逐渐展开,其表面疏水性以近似线性的方式显著提高[17],说明米谷蛋白本身富含疏水性氨基酸。结合研究中RGFAs贮藏1 d和4 d的表面疏水值可知,在RGFAs的形成过程中,除了形成蛋白质纤维聚集体β-折叠结构的主要作用力氢键以外[18],疏水相互作用也发挥着重要的作用;RGFAs表面亲水、疏水基团的分布会影响其与其他物质间的相互作用。
2.2 贮藏时间对RGFAs乳化性的影响
研究[19]表明,蛋白质原纤维具有各向异性,其乳化效果优于刚性的球状蛋白。由图2可知,在贮藏1 d的RGFAs样品中,4 h-RGFAs的乳化活性值最高,而后,随加热时间的延长,乳化活性值降低,这可能是由于4 h-RGFAs中存在较多短的纤维,而(6~15 h)-RGFAs样品中纤维的长度较长。相关研究[20-21]报道,与长的卵清蛋白纤维相比,短纤维的稳定界面具有更高的剪切模量,此外,短的纤维能减少损耗和桥接絮凝。而在贮藏4 d后,所有RGFAs样品的乳化活性值升高,这可能是由于纤维在贮藏的过程中,结构进一步发生演变,蛋白质的二级结构倾向于转化为β-折叠结构,使得纤维数量增多。
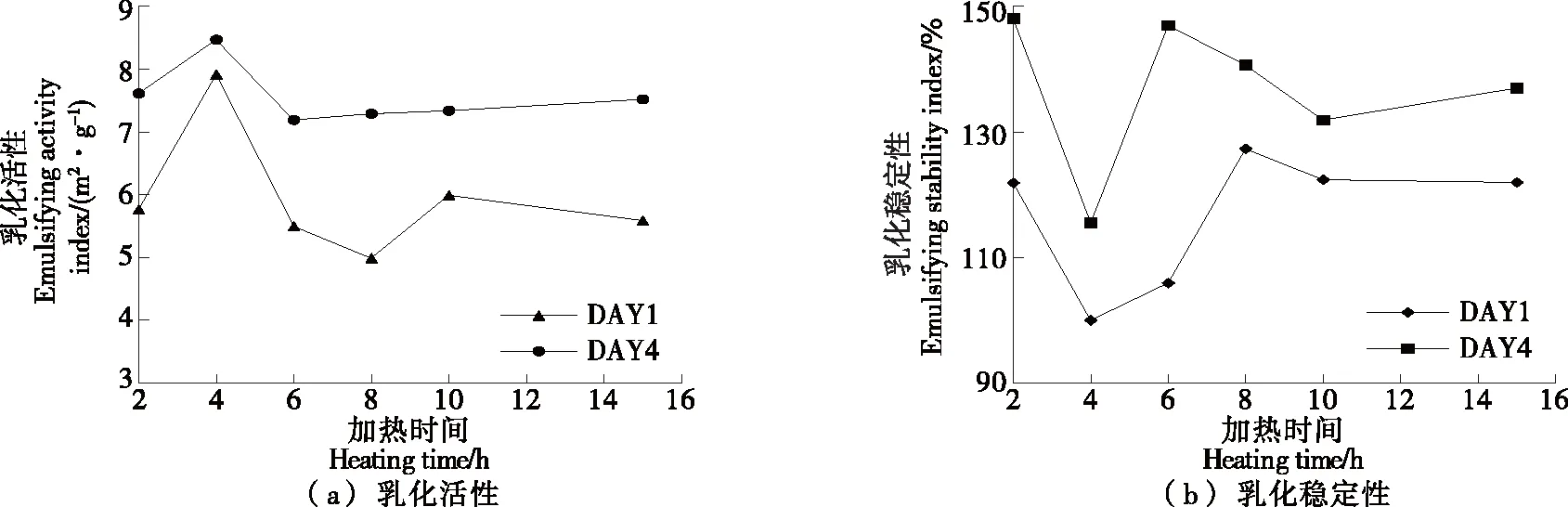
DAY1代表贮藏天数为1 d,DAY4代表贮藏天数为4 d
食品油/水界面的稳定性依赖于界面膜的强度,即黏弹模量[22]。由RGFAs样品稳定的乳液其稳定性呈先下降后上升的趋势,这可能是由于水解后的米谷蛋白、多肽及长的柔性纤维聚集体具有更高的界面吸附能,使得形成的乳液稳定性更好。纤维在贮藏4 d后,其乳化稳定性也有所提高。综上,米谷蛋白纤维聚集体在贮藏4 d后,其乳化活性及乳化稳定性均得到改善。
2.3 贮藏时间对RGFAs黏度的影响
由图3可知,随剪切速率的增大,所有RGFAs样品均呈现剪切变稀的特性,这可能是由于在加速剪切过程中,缠绕的蛋白质纤维逐渐与剪切流对齐并发生解离[23-24]。
如图3(a)所示,在低剪切速率范围内(0.1~1.0 s-1),RGFAs样品的剪切黏度呈小幅度上升而后下降的趋势,反映了原纤维与低剪切流保持对齐的过程[25],其中,15 h-RGFAs 样品的黏度变化最大,反映了其在剪切过程中,缠绕形成的网状结构受破坏的程度最大。在高剪切速率范围内,2 h-RGFAs样品的剪切黏度明显高于其他样品,这可能与其较大的流体动力学半径有关[26]。
如图3(b)所示,在剪切速率范围内(0.1~100 s-1),2 h-RGFAs样品的黏度值较高,这可能是由于贮藏4 d的2 h-RGFAs样品中仍有较大直径的颗粒存在,较大的流体动力学半径使得纤维样品表现出较大的剪切黏度; 15 h-RGFAs样品在贮藏4 d后黏度大幅降低,这可能与其纤维结构发生解离和断裂,网状结构被破坏有关[8]。

图3 贮藏1 d和4 d的米谷蛋白纤维聚集体的剪切黏度
2.4 RGFAs对小麦淀粉糊化特性的影响
根据Li等[8]的研究发现,热处理2 h和6 h所产生的米谷蛋白纤维聚集体的结构及对大米淀粉的消化抑制作用具有显著性的差别,因此,以热处理2 h和6 h的RGFAs样品为研究对象,揭示贮藏时间(1,4 d)对米谷蛋白纤维聚集体抑制小麦淀粉消化性能的影响机制。
将RG或RGFAs和小麦淀粉混合加热,利用快速黏度分析仪观察混合体系中小麦淀粉糊化特性的变化,加热过程中淀粉糊化参数反映了淀粉悬浮液在升温、高温保持和冷却过程中黏度的变化,本质上反映了淀粉晶体和非晶态淀粉分子间的氢键断裂,可以一定程度上揭示RG或RGFAs和小麦淀粉间的相互作用[27]。
淀粉的黏度与溶胀力、直链淀粉浸出含量及淀粉颗粒的破坏程度有关[28]。RG/RGFAs与小麦淀粉混合物的糊化特性测定结果如图4和表1所示,与纯小麦淀粉相比,添加RG或RGFAs的混合样品中淀粉的峰值黏度、崩解值、回升值均显著降低,糊化温度显著升高,这可能是由于RG/RGFAs与小麦淀粉的相互作用抑制了淀粉的糊化,降低了直链淀粉的浸出率,同时淀粉的热稳定性增加[29],导致蛋白—淀粉混合体系的吸热峰向更高的温度移动[30],也可能是由于蛋白质与淀粉的相互作用促进了新的氢键、疏水和静电相互作用形成,在糊化的过程中破坏新形成的键和相互作用需要更多的能量[31];回升值的显著降低代表RG/RGFAs可以使淀粉的老化受到抑制或延缓[32],说明淀粉分子的重排因RG或RGFAs的空间位阻作用而受到抑制。
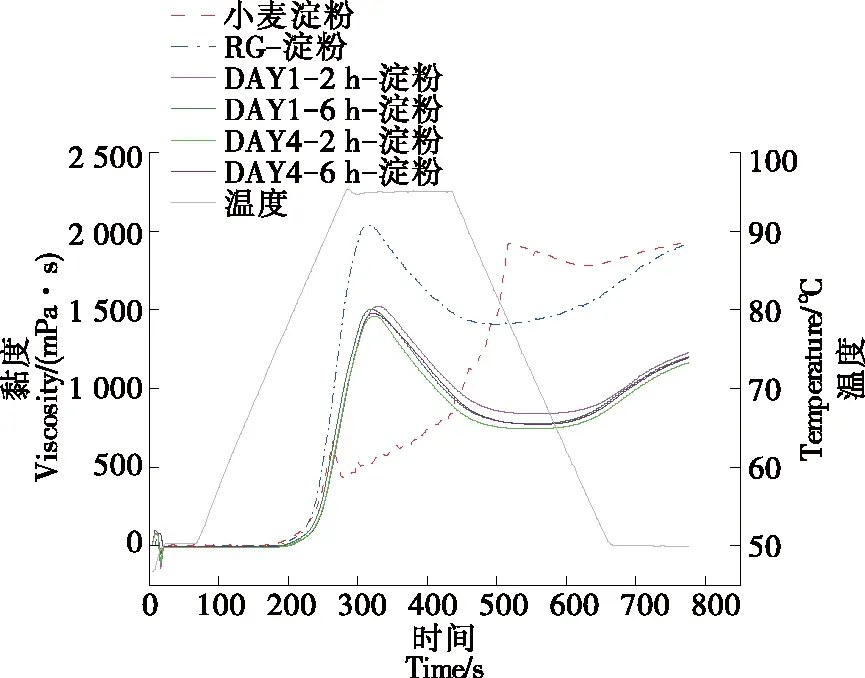
图4 RG/RGFAs-小麦淀粉混合物的糊化曲线
与添加RG的混合物相比,RGFAs对淀粉的糊化抑制现象更加明显,具体表现为峰值黏度由(1 998.00±40.15) mPa·s降至(1 462.00±11.14)~(1 513.00±8.19) mPa·s;糊化温度由(82.57±0.51) ℃升至(83.98±0.08)~(85.62±0.80) ℃(P<0.05),这可能是由于纤维聚集体具有极端长径比,对淀粉颗粒的物理屏障作用加强[8];也可能是蛋白纤维聚集体表面积增加,与淀粉颗粒基质作用的官能团增加,形成氢键、静电和疏水相互作用,从而阻碍了淀粉的吸水膨胀和糊化。
对比贮藏1 d和4 d后的2 h-RGFAs,6 h-RGFAs样品对小麦淀粉糊化参数影响发现,不管是贮藏1 d还是4 d,6 h-RGFAs样品与淀粉混合体系的峰值黏度和最终黏度均显著降低,表明6 h-RGFAs较大的长径比抑制了淀粉的糊化。根据Xu等[33]的研究结果:蛋白质与直链淀粉混合体系的结合力主要来源于疏水相互作用,已知贮藏1 d的2 h-RGFAs样品具有最大的疏水值,理应与直链淀粉的相互作用最强,从而降低淀粉中直链淀粉的浸出率,提高淀粉热稳定性和增加其糊化温度,但由表1可知,贮藏1 d的2 h-淀粉组显示出最低的淀粉糊化温度(P<0.05),可能是因为糊化过程与纤维样品的结构、纤维与淀粉结合的相互作用力的类别及强度、竞争水分的机制不同有关。
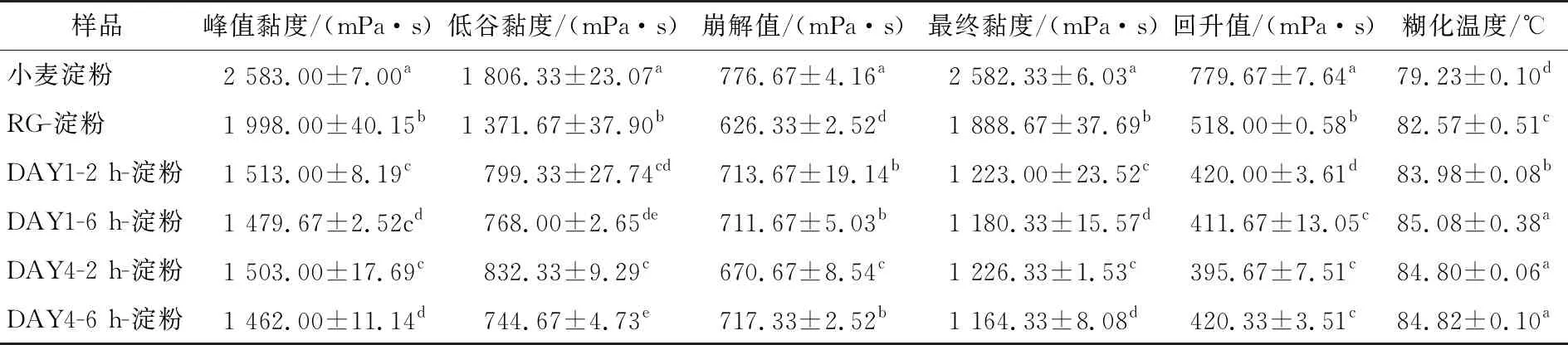
表1 贮藏1 d和4 d的米谷蛋白纤维聚集体—小麦淀粉混合物的糊化特性参数†
2.5 RGFAs-淀粉混合物的消化水解率
由图5可知,纯淀粉经体外模拟肠消化180 min后,其水解率为(94.32±1.36)%;添加了米谷蛋白或RGFAs的淀粉水解率明显降低,水解率为(77.37±1.11)%~(83.84±1.69)%,表明米谷蛋白及其纤维聚集体对淀粉的体外消化性具有抑制作用。在模拟体外消化过程中,蛋白质可作为物理屏障包裹淀粉颗粒[34];或屏蔽淀粉颗粒表面酶的吸附点,抑制淀粉酶的活性[35];或与酶结合,降低酶的催化作用[36]。
对比米谷蛋白,RGFAs对小麦淀粉水解的抑制效果更明显,这可能是由于蛋白纤维具有极端长径比,为小麦淀粉颗粒的结合提供了更多的蛋白质表面[1,8]从而减缓了淀粉的糊化,该推论与2.3得出的结论一致;也可能是因为纤维与淀粉之间的相互作用(物理和/或化学)在空间上阻断了α-淀粉酶对淀粉的水解作用。López-Barón等[37]指出,在蛋白质变性过程中,淀粉与蛋白质之间的疏水相互作用会加强,从而促进变性蛋白对糊化淀粉底物的包裹作用。纤维化本质上也是蛋白质的酸热变性过程,米谷蛋白在形成纤维聚集体后,包裹在内部的疏水基团暴露,促进与淀粉颗粒的疏水相互作用。
由图5可知,贮藏1 d的RGFAs的水解率低于贮藏4 d的纤维样品。由图1可知,贮藏1 d的2 h-和6 h-RGFAs样品的表面疏水性显著高于贮藏4 d的样品,表明疏水性的高低导致了蛋白质—淀粉相互作用的差异;疏水性差异也可能与蛋白纤维消化后的水解物对抑制酶活性的强弱有关,Chi等[38]发现大米蛋白酶解物的氨基酸配体与α-淀粉酶的催化残基通过氢键、静电相互作用和疏水相互作用结合来抑制α-淀粉酶的酶活。无论是贮藏1 d 还是4 d,2 h-RGFAs样品的水解率略小于6 h-RGFAs 样品的,这可能与2 h-RGFAs较高的黏度有关(图3),研究[34]报道,蛋白质的存在会干扰淀粉颗粒在糊化过程中的水流动性,此外,黏度较高的蛋白质纤维聚集体样品粘附在淀粉颗粒表面,使得淀粉酶难以和糊化淀粉接触,从而使得淀粉水解率下降[39]。
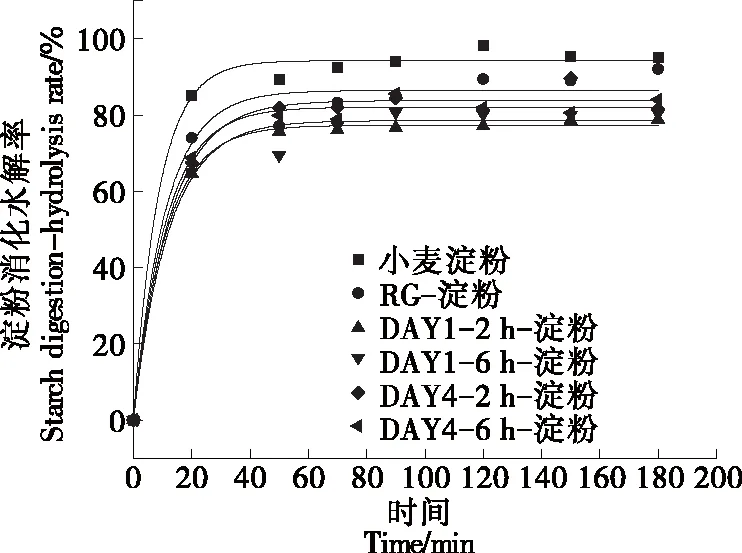
DAY1代表贮藏天数为1 d,DAY4代表贮藏天数为4 d
3 结论
米谷蛋白纤维聚集体在贮存过程中,暴露在样品表面的疏水基团通过疏水相互作用促进纤维聚集体的生长和成熟;加热15 h的米谷蛋白纤维聚集体样品的表面疏水性无显著变化,但剪切黏度降低。在抑制小麦淀粉糊化和水解特性方面,米谷蛋白纤维聚集体的表现优于米谷蛋白的效果,并且贮藏1 d的米谷蛋白纤维聚集体样品抑制小麦淀粉糊化的效果更好。米谷蛋白纤维聚集体的形状、表面疏水性、粒径和黏度等在贮存过程中的变化可能影响了其与淀粉的相互作用和淀粉酶与底物的可接触性,然而,米谷蛋白纤维聚集体抑制淀粉水解的机制有待进一步研究。
